氢化铝钠的制备方法及应用浅析
2012-02-09李永青
李永青
(惠生工程(中国)有限公司河南化工设计院分公司,河南郑州 450046)
还原反应是一类基本的化学反应。在有机合成工业中,还原剂可以是多种多样的,但是最理想的是络合金属氢化物。因为这一类还原剂能够溶于某些有机溶剂,使还原反应在均相体系中于常温常压下进行,因而使许多冗长而复杂的工艺变得迅速和简单。
常用的络合金属氢化物有氢化铝锂(LiAlH4)、氢化铝钠(NaAlH4)、硼氢化钾(KBH4)、硼氢化钠(NaBH4)等。氢化铝锂是一种几乎能还原所有有机官能团的极强还原剂,它与许多还原剂和氢化剂不同,只在特殊条件下才能使 C=C双键氢化,不会发生副反应,也不会引起裂解和缩合。但它的价格较贵,这是由于锂的价格高引起的,因此限制了它在一般化学工业中的广泛应用;硼氢化钠和硼氢化钾虽有价格低和能在碱性溶液中使用等优点,但是它对某些较复杂的官能团不能起有效的还原作用;氢化铝钠是最具希望得到广泛应用的络合金属氢化物还原剂,因为它具有与氢化铝锂十分相似的还原性能,且它以廉价的钠代替了昂贵稀缺的锂,使生产成本降低。但由于其合成比氢化铝锂较困难,致使目前还未进行规模化生产。
1 NaAlH4概述
1.1 络合金属氢化物
在一些离子型氢化物中,例如LiH等,由于H-的电荷少而半径大,离子型氢化物能在非极性溶剂中同 B3+、Al3+、Ga3+,形成络合金属氢化物,例如NaBH4、LiBH4等。络合金属氢化物都是极强的还原剂,在干燥的空气中比较稳定,遇质子溶剂则发生猛烈的反应。常见的络合金属氢化物还有氢化铝钠(NaAlH4)、氢化铝钾(KAlH4)等。对于这些络合氢化物的研究主要集中在储氢性能上。
1.2 氢化铝钠的性质
氢化铝钠(NaAlH4)是正四面体的空间结构,其中Na+作为平衡阳离子,AlH-4为络合离子体,Al位于四面体的中心,而H-则位于正四面体的顶点上[1]。它是白色晶状固体,在常温干燥的情况下能够稳定存在,熔点185℃,加热至185℃时融化同时有氢气放出。易溶于四氢呋喃和乙二醇二甲醚类二甲基溶剂中,不溶于甲苯和乙醚。遇氧化剂、酸或水剧烈反应,甚至有爆炸的危险。应密封保存或在惰性氛围下保存。
2 氢化铝钠的制备方法
自1951 年 Schlessinger和 Fenholt等[2]利用 Al-Br3和NaH并以二甲醚为溶剂制备NaAlH4以来,氢化铝钠就因为其优秀的还原性能受到众多学者的关注。目前众多文献关于氢化铝钠的合成报告中主要有复合法、单质直接合成法和固相球磨法等。下面就对这几种方法进行简单的阐述。
2.1 复合法
复合法主要是利用NaH和卤化铝在四氢呋喃或醚类溶剂中合成出NaAlH4的原理。
1955年Finholt等[3]沿袭LiAlH4在常温常压条件下的合成方法,在四氢呋喃溶剂(THF)中钠和氢气进行反应制备NaH;再在惰性氛围中,将三氯化铝的THF溶液滴加到NaH的THF溶液中,回流反应来制得NaAlH4,该方法一方面要求原料的纯度相当高,另一方面反应过程中NaH和AlCl3的反应速率较慢,反应生成的NaCl易沉积在氢化钠表面,阻止了AlCl3和NaH的进一步反应,致使原料转化率较低。
1961年,前苏联的两位学者 Zakharkin和Gavrilenko[4]尝试着用有机金属化合物三乙基铝(Al(C2H5)3)作为催化剂,用NaH和AlCl3在醚类溶液中反应制备NaAlH4,反应结束经THF萃取提取产物NaAlH4,产率可达90%。反应方程式如下:
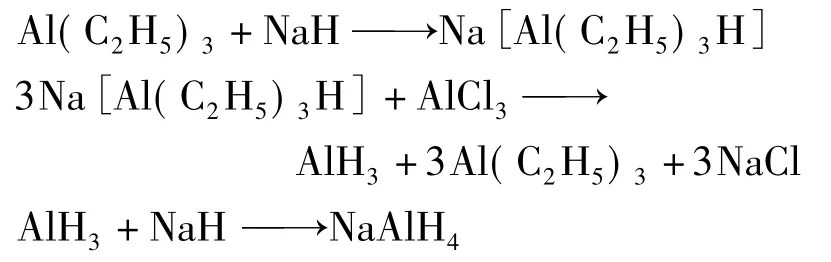
催化剂的引入大大促进了氢化铝钠制备的进展,给氢化铝钠的制备实现工业化带来了希望。
20世纪80年代,南开大学的申泮文院士在上述工艺的基础上进行了工艺优化[5],主要利用TiCl4作为催化剂使Na与H2反应生成高分散性、高活性、纳米级的NaH,再将其在常温下与AlCl3反应生成NaAlH4。采用这种方法合成NaAlH4可生成颗粒较大的NaCl,消除了复合法的反应阻断现象,副产物NaCl容易沉降,易于和产品NaAlH4分离。
2.2 球磨法
热压球磨法采用直接法以金属钠、金属铝、氢气为原料,在热压球磨机中反应生成NaAlH4,原料的利用率很高并且没有副产物。
1993年,俄罗斯学者 Dymova[6]利用热压球磨NaH和AlH3制得氢化铝钠。
唐安江等[7]对低压球磨法(0.3 MPa)进行了一系列的研究,结果表明在低压条件下,反应很难进行,TiCl4催化剂的加入能够促进反应的进行,但是效果并不是很理想。一方面原料的纯度和活性影响了反应的进行,另一方面这个反应是体积减小的反应,较高压力有利于促进反应的进行。
但是因为球磨法对设备和工艺条件要求苛刻,故难以实现工业规模的生产。
2.3 直接法
球磨法和复合法适宜于在实验室合成氢化铝钠,而工业化的生产只有直接法能够实现。利用此种方法合成的氢化铝钠大多作为生产多晶硅所用的中间产品来和SiF4反应制备高纯硅烷。利用铝粉、液态钠、氢气在一定温度(130~170℃)、一定压力(13~18 MPa)下在高压反应容器内直接合成:
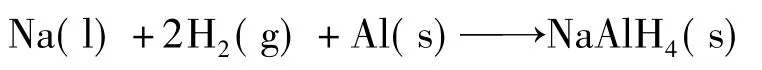
流程图如下:

图1 工艺流程示意图
反应在甲苯溶剂中进行,因为氢化铝钠不溶解于甲苯,所以制备出来的氢化铝钠固体颗粒可通过沉降过滤与溶剂分离,然后可通过加入乙二醇二甲醚类溶剂,使氢化铝钠溶解在乙二醇二甲醚中,和反应时过量的铝粉进行分离,得到纯度很高的氢化铝钠的乙二醇二甲醚溶液。反应的转化率很高。即便如此也需要用三乙基铝(TEA)作为反应的催化剂来提高反应速率。否则反应速率很慢。
3 氢化铝钠的应用
3.1 多晶硅制备中的还原剂
直接法制备出来的氢化铝钠大部分被用作硅烷法多晶硅生产中的还原剂,还原制备[8]。
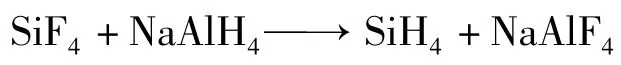
NaAlH4被稀释成一定浓度的乙二醇二甲醚(DME)溶液,经过逆流反应和逆流而上的SiF4气体反应,生成的SiH4从上部引出,副产品NaAlF4留在DME溶剂中,经过一定的处理后,可以外售或者返回制备SiF4工段。采用硅烷法生产多晶硅的企业利用NaAlH4的优越还原性,将SiF4还原生成SiH4。
3.2 有机合成中的还原剂
由于NaAlH4能够将醛、酮、羧酸等还原为醇,将硝基还原为氨基,同时NaAlH4还能够溶解于某些二甲基醚类溶剂(如乙二醇二甲醚)中,使得还原反应在均相体系中常温常压进行。因此,在有机合成中被广泛应用。
3.3 储氢材料
面对能源日益枯竭的21世纪,氢能作为一种清洁、安全、高效、可持续的能源,无疑是最具有发展前景的能源之一。而储氢材料相应的也受到很多国家的青睐。NaAlH4属于金属络合氢化物,在常温下能够稳定存在,在185℃时熔融并分解产生H2,并且其含氢量高达7.4%。1997年,德国Max-Plank煤炭研究所的 Bogdanovic[9]发现用TiCl3作为催化剂能够显著降低NaAlH4的分解温度,提高分解速率。氢化铝钠的分解分为两步:
在未使用催化剂时第一步的分解温度在185~230℃间发生,第二步反应在260℃以上才能发生。加入钛类等催化剂后温度可显著的降低到100℃和180℃。并且(1)、(2)两步反应均是可逆反应,从此人们意识到NaAlH4作为储氢材料的巨大潜力。此后很多国家包括美国、日本的研究人员对氢化铝钠掺杂储氢性能进行了大量的研究,开启了储氢材料研究的新篇章。
总之,我国氢化物还原剂的生产目前还处于落后状态,许多产品都依赖进口。随着国民经济的不断发展,科学研究的开展以及具有特殊性能化学制品的生产,越来越迫切的要求供应各种氢化物还原剂,加大这些特殊试剂的研制和生产是具有重要意义的。在吸收国外先进技术的基础上再创新也是实现这类化学品国内化的必由之路。
[1]王国清,赵栋梁,张羊换,等.Na/Li络合铝氢化物储氢材料的研究进展[J].金属功能材料,2008,15(4):38-43.
[2]Schlessinger N I,Fenholt A E,U S Patent[P].2576311,1951.
[3]Finholt A E,Barbaras G D,Barbaras G K,et al.The preparation of sodium and calcium aluminium hydrides[J].J Inorgan Nuclear Chem,1955,1(4-5):317-325.
[4]Zakharkin L I,Gavrilenko V V.A simple method for the preparation of sodium and potassium aluminium hydrides[J].Bull Acad Sei SSSR,Div Chem Sci,1961,10(12):2105-2106.
[5]申泮文,车云霞.氢化铝钠的合成方法[P].CN:1051152,1991-05-08.
[6]Dymova T N,Aleksandrov D P,Konoplev V N,et al.Spontaneous and thermal decomposition of lithium tetrahydridoaluminate LiAlH4The promoting effect of mechanochemical action on the proeess[J].Russ J Coord Chem,1993,19(7):607.
[7]唐安江,蒋东海,陈虹锦,等.低压球磨法制备氢化铝钠的研究[J].四川化工,2012,3(14):15-18.
[8]Boone J E,Rouge B,RichardsD M.PIocess for preparation of silane[P].US:5075092.1991.12-24.
[9]Bogdanovie B,Sehwickard M.Ti-doped alkali metal aluminium hydrides as potential noval reversible hydrogen storage materials[J].J Alloys Compd,1997,253-254:1-9.
