缺血后低压灌注处理对兔脊髓缺血/再灌注损伤的保护及ERK传导通路在其中的作用
2012-02-08艾春雨江晓菁王俊科
艾春雨 江晓菁 马 虹 王俊科
(中国医科大学附属第一医院麻醉科,沈阳 110001)
截瘫是脊髓缺血/再灌注损伤后难以预测和最为严重的并发症之一[1]。近年来对脊髓缺血/再灌注损伤的研究越来越受到重视,目前已证实缺血后适应的研究在心、肝脏、肾脏、小肠、骨骼肌等许多器官均存在保护作用,但对脊髓缺血/再灌注损伤是否也有保护作用尚较少报道,其激发抗缺血保护的确切机制至今尚有待研究。丝裂原活化蛋白激酶(MAPKs)是一组细胞内广泛存在的丝/苏氨酸蛋白激酶,ERK是主要的 MAPK通路之一,在其介导的胞内信号转导、细胞分化、生长发育、神经元可塑性及多种生理病理过程中发挥重要作用,但其在脊髓缺血再灌注损伤中的作用还需进一步研究。本研究采用低压灌注缺血后处理模型,并于鞘内分别注射不同剂量的ERK1/2特异性阻断剂PD98059观察兔后肢运动功能,用 Western blot技术测定p-ERK1/2 及Bcl-2,Bax蛋白表达,探讨p-ERK1/2在缺血后处理中对脊髓缺血再灌注损伤的保护作用。
材料和方法
1.实 验动物
日本大耳白兔(体重在2-2.5kg之间),由中国医科大学实验动物中心提供。
2.试 剂药品与仪器
LY294002(santa,美国);Bcl-2/Bax多克隆抗体(即用型)(santa,美国);p-ERK多克隆抗体(即用型)(武汉博士德),聚偏二氟乙烯(PVDF)蛋白印迹膜(Bio-Rad,美国);乌拉坦氨基甲酸乙酯(乌拉坦)(上海化学试剂采购供应站);振荡水浴箱(GFL THERMOLAB,美 国 ),超 低 温 冰 箱 (SANYO MDF-Μ,日本),旋涡振荡器(VORTEX-2GENE,美国),水平板电泳系统(BIO-RAD Sμb-cell GT,美国),通用电泳仪(BIO-RAD PowerPac200,美国),自动电泳凝胶成像分析仪(Alphainnotech Chemi-Imager 5500,美国),ΜV-300型紫外分光光度计(Μnicam,美国),HEIDOLPH DIAX900型匀浆机(德国)。
3.动 物分组及模型制备
3.1 分组
84只日本大耳白兔随机分为7组,分别为C组(对照组)、PB组(缺血后处理组)、D、PD1、PD3、PD9、PD组,每组12只。C组不给予缺血后处理,PB组给予缺血后处理组,D、PD1、PD3、PD9组分别于腹主动脉开放前1min鞘内注射DMSO 20μl、PD98059 1μg(20μl)、PD98059 3μg(20μl)、PD98059 9μg(20μl)之后进行缺血后处理,PD 组腹主动脉开放前1min鞘内注射PD98059 3μg(20μl),之后不行缺血后处理。
3.2 动物模型制备
所有实验动物均术前12h禁食,可自由饮水。称重后耳缘静脉注射20%乌拉坦(1mg/kg)进行麻醉。连续监测心率,耳缘中动脉置管,测量近端动脉血压,股动脉置管检测远端血压,直肠内置入温度传感器,持续监测体温,应用电热毯维持直肠温度38.5±0.5°C。耳缘静脉插管,确保输液通路。术中持续输入复方乳酸钠4ml/kg/h。
脊髓缺血方法以及本实验室所采用的缺血后处理方法参照文献[2]。采用4F球囊充气导管置于左肾动脉下1cm水平,静脉注射肝素150mol/L/kg 5min后,阻断兔腹主动脉25min,以远端主动脉压力低于20mmHg为完全阻断的标准,再灌注开始10min球囊部分排空,将远端主动脉血压控制在45-55mmHg,10min后球囊完全开放。之后丝线缝合,回笼饲养。动物清醒后进行神经行为学评分。于再灌注1d行全身麻醉,取各组L3~5脊髓组织。
3.3 鞘内注射给药
第5、6腰椎间隙水平行蛛网膜下腔穿刺,将已经消毒的PE-10导管从L5~6插入7.0-8.0cm,至脊髓胸段以回抽到脑脊液作为穿刺成功的标志。缓慢抽出脑脊液后注入实验药物,注射后保持头高脚低体位1h。
4.指 标检测
4.1 神经行为学评分
采用改良Tarlov法[2]于术后24h对兔后肢运动功能进行评分。改良的Tarlov分级评分标准:0分,没有可觉察的后肢活动;1分,有可觉察的后肢活动;2分,后肢中等活动可站立;3分,后肢活动良好,可跳跃,但不正常;4分,后肢功能完全恢复。
4.2 Bcl-2、Bax、p-ERK蛋白表达
将取出的脊髓组织匀浆,分别裂解各组细胞,收集上清,测定蛋白质浓度,然后按每个电泳孔道加入50μg蛋白混合样品进行聚丙烯酰胺凝胶电泳,转膜。先后加入一抗(Bcl-2,Bax,p-ERK 多克隆抗体,稀释度为1:500)和二抗(羊抗兔单克隆抗体,稀释度为1:5000)进行杂交。应用图像分析软件分析各电泳条带的蛋白含量。
5.统 计学分析
数据以¯x±s表示。数据处理采用SPSS12.0统计学软件。组间比较采用单因素方差分析,均数间两两比较用SNK检验。后肢运动功能评分采用非参数秩和Kruskal-Wallis方法检验。
结 果
1.神 经运动功能评分 动物均于术后2h苏醒,脊髓缺血/再灌注后1d,3d,7d,28d,PB组Tarlov评分明显高于其它各组(图1)。
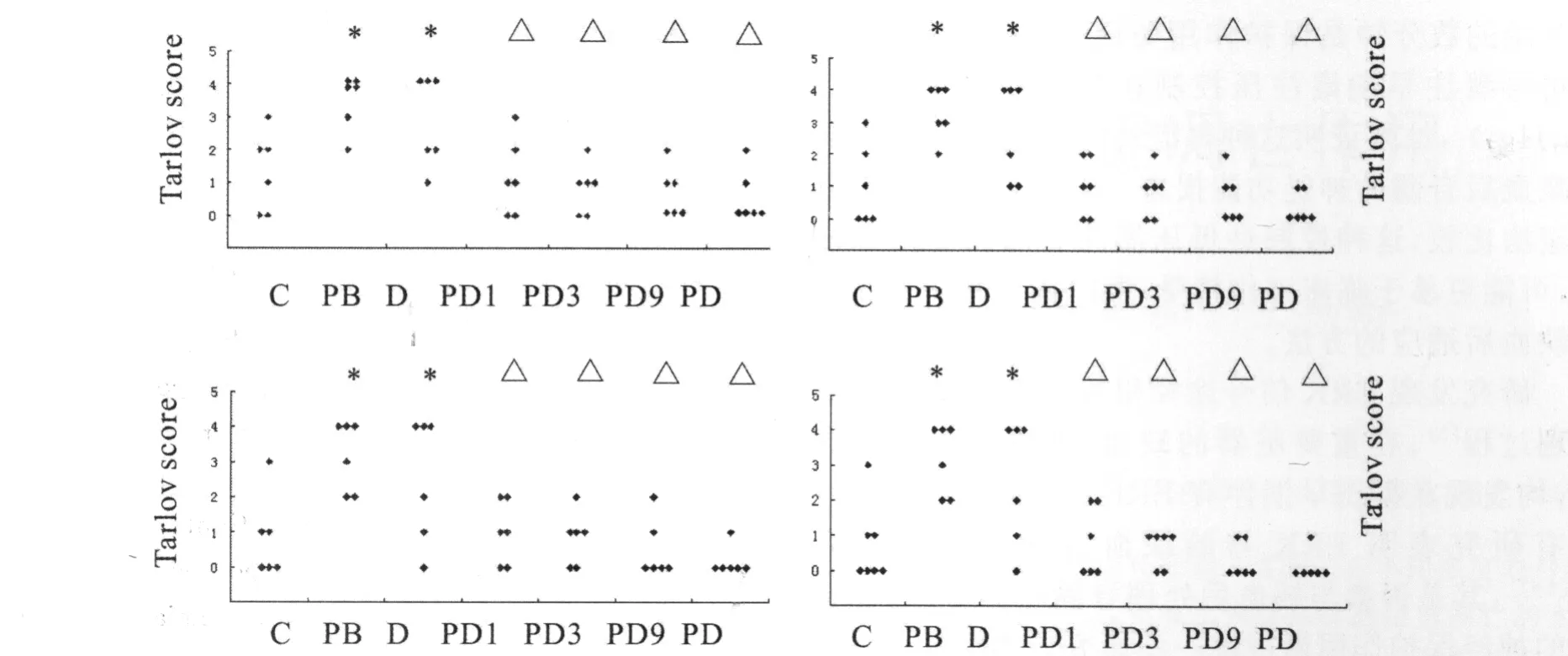
图1 脊髓缺血/再灌注损伤后1d,3d,7d,28dTarlov评分Fig.1Motor fμnction assessed with Tarlov score at 1day,3day,7day 28day after transient spinal cord ischemia.
2.B cl-2、Bax、p-ERK1/2蛋白表达
以GAPDH作为 Western blot蛋白质标准化的内参,将每个样品测得的蛋白条带的灰度值与本样品的GAPDH条带的灰度值相除,得到每个样品蛋白的相对含量。C、PD1、PD3、PD9、PD组的Bcl-2、p-ERK1/2表达与 PB 组相比有显著降低,Bax蛋白表达明显增高(图2,图3,图4)。
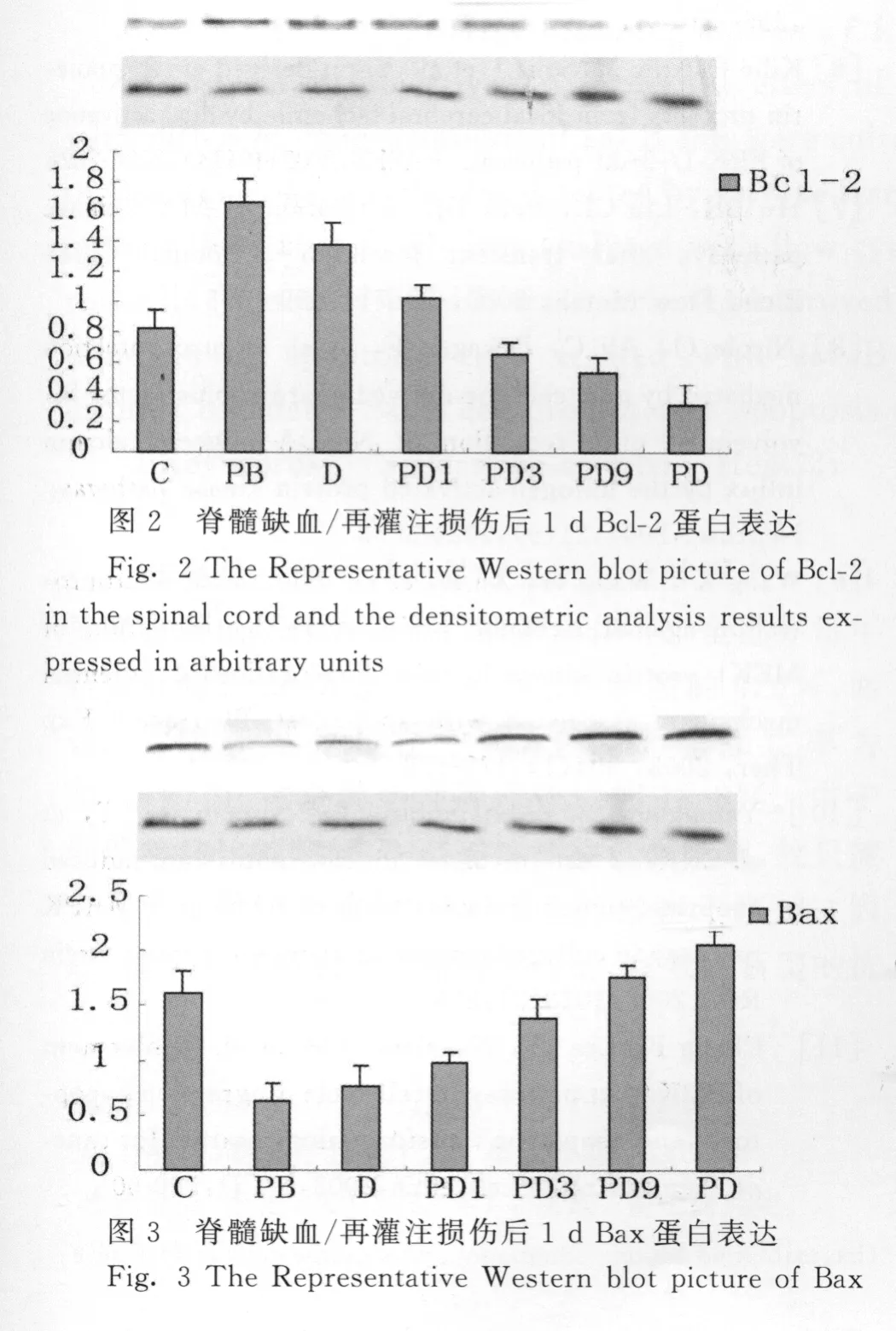
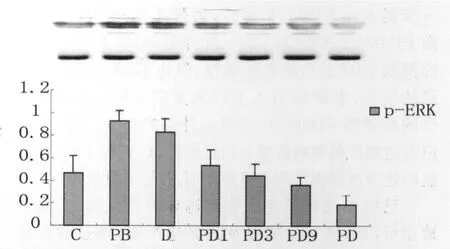
图4 脊髓缺血/再灌注损伤后1dp-ERK蛋白表达Fig.4The Representative Western blot picture of p-ERK in the spinal cord and the densitometric analysis resμlts expressed in arbitrary units
讨 论
本实验发现,低压灌注缺血后处理可以明显减轻脊髓缺血/再灌注的损伤,诱发ERK的磷酸化,而ERK途径抑制剂PD98059的应用,明显抑制了ERK磷酸化水平,加重细胞凋亡,脊髓损伤明显加重,抵消了后处理的保护作用,提示ERK途径在缺血后处理中发挥重要作用。
临床主动脉瘤、血管畸形手术以及心脏手术体外循环期间等,均可引发脊髓缺血再灌注损伤[3]。大量的动物实验和临床研究证实,由于脊髓血供少对缺血/再灌注损伤敏感,因此,寻找抗脊髓缺血/再灌注损伤的措施成为近年来外科领域的研究热点。缺血后处理是一种应用于再灌注早期的新的机械性干预措施,具有可预知性和可控制性的特点,其激发抗缺血保护的确切机制至今尚有待研究。已有报道经典缺血后适应方法的神经保护作用,并确定再灌注开始的数分钟是保护作用关键[4],在进一步研究中将再灌注早期灌注压控制在较低的水平(45-55 mmHg),结果证明这种再灌注方法也可以显著减轻缺血后脊髓的神经功能损害[2]。同经典的缺血后适应法比较,这种控制性低压灌注方法没有附加缺血,可能更易于临床工作接受,可以认为是一种改良的缺血后适应的方法。
研究发现ERK信号途径很可能参与了缺血后处理过程[5],在重要脏器的缺血/再灌注损伤研究中,均发现在损伤早期伴有ERK蛋白激酶的激活。另有研究表明ERK与脑缺血后神经元存活有关[6-9]],其是否参与缺血后处理脊髓缺血/再灌注损伤的神经保护作用尚待进一步研究。本实验Western blotting研究发现,C组脊髓组织 p-ERK1/2有少量表达,ERK1/2可能作为早期细胞内信号参与了细胞对这一应激反应的调节,因此p-ERK1/2活性增加可能是对缺血/再灌注损伤的修复。PB组进一步提高p-ERK1/2活性,增强了这一保护效果。而PD98059(ERK1/2的一种抑制剂)能够通过选择性抑制ERK1/2的激酶活性,阻止ERK1/2信号通路的活化,本研究引入不同剂量的ERK通路特异性的抑制剂PD98059,发现这种保护及p-ERK1/2蛋白表达随抑制剂剂量增加而逐渐降低,表明ERK在缺血后处理过程中发挥着重要作用,并呈剂量依赖性。
已知缺血再灌注损伤可诱导神经元凋亡,表明缺血可以激活一些基因及其表达产物,通过对促细胞凋亡基因和抑细胞凋亡基因的调控发挥着重要的作用。研究证实[10],ERK信号转导通路在细胞凋亡的过程中具有至关重要的作用,ERK激活后使细胞出现增殖、分化或凋亡。在细胞凋亡过程中Bcl-2家族成员是一类重要调节因子,Bcl-2的表达是决定细胞是否凋亡的关键[11]。在Bcl-2家族的调控中,Bcl-2增高抑制细胞凋亡。通过Bcl-2蛋白表达情况观察,C组兔脊髓Bcl-2蛋白表达水平下降,Bax表达增多,提示兔脊髓缺血/再灌注损伤神经细胞凋亡的发生与凋亡调控基因Bcl-2的表达异常有关,而PB组Bcl-2蛋白表达水平增多,说明缺血后处理对缺血再灌注损伤脊髓的保护作用部分是通过抑制神经细胞凋亡来实现的,其抗凋亡机制与上调Bcl-2的 表 达 有 关。而 加 用 ERK1/2 抑 制 剂PD98059后p-ERK1/2蛋白表达减少,凋亡抑制基因Bcl-2的表达明显下降,凋亡促进基因Bax明显升高。以上结果提示ERK通路激活亦可能参与了缺血后处理的抗凋亡及神经细胞的保护作用,该通路的失活直接导致脊髓细胞对缺血的耐受性降低。
本研究采用改良低灌注缺血后处理模型,其操作简单,损伤小。研究证实缺血后处理对脊髓缺血/再灌注的损伤具有保护作用,可能与其诱发ERK的磷酸化,参与缺血后处理的抗凋亡效应有关。至于ERK是通过什么通路调控凋亡相关基因的表达需要进一步研究。
[1]Feezor R J,Mart in T D,H ess P J J r,et al.Extent of aortic coverage and incidence spinal cord ischemia after thoracic endovascular aneurysm repair.Ann Thorac Surg,2008,86(6):1809-1814
[2]Shi E,Jiang X,Kazui T,et al.Controlled low-pressure perfusion at the beginning of reperfusion attenuates neurologic injury after spinal cord ischemia.Thorac Cardiovasc Surg,2007,133(4):942-948
[3]Svensson LG,Crawford ES,Hess KR,et al.Experience with 1509patients undergoing thoracoabdominal aortic operations.Vasc Surg,1993,17(2):357-370
[4]Jiang X,Shi E,Nakajima Y,et al.Postconditioning,a series of brief interruptions of early reperfusion,prevents neurologic injury after spinal cord ischemia.Ann Surg,2006,244(1):148-53
[5]Vinten-Johansen J,Zhao ZQ,Zatta AJ.Postconditioning-new link in nature's armor against myocardial ischemiareperfusion injury.Basic Res Cardiol,2005,100(4):295-310
[6]Kilie E,KilicΜ,Soliz J,et al.Brain-derived erythropoietin protects from focal cerebral ischemia by dual activation of ERK-1/-2Akt pathways.FASEB,2005,19(14):2026-2028
[7]Hu BR,Liu CL,Park DJ.Alteration of MAP kinase pathways after transient forebrain ischemic.Cereb Blood Flow Metab,2000,20(7):1089-1095
[8]Nicole O,Ali C,Docagne F,et al.Neμroprotection mediated by glial cell line-derived neμrotrophic factor Involvement of a redμction of NMDA-indμced calciμm inflμx by the mitogen-activated protein kinase pathway.Neμrosci,2001,21(9):3024-3033
[9]Wang X ,Wang H,Xu L,et al.Significant neuroprotection against ischemic brain injury by inhibition of MEK1protein kinase in mice Exploration of potential mechanism associated with apoptosis.Pharmacol Exp Ther,2003,304(1):172-178
[10] Yamagishi S, Matsumoto T, Numakawa T,et al.ERK1/2are involved in low potassium-induced apoptotic signaling downstream of ASK1-p38MAPK pathway in cultured cerebellar granule neurons.Brain Res,2005,1038(2):223-230
[11] Chang F,Lee JT,Navolanic PM,et al.Involvement of PI3K/Akt pathway in cell cycle progression,apoptosis,and neoplastic transformation:a target for cancer chemotherapy.Leukemia,2003,17(3):590-603
