大鼠PTSD后蓝斑核β-catenin的表达下降伴随细胞凋亡
2012-02-08闫胜男石玉秀
闫胜男 韩 芳 石玉秀
(中国医科大学基础医学院组织学与胚胎学教研室,病理与病理生理学研究所,沈阳110001)
创 伤 后 应 激 障 碍 (posttraumatic stress disorder,PTSD)是指人们经历过一次或多次的创伤性事件后所发生的一种严重精神反应,以创伤性事件的再体验、回避行为和警觉性高为主要症状[1]。蓝斑是应激反应的关键部位,直接参与了PTSD的发生[2,3]。目前有报道表明:PTSD患者存在蓝斑神经元数目减少的现象[4]。我们前期已经报道了蓝斑神经元的凋亡和杏仁核神经细胞凋亡的相关研究[5],那么凋亡由何原因所致?近来发现 Wnt通路与多条信号转导通路存在“对话”,参与多种细胞发育和细胞死亡的调节[6]。
Wnt信号途径是调控细胞生长增殖的关键途径,与神经系统的发生发展以及神经系统方面的疾病关系密切。Wnt信号途径可以通过多种机制来控制细胞的凋亡,Rhee等[7]研究发现,在一些细胞受损发生凋亡时,Wnt通路通过β-连环蛋白/Tcf的转录调节途径来调节细胞凋亡。Wnt通路也可以抑制线粒体释放细胞色素C从而抑制细胞凋亡[8]。β-catenin是 wnt途径中的关键因子。
因此,本文研究了PTSD大鼠蓝斑神经元β-catenin的表达,旨在为深入揭示PTSD的发病机制提供实验依据。
材料和方法
1.实 验动物及分组
成年健康雄性Wistar大鼠100只,重量150-180g(本学校实验动物中心提供),实验室条件饲养,随机分为5组,对照组、SPS后无干扰地静养1d、4d、7d和14d组,每组20只。
2.大 鼠模型的建立
采用2005年日本文部省召开的"基础和临床研究进展"国际会议确定的关于大鼠PTSD模型-SPS[9]。将大鼠连续进行下述步骤处理:禁锢2h;强迫性游泳20min(水深40cm,水温25℃);休息15min后乙醚麻醉,意识丧失后停止麻醉;无干扰常规喂养直至取材。
3.透 射电镜标本制备
动物常规麻醉,混合固定液(2.5%戊二醛和2%多聚甲醛的磷酸缓冲液)心脏灌流,取蓝斑,常规透射电镜制样(梯度酒精脱水,丙酮置换,EPON 812树脂浸透),定位倒扣包埋、聚合,半薄切片定位,超薄切片,透射电镜(JEOL1200EX)80kV下观察摄片。
4.免 疫组化标本制备
分别取SPS1d、4d、7d、14d及正常对照组大鼠进行灌流固定。大鼠经0.4%戊巴比妥腹腔注射麻醉后,暴露心脏,左心室插管,剪开右心耳,先以生理盐水300ml快速灌冲,再灌注4%多聚甲醛进行固定,取出脑组织,并浸入同种固定液中续固定3h,然后浸 Holt'S 液(40%蔗糖,0.01mol/L PBS配制)中至沉瓶底。于恒冷箱冰冻切片机中行冠状切片,片厚8μm,用于免疫组化染色。
5.β -catenin免疫组织化学SABC法染色
冰冻切片经吹干,依次用3%H2O2-DH2O10min、含0.03%TritonX-100的PBS漂洗10min×3,5%BSA封闭20min后,滴加鼠多克隆抗体β-catenin(工作浓度为 1:200,Santa Cruz Biotechnology)。0.01mol/L PBS 代替一抗作阴性对照,4℃ 孵育过夜,滴加生物素化羊抗鼠IgG 37℃、30min,滴加SABC 37℃、20min,以上各步间均用0.01mol/L PBS漂洗,之后DAB(武汉博士德公司)显色,常规脱水,透明,中性树胶封片。光学显微镜(OLYMPUS,BX60,Japan)下观察蓝斑的β-catenin的表达,摄片。
6.免 疫印迹法测定
脱颈法处死大鼠,冰上断头快速取出正常及SPS模型处理后1d、4d、7d、14d脑干组织,从Bregma线向后9.2-10.4mm确定脑干蓝斑位置[10],组织经匀浆、超声粉碎后高速低温离心,12000rmp/min,取上清;;采用考马斯亮蓝法定蛋白浓度为3mg/ml;每例标本提取蛋白5μg,10%SDS PAGE变性凝胶电泳,浓缩胶90v、30min和分离胶110v、120min;恒压转移到PVDF膜上,5%脱脂奶粉封闭60min;加入鼠多克隆抗体β-catenin(1:500,Santa Cruz)4℃孵育过夜、辣根过氧化物酶标记羊抗小鼠1:2000室温孵育1h,ECL显色。应用Image J分析软件分析上述结果,以目的条带与内参照GAPDH的平均灰度值的比值表示蛋白水平,进行半定量分析。
7.统 计学处理
所得数据使用SPSS 11.0统计软件。计量资料用平均数±标准差(¯x±s)表示,进行方差分析和t检验,P<0.05为差异有显著性。
结 果
1.透 射电镜观察
SPS刺激后,部分神经元出现细胞凋亡的改变。细胞核变形,核膜下陷,异染色质边集,继之出现明显的皱褶,细胞核裂解,胞质内出现多数的小泡,细胞膜渐消失(图1)。
2.β -catenin免疫组化结果
在正常对组(图2)β-catenin免疫组化染色阳性信号为棕黄色,表达在细胞质内。模型组SPS刺激后,在SPS 1d、4d(图3)、7d、14d组(图4)βcatenin的表达出现逐渐下调的趋势。经计算机图像分析系统分析和统计后,证实实验组和对照组有显著性差异(表1)。
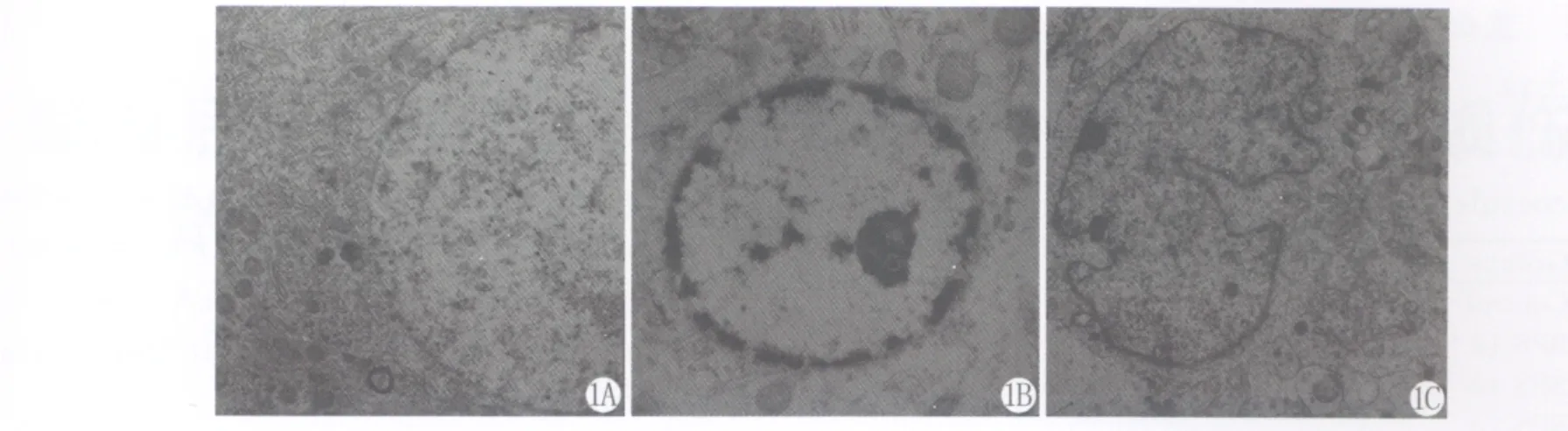
图1 A 透射电镜观察正常对照组神经元。×5000图1B 透射电镜观察,模型组神经元核内染色质固缩于核膜下、边缘聚集。×5000图1C 透射电镜观察,模型组神经元细胞核变形,核膜下陷。×5000Fig.1A Normal control neuron using transmission electron microscopy.×5000Fig.1B Chromatin coacervation and chromatin gathered along the inside of the nuclear membrane,using transmission electron microscopy.×5000Fig.1C Nucleus deformation and nuclear membrane introcession,using transmission electron microscopy.×5000
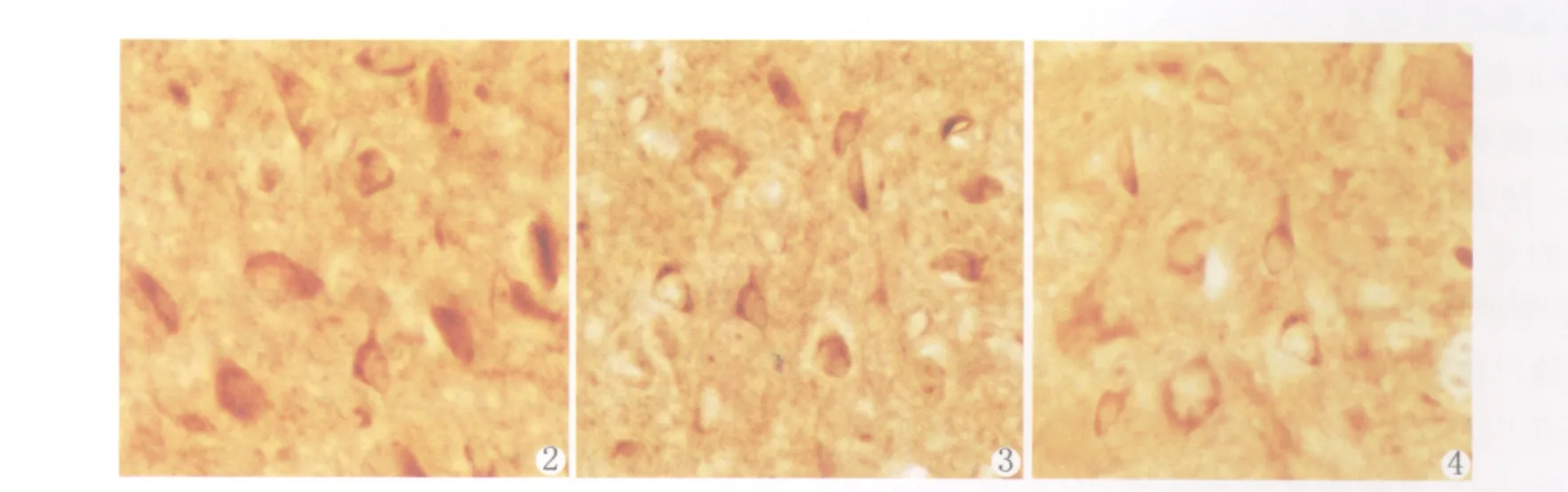
图2 正常对照组β-catenin免疫反应阳性细胞。×400图3 SPS-4d组β-catenin免疫反应阳性细胞。×400图4 SPS-14d组β-catenin免疫反应阳性细胞。×400Fig.2 Immunoreaction ofβ-catenin in rat locus coeruleus of control group.× 400Fig.3 Immunoreaction ofβ-catenin in rat locus coeruleus of SPS 4dgroup.× 400Fig.4 Immunoreaction ofβ-catenin in rat locus coeruleus of SPS 14dgroup.×400
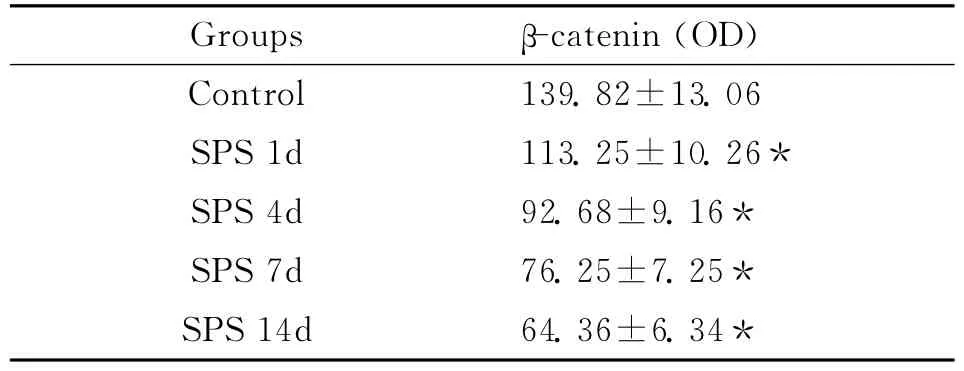
表1 蓝斑神经元β-catenin在对照组和模型组的平均灰度值(¯x±s)Table 1 The locus coeruleus neuronsβ-catenin expression in the model group and control group(OD)(¯x±s)
3.Western blotting结果
采用免疫印迹法检测β-catenin,以GAPDH的吸光度值作为内参照,对各组条带的吸光度值进行校正和半定量分析。与正常对照组相比,模型组蓝斑β-catenin蛋白水平变化明显:SPS刺激后1d后表达开始逐渐下降,14d表达最低(图5),分析结果见表2。
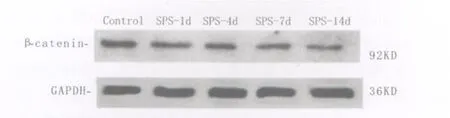
图5 模型组和对照组β-catenin蛋白的免疫印迹分析Fig.5Western blot analysis ofβ-catenin proteinin the model group and cont rol group
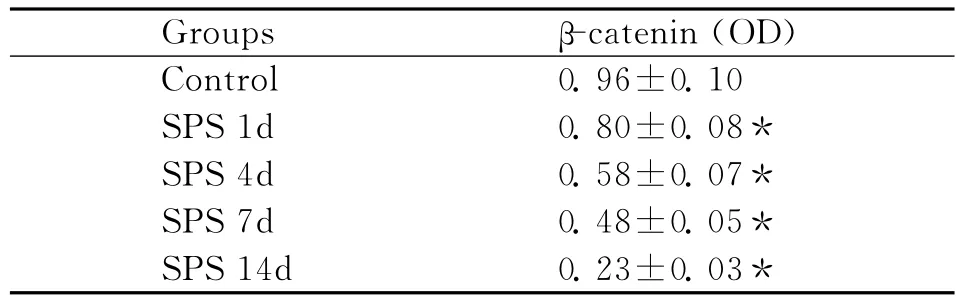
表2 蓝斑β-catenin的平均灰度值(Western blot)(¯x±s)Table 2 The average gray value ofβ-catenin in locus coeruleus(Western bot)
讨 论
创伤后应激障碍(PTSD)是以创伤性事件为主要致病因素,主要包括创伤性事件的再体验、回避行为和警觉性增高,涉及到多个精神生物系统的紊乱[11]。蓝斑是机体产生去甲肾上腺素的关键部位,在应激状态下,蓝斑内去甲肾上腺素神经元迅速激活,使去甲肾上腺素合成增多,以适应机体内外环境的变化。由此可见蓝斑的功能变化在PT SD的发生中有重要作用。目前对发生PTSD的退伍军人的尸体解剖中发现,蓝斑神经元数目减少,并有报道[12],PTSD蓝斑神经元存在凋亡。细胞凋亡(apoptosis),又称程序性细胞死亡(programmed cell death),是指细胞为维持内环境稳定,由基因活动指导下的主动性死亡。近来发现 Wnt通路与多条信号转导通路存在“对话”,参与多种细胞发育和细胞死亡的调节[6]。近几年的研究表明,该通路具有调控多种细胞发育的性质和防止细胞凋亡损伤的潜能,特别是在不同影响因素下可以促进或抑制细胞早期或晚期凋亡损伤,包括神经细胞、内皮细胞、血管平滑肌细胞、心肌细胞等。β-catenin在 Wnt信号途径和细胞黏附连接中发挥关键作用。Wu等[13]在研究中发现,β-catenin发生降解,可促进细胞凋亡。当凋亡刺激因子抑制Wnt信号途径,使β-catenin下调,进而促使细胞凋亡。该实验通过免疫组化观察PTSD大鼠蓝斑β-catenin的定位表达,通过Western Blot检测进行定量分析,结果显示,βcatenin表达在SPS刺激后出现逐渐下调的趋势,并且,通过电镜发现,模型组PTSD大鼠蓝斑神经元出现了细胞凋亡的改变。实验表明PTSD大鼠蓝斑 β-catenin 表 达 发 生 变 化, 提 示 β-catenin 与PTSD大鼠蓝斑的细胞凋亡有密切关系,为揭示PTSD的凋亡机制提供了实验依据。并为进一步探讨有效干预蓝斑神经元细胞凋亡,有望寻找治疗PTSD新药靶点提供新思路。
[1]Lei Zhang,Rulun Zhou,Xiaoxia Li,et al.Steess-induced change of mitochondria embrane potential regulated by genomicnd nongenomic GR signaling:A possible echanism for hippocampus atrophy in PTSD.Medical Hypotheses,2006,66:1205-1208
[2]Vanitallie TB.Stress:a risk factor for serious illness.Metabolism,2002,51(6):40-45
[3]Xu G P,Van-Bockstaele E,Reyes B,et al.Chronic morphine sensitizes the brain norepinephrine system to corticotrophin-relsasing factor and stress.J Neurosci,2004,24(38):8193-8197
[4]Li A,Nattie E.Catecholamine neurons in rats modulate sleep,breathing central chemoreception and bresthing variability.J Physiol,2006,570(2):385-396
[5]肖冰,韩芳,石玉秀.PTSD样情感行为异常大鼠杏仁核Caspase-9的改变.中国组织化学与细胞化学杂志,2010,19(1):6-10
[6]McManus EJ,Sakamoto K,Armit LJ,et al.Role that phos pho-rylation of GSK3p lays in insulin and Wnt signalling defined by knockin analysis.EMBO J,2005,24(8):1571-1583
[7]Rhee CS,Sen M,Lu D,et al.Wnt and frizzled receptors as potential targets for immunotherapy in head and neck squamous cell carcinomas.Oncogene,2002,21(43):6569-6605
[8]You Z.Saims D,Chen S,et al.Wnt signaling promotes oncogenic Transformation by inhibiting c-myc-induced apotosis.J Cell Biol,2002,157(3):429-440
[9]Liberzon I,Krstov M,Young EA.Stress-restress:effects on ACTH and fast feedback.Psychoneuroendocrinology,1997,22(6):443-453
[10]Andrel,Curtis,Luis A,et al.Long-Term Regulation of Locus Coeruleus Sensitivity to Corticotropin-Releasing Factor by Swim Stress.Pharmacology and experimentics,1999,3(289):1711-1719
[11]Grillon C,Southwick SM,Char ney DS.The psychobiolo gical basis of posttr aumatic stress disor der.M ol Psychiatry,1996,1(4):278-297
[12]李慢,韩芳,石玉秀.创伤后应激障碍大鼠蓝斑核神经元细胞凋亡的实验研究.中国组织化学与细胞化学杂志,2010,19(1):15-19
[13]Wu WB,Peng HC,Huang TF.Disintegrin cause p roteolysis of beta-catenin and apop tosis of endothelial cells.Involvement of cell-cell and cell-ECM interactions in regulating cell viability.Exp Cell Res,2003,286(1):115-127
