胃癌组织中幽门螺杆菌L型感染与淋巴管形成关系的研究
2012-02-08蔡兆根于东红吴海波冯振中
蔡兆根 于东红* 田 甜 吴海波 赵 艳 冯振中
(1蚌埠医学院第一附属医院临床病理科,蚌埠医学院病理学教研室,安徽省感染与免疫重点实验室,安徽233003;2南京金陵司法鉴定所,江苏210000;3安徽医科大学附属省立医院临床病理科,安徽230001)
国内外有关Hp感染与胃癌关系的研究较多,并已成定论,而Hp-L型感染与胃癌关系的研究较少,Hp-L型与胃癌的淋巴道转移之间的关系罕见报道[1]。肿瘤淋巴管新生在实体瘤(包括胃癌)淋巴结转移过程中起重要作用。D2-40和LYVE-1抗体是新发现的比较特异的淋巴管标志物,因能特异地与淋巴管内皮反应而被广泛地用于标记实体肿瘤组织中的淋巴管内皮。微淋巴管密度(lymphatic microvessel density LVD)是反映肿瘤淋巴管生成的有效指标。因此本研究应用免疫组化及革兰氏染色方法检测幽门螺杆菌L型感染的情况、LVD值及VEGFR-3蛋白的表达,旨在探讨胃癌组织中LVD、VEGFR-3蛋白表达和Hp-L型感染的关系。
材料和方法
1.标 本
收集2010年7月至2011年6月间,蚌埠医学院第一附属医院病理科存档的80例胃癌手术切除的石蜡标本及相关临床病例资料,从中随机取切缘组织25例(作为正常对照组)。所有标本均经HE染色切片组织学复查确认。患者术前未进行任何放化疗、生物学治疗及抗生素治疗。男58例,女22例;年龄36-73岁,中位年龄为51岁。淋巴结转移者63例,无转移者17例。
2.试 剂和方法
所有标本均经10%福尔马林固定,常规石蜡包埋、切片,厚4μm,分别行常规 HE染色、革兰染色和免疫组化染色SP法。用已知阳性的组织切片作为阳性对照,PBS代替一抗作为阴性对照,组织切片革兰染色按常规染色进行。浓缩型鼠抗人D2-40单克隆抗体(编号ZM-0465)和兔抗人VEGFR-3多克隆抗体(编号ZA-0267),购自北京中杉金桥公司;兔抗人LYVE-1多克隆抗体(编号 BS-1311R),购自北京博奥森生物技术有限公司;兔抗人Hp-L型抗体由蚌埠医学院微生物学教研室制备。
3.结 果判断
3.1 幽门螺杆菌L型的检测及结果判定
革兰染色阴性呈红色,阳性呈紫色,Hp-L型大多数呈革兰染色阴性,少数Hp-L型革兰染色阳性。Hp-L型形态多样,大小不等,有巨形体、圆球体、短杆状、长丝体等。在油镜(10×100)下观察并计数;每例随机观察8-10个不同视野,取平均数,L型菌数≥20个定为阳性,<20个或未查见L型则为阴性。Hp-L型抗体免疫组化的阳性标准为:胃癌细胞、正常胃黏膜上皮细胞及间质巨噬细胞的胞质或胞膜着棕黄色细颗粒为阳性。革兰染色和免疫组化两者同时阳性定为Hp-L型感染阳性。
3.2 免疫组化染色结果判定和淋巴管密度计算(LVD)
VEGFR-3在胃癌细胞中的表达定位于细胞质,阳性染色为棕黄色。D2-40、LYVE-1表达阳性均为淋巴管内皮细胞着棕黄色或者棕褐色。本实验以D2-40、LYVE-1标记同时阳性的淋巴管代表真正阳性的淋巴管并以此标准计算LVD值;计数淋巴管时先于低倍视野下确定3个淋巴管密集区域(热点),然后在40×10倍放大视野下记数,取3个区域高倍视野下淋巴管平均数作为肿瘤新生淋巴管密度值。
4.统 计学分析
微淋巴管密度以(¯x±s)表示,使用统计分析软件SPSS 15.0对实验数据进行χ2检验、t检验及Spearman等级相关性分析。以P<0.05认为有统计学意义。
结 果
1.H p-L型的分布特点及检测结果
观察革兰染色切片发现,Hp-L型大部分是革兰染色阴性,多数为圆球形,可在癌巢、癌间质或黏膜层聚集成堆,也可散在分布于其中,Hp-L型主要存在于胃癌癌巢和癌旁,癌巢的坏死处几乎无Hp-L型,正常组织内较少见。L型阳性的组织切片上均见到L型黏附于癌细胞及黏膜细胞表面的现象(图1)。80例胃癌中有54例革兰染色细菌阳性,阳性率为67.5%;免疫组化Hp-L型抗原表达阳性52例(见图2),阳性率为65%,与革兰染色L型检出阳性率具有一致性(P>0.05),两组同时阳性的病例有50例,阳性率为62.5%,明显高于对照组的24% (P<0.01)。
2.胃 癌组织中 D2-40、LYVE-1标记的微淋巴管形态特点和LVD值
D2-40、LYVE-1标记阳性的微淋巴管管壁薄无肌层,形态欠规则,腔内无红细胞。在胃癌癌周组织中微淋巴管数目较多且多为开放的管腔;而在胃癌组织中心区微淋巴管数量较少且多为细小腔隙或条形闭锁状;对照组微淋巴管分布稀疏且主要位于粘膜下层和外膜层(图3、4)。
本实验研究结果显示新生淋巴管主要位于癌周区,癌中心区相对较少,因此以癌周区的淋巴管数为主计算微淋巴管密度,结果显示,80例癌周组织中D2-40标记阳性的微淋巴管LVD值为27.34±4.61,LYVE-1标记阳性的微淋巴管LVD值为26.75±6.34,两者同时阳性的微淋巴管LVD值为25.48±5.87,两者阳性率具有一致性(P>0.05);与对照组相比具有统计学意义(P<0.01表1)。有淋巴结转移组LVD值为28.43±4.36,高于无淋巴结转移组的21.34±3.25(P<0.01)。

表1 胃癌癌周组织中D2-40、LYVE-1标记阳性微淋巴管的LVD值Table 1 The lymphatic microvessel desenity marked by D2-40、LYVE-1in peripheral gastric carcinoma
3.V EGFR-3蛋白的表达及与LVD值和Hp-L型之间的相互关系
VEGFR-3主要表达于癌细胞的胞质中,在间质纤维细胞及脉管内皮细胞的胞质中亦有表达(图5)。胃癌组织中VEGFR-3的阳性表达率44%(35/80),高于对照组的4%(1/25),差异具有统计学意义(P<0.01)。Hp-L型阳性组 VEGFR-3表达阳性率高于Hp-L型阴性组,差异具有统计学意义(P<0.05);VEGFR-3蛋白阳性组的LVD值为28.75±3.56,高于阴性组的21.45±5.16,差异具有统计学意义(P<0.05);两者之间的表达呈正相关关系(r=0.532,P<0.01)。Hp-L型阳性与 VEGFR-3蛋白表达和LVD呈正相关关系(r=0.300,P<0.05;r=0.804,P<0.01,表2)。
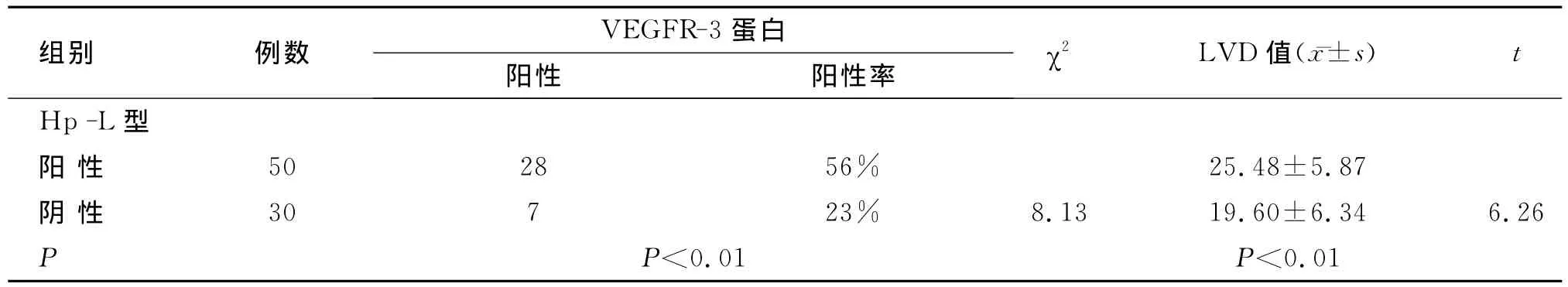
表2 胃癌组织中LVD值、VEGFR-3蛋白与Hp-L型之间的关系Table 2 Relationship between the expression of VEGF-C protein and the lymphatic microvessel density and helicobacter pylori L-form infection in gastric carcinoma
讨 论
淋巴管形成是肿瘤生长和转移的基础。以往对肿瘤淋巴管生成的研究因缺乏特异的淋巴管内皮细胞标记物而相对滞后于肿瘤新生血管的研究。D2-40是新近发现的一种分子质量为40kDa、能特异性标记肿瘤组织中淋巴管内皮的单克隆抗体[2]。已有研究证明,D2-40在前列腺癌、肾癌和胃癌[3]等多种肿瘤的微淋巴管内皮细胞上都有阳性表达。本研究结果显示由D2-40标记的微淋巴管具有一定的分布特点,在癌周组织中微淋巴管丰富且管腔较大,在癌中心区仅能见到少量的裂隙状或条索状微淋巴管结构,这与 U Coskun等[4]的结论基本一致。LYVE-1是较特异的淋巴管标记物之一,在肿瘤研究中经常作为重要标志蛋白来区分淋巴管和血管[5]。P Gao等[6]通过对63例胃癌研究发现LYVE-1在正常组织和癌组织的毛细淋巴管都呈阳性表达,而不表达于毛细血管及肿瘤细胞,并发现LYVE-1标记的LVD值与胃癌组织的大小及淋巴结转移具有相关关系。本研究结果与上述一致,并发现LYVE-1的表达与D2-40相类似。同时我们也发现LYVE-1染色切片中部分肿瘤细胞也有少量非特异性染色,并且主要在分化差的癌组织内观察到此种现象,其原因可能是LYVE-1为多克隆抗体,存在交叉反应所致,或是由于肿瘤自身具有形成淋巴管的趋势,具体原因还有待研究,但是其总体染色结果未受到明显影响。因此两种标记物联合使用更能客观的反应胃癌组织中的淋巴管新生情况,从而得到比较可靠的LVD值。
VEGFR-3作为 VEGF-C、-D的受体,除表达于脉管组织外,许多肿瘤细胞本身也有VEGFR-3的表达,并通过自分泌的作用机制在肿瘤进展过程中发挥重要作用[7]。已有证据表明,VEGFR-3可通过与其配体VEGF-C的结合,促进实体瘤内淋巴管的新生,并促进肿瘤细胞的淋巴结转移[8]。本实验结果显示,VEGFR-3在胃癌中的阳性表达率为44%,而对照组中仅有个别组织呈局灶表达。VEGFR-3的表达与LVD值呈正相关关系,说明VEGFR-3与胃癌淋巴管生成有关,并由此推测胃癌组织内淋巴管生成也可通过胃癌细胞内的VEGFR-3与VEGF-C结合刺激淋巴管的生成。本研究结果还显示,在肿瘤组织周围间质中,部分炎细胞及纤维细胞也可见VEGFR-3蛋白表达,但其作用机制不祥,有待进一步研究。有研究显示[9],在肿瘤淋巴管生成过程中,肿瘤组织间质中的炎性细胞也可能发挥了重要作用。
本实验结果还显示,胃癌组中Hp-L型阳性组的LVD值、VEGFR-3的表达阳性率高于 Hp-L型阴性组,且差异有显著性(P<0.05),说明 Hp-L型与胃癌的淋巴管形成有关,并提示Hp-L型可能是上调VEGFR-3的表达从而促进胃癌淋巴道转移的发生。其可能机制为:1.Hp-L型在体内长期存活造成宿主细胞慢性损伤引起慢性炎症[10]。炎症时炎细胞释放的多种炎症介质包括VEGF在内的一类血管生长因子可刺激血管内皮细胞和淋巴管内皮细胞的增生,诱导淋巴管生成,使组织内LVD增加。新生的淋巴管管壁通透性较大,加之内皮细胞分泌的一些蛋白酶类使肿瘤细胞容易进人微淋巴管而发生淋巴道转移。2.炎性渗出和组织水肿,加上大量增生的肿瘤细胞可造成局部组织缺氧,而低氧可以介导多种血管、淋巴管生长因子的表达增加,促进淋巴管生成,进而表现出LVD的增加[11]。
综上所述,Hp-L型感染在胃癌的淋巴管生成中具有重要作用,通过检测 Hp-L型、LYVE-1、D2-40以及VEGFR-3可有助于了解肿瘤的生物学行为及为临床治疗提供实验依据;以VEGFR-3为靶点的基因治疗具有新的应用前景。
[1]田甜,于东红.胃癌组织中D2-40标记的微淋巴管密度与幽门螺杆菌L型感染的关系研究.蚌埠医学院学报,2010,35(12):1214-1216,1219
[2]Arigami T,Natsugoe S,Uenosono Y,et al.Lymphatic invasion using D2-40monoclonal antibody and its relationgship to lymphnode micrometastasis in PNO gastric cancer.Bri Cancer,2005,93(6):688-693
[3]Takanami I.Lymphatic micro-vessel density using D2-40is associated with nodal metastasis in non-small cell lung cancer.Oncol Rep,2006,15(2):437-442
[4]U Coskun,N Akyurek,A Dursun,et al.Peritumoral lymphatic microvessel density associated with tumor progression and poor prognosis in gastric carcinoma.J Surg Res,Nov 2010,164(1):110-115
[5]李蕾,张翠萍,赵清喜,等.淋巴管内皮细胞透明质酸受体-1在胃癌组织中的表达及意义.世界华人消化杂志,2006,14(24):2421-2424
[6]P Gao,GY Zhou,QH Zhang,et al.Clinicopathological significance of peritumoral lymphatic vessel density in gastric carcinoma.Cancer Lett,2008,263(2):223-230
[7]JY Sung,S Lee,YW Kim,et al.Vascular endothelial growth factor receptor-3is a favorable prognostic factor in advanced gastric carcinoma.Oncol Rep,2008,19(4):939-944
[8]Kuwai T,Tanaka S,Oue N,et al.Vascular endothelial growth factor C stimulates progression of human gastric cancer via both autocrine and paracrine mechanisms.Clin Cancer Res,2008,14(22):7205-7214
[9]SY Wong,RO Hynes.Tumor lymphatic interactions in an activated stromal microenvironment.J Cell Biochem,2007(4),101:840-850
[10]佘菲菲.幽门螺杆菌的球形变异及其特征和意义.中国微生态学杂志,2001,13(5):299-303
[11]于东红,罗彦丽,王萍等.幽门螺杆菌L型感染与胃癌血管形成的关系.癌变.畸变.突变,2008,20(5):359-362
图 版 说 明
图1 Hp-L型在癌旁及癌内,主要呈圆球体(革兰染色 ×1000)
图2 Hp-L型在胃癌细胞内的表达(SP法×100)
图3 D2-40在胃癌癌旁间质淋巴管的表达(SP法×100)
图4 LYVE-1在胃癌内间质淋巴管的表达(SP法×100)
图5 VEGFR-3在胃癌内的表达(SP法×400)
EXPLANATION OF FIGURES
Fig.1Massive Hp-L in gastric carcinom(Grams staining×1000)
Fig.2Hp-L expressed in gastric carcinom(SP method×100)
Fig.3D2-40protein expressed in gastric carcinom (SP method×200)
Fig.4LYVE-1protein expressed in gastric carcinom (SP method×100)
Fig.5VEGFR-3protein expressed in gastric carcinom (SP method×400)

