大肠癌中STAT3和VEGF的表达及相关性研究
2012-02-08陆娜娜曹立宇
陆娜娜 尹 玉 李 昊 江 燕 曹立宇
(安徽医科大学病理学教研室,合肥230032)
大肠癌(colorectal carcinoma,CRC)是人类消化系统最常见的恶性肿瘤之一,在我国,由于饮食习惯和生活方式的改变,其发病率呈逐渐上升趋势。大肠癌的生长、侵袭及转移过程受到多种因素的影响,其中血管生成对肿瘤的生长起重要作用,是影响肿瘤生物行为的重要因素。肿瘤血管的形成受多种因子调节,其中最重要的是血管内皮细胞生长因子(vascular endotelial growth factor,VEGF),近来有报道VEGF直接由信号转导子与转录活化子3(signal transducers and activators of transcription,STAT3)蛋白调节,并已在肺癌、胃癌、乳腺癌等肿瘤 中 得 到 证 实[1-3]。 本 研 究 采 用 免 疫 组 化 S-P(streptavidin-eroxidase,链霉菌抗生物素-过氧化物酶)法检测大肠癌组织中STAT3和VEGF的表达,分析其在大肠癌发生、发展中的作用,以及两者间的关系。
材料和方法
1.标 本来源
收集安徽医科大学第一附属医院病理科2007年月-2008年月间住院大肠癌手术切除标本62例,所有病例术前均未接受放疗、化疗及其他针对肿瘤的特殊治疗,且术后经病理证实。其中,男41例,女21例;年龄37-89岁,中位年龄57岁。高分化腺癌16例,中分化腺癌30例,低分化腺癌16例;浸润突破肌层者45例,未突破肌层者17例;有淋巴结转移者28例,无淋巴结转移者34例;Duke's分期:A期与B期共34例,C期与D期共28例。另取20例距癌灶边缘5cm以上切缘的正常大肠粘膜组织作为对照。所有标本经10%中性福尔马林液固定,石蜡包埋,常规切片,分别作HE染色和免疫组化染色。
2.主 要试剂
鼠抗人STAT3单克隆抗体(SC-8019)购自Santa Cruz公司,鼠抗人VEGF单克隆抗体(MAB-0243)及广谱免疫组化S-P试剂盒均购自福州迈新生物技术开发有限公司。DAB(3,3'-diaminobenzidine,3,3'-二氨基联苯胺)显色试剂盒购自北京中杉生物有限公司。
3.实 验方法
免疫组织化学染色(S-P法)参照试剂盒说明书操作,用已知阳性切片作为阳性对照,用PBS代替一抗作为阴性对照。
4.结 果判断
STAT3和VEGF免疫组化染色表达主要定位于细胞质内,呈棕黄色颗粒。采用半定量方法,(1)按细胞染色强弱评分:0分不着色,1分浅黄色,2分棕黄色,3分棕褐色。(2)选取5个高倍视野(×400),计数阳性染色细胞占细胞总数的百分比:1分<25%,2 分 26%-50%,3 分 50%-75%,4 分 >75%。按(1)、(2)乘积判断结果:≤1为阴性(-),>1为阳性(+)。
5.统 计学处理
应用SPSS 13.0软件包进行统计分析。各样本资料差异的统计学处理采用χ2检验方法,Spearman相关分析检验方法,P<0.05表示有统计学意义。
结 果
1.大 肠癌中STAT3和VEGF蛋白表达与临床病理因素间的关系
淋巴结转移阳性组STAT 3和VEGF阳性表达率分别为78.6%(22/28)、89.3%(25/28),均高于阴性组52.9%(18/34)、64.7%(22/34),两者比较差异有显著性(P<0.05)。Duke's临床分期中,C+D期STAT3和VEGF阳性表达率分别为78.6%(22/28)、89.3%(25/28),均高于 A+B 期52.9%(18/34)、64.7%(22/34),两者比较差异有显著性(P<0.05)。STAT3和VEGF表达与患者年龄、性别、肿瘤分化程度及浸润深度均无关(P>0.05,表1)。

表1 STAT3和VEGF与临床病理参数之间的关系Table 1 The relationship of STAT3and VEGF expression and clinicopathological manifestations in colorectal carcinoma
2.S TAT3和VEGF蛋白在大肠癌组织和正常大肠黏膜组织中的表达
STAT3和VEGF蛋白在65例大肠癌组织中的阳性表达率分别为64.5%(40/62)、75.8%(47/62),在20例正常大肠癌黏膜中的阳性表达率分别为35%(7/20)、30%(6/20)。STAT3和 VEGF蛋白在大肠癌组织中的表达均显著高于正常大肠黏膜(P<0.05,表2,图1,图2)。
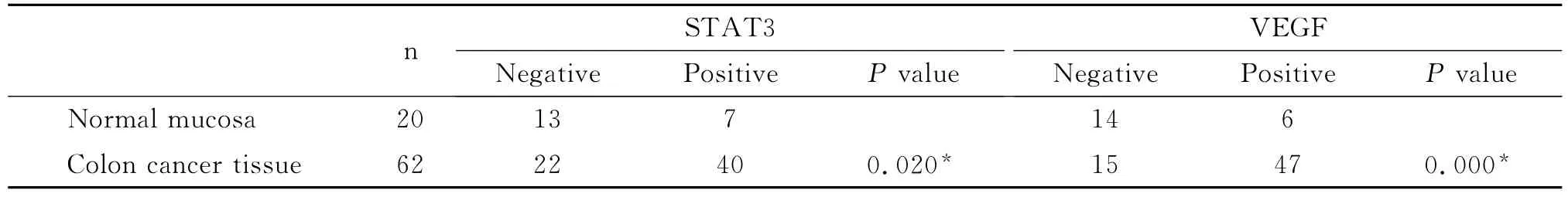
表2 STAT3和VEGF在正常大肠黏膜和大肠癌组织中的表达Table 2 Expressions of STAT3and VEGF in normal colorectal mucosa and colorectal carcinoma

图1 大肠癌组织中STAT3蛋白呈阳性表达(S-P×200)图2 大肠癌组织中VEGF蛋白呈阳性表达(S-P×200)Fig 1The expression of STAT3protein is positive in colorectal carcinoma.(S-P method×200)Fig 2The expression of VEGF protein is positive in colorectal carcinoma.(S-P method×200)
3.S TAT3和VEGF蛋白在大肠癌组织中表达之间的关系
在62例大肠癌中,STAT3和VEGF蛋白表达均阳性36例,均阴性11例,前者阳性而后者阴性4例,前者阴性而后者阳性11例。Livin和Survivin蛋白在大肠癌中的表达呈正相关(r=0.447,P<0.01,表3)。
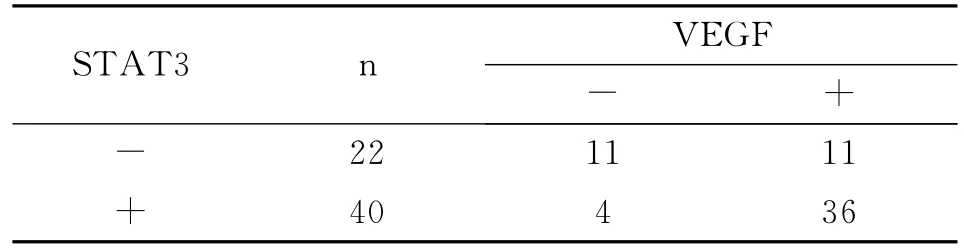
表3 大肠癌组织中STAT3和VEGF蛋白表达之间的关系Table 3 Association between STAT3and VEGF expression in colorectal carcinoma
讨 论
肿瘤新生血管的生成是肿瘤组织生长的必备条件,同时也是肿瘤浸润、转移的基础。VEGF又称血管渗透因子,于1989年在牛垂体滤泡星状细胞体外培养液中首先纯化出来[4,5]。VEGF基因定位于第六号染色体长臂(6p21.3)上,由8个外显子和7个内含子组成,其编码产物是相对分子质量约为46 000kDa的糖蛋白二聚体,对血管有高度特异性,对肝素有一定亲和力。由于VEGF mRNA选择性拼接方式不同,VEGF家族成员包括 VEGF-A、VEGF-B、VEGF-C、VEGF-D 和胎盘生长因子,其中研究最多的是VEGF-A。VEGF是目前所知最强的直接作用于血管内皮细胞的生长因子[6],有很强的促进血管内皮细胞分裂、增生、迁移和增强血管通透性的作用。也是一种有效的血管形成和血管通透性诱导因子,由内皮细胞、粒细胞、巨核细胞等合成释放[7]。研究表明,VEGF的表达具有一定的异质性,广泛地表达于多种细胞,包括巨噬细胞、成纤维细胞、平滑肌细胞、内皮细胞及肿瘤细胞;其中以肿瘤细胞和内皮细胞为主。
非受体和受体酪氨酸激酶,如Src(属于非受体酪氨酸激酶Src家族成员)、EGFR等是VEGF的主要诱导子,这些酪氨酸激酶信号通过多种途径传递,STAT3是这些途径的一个交汇点。STAT是一族具有高度同源性的转录因子,是细胞质内具有信号转导和转录因子双重功效的DNA结合蛋白,可以在外界信号的刺激下激活并直接转入细胞核内引发相应靶基因的转录。STAT约有750-900个氨基 酸, 分 子 量 84000-113000, 由 STAT1-4、STAT5a、STAT5b、STAT6 等 7 个 成 员 组 成[8]。STATs在结构上包括6个功能区,分别为N端的氨基酸保守序列、卷曲螺旋区、DNA结合域、连接区、SH2结构域、C端的转录结构域。STAT3在正常组织中的表达是快速而短暂的,而在多种恶性肿瘤组织,如头颈部鳞状细胞癌、肺癌、肝癌、胃癌、乳腺癌、前列腺癌中,STAT3表现为持续性激活和高表达,并且与肿瘤的恶性程度及预后密切相关[9-12]。有研究发现STAT3可结合于VEGF基因的启动子区域,从而调控VEGF的表达[13]。并且,STAT3还可抑制缺氧诱导因子(HIF1a)的降解,增加HIF1a的合成,从而间接上调VEGF的表达[14]。因此,STAT3信号通路的阻断,可引起多种信号途径介导的肿瘤血管生成的阻断,从而阻止肿瘤的生长和转移。
研究结果显示,STAT3和VEGF蛋白在大肠癌组织中阳性表达率显著高于正常黏膜,并且分别与淋巴结转移情况以及临床Duke,s分期有关,与患者年龄、性别及肿瘤分化程度、浸润深度无关。STAT3和VEGF蛋白在大肠癌组织的阳性表达呈正相关。提示STAT3和VEGF在大肠癌的发生发展中均具有重要作用,同时两者具有协同作用,联合检测较单一检测更有意义。
[1]Weerasinghe P,Garcia GE,Zhu Q,et al.Inhibition of Stat3activation and tumor growth suppression of nonsmall cell lung cancer by G-quartet oligonucleotides.Int J Oncol,2007,31(1):129-136
[2]Zhu BH,Zhan WH,Li ZR,et al.(-)-Epigallocatechin-3-gallate inhibits growth of gastric cancer by reducing VEGF production and angiogenesis.World J Gastroenterol,2007,13(8):1162-1169
[3]Hsieh FC,Cheng G,Lin J.Evaluation of potential Stat3-regulated genes in human breast cancer.Biochem Biophys Res Commun,2005,335(2):292-299
[4]Kumar H,Heer K,Lee PW,et al.Preoperative serum vasular endothelial growth factors can predict stage in colorectal cancer.Clin Cancer Res,1998,4(5):1279-1285
[5]Ferrara N,Gerber HP,Le Couter J.The biology of VEGF and its receptors.Nat Med,2003,9(6):669-676
[6]Takahashi Y,Kitadai Y,Bucana CD,et al.Expression of vascular Endothelial growth factor and its receptor,KDR,correlates with vascularity,metastasis and proliferation of human colon cancer.Cancer Res,1995,55(18):3964-3968
[7]Enjoji M,Nakamuta M,Yamaguchi K,et al.Clinical significance of serum levels of vascular endothelial growth factor and its receptor in biliary disease and carcinoma.World J Gastroenterol,2005,11(8):1167-1171
[8]Rawlings JS,Rosler KM,Harrison DA.The JAK/STAT signaling pathway.J Cell Sci,2004,11(7):1281-1283
[9]Yang SF,Wang SN,Wu CF,et al.Altered p-STAT3(tyr705)expression is associated with histological grading and intratumour microvessel density in hepatocellular carcinoma.J Clin Pathol,2007,60(6):642-648
[10]Gong W,Wang L,Yao JC,et al.Expression of activated signal transducer and activator of transcription 3 predicts expression of vascular endothelial growth factor in and angiogenic phenotype of human gastric cancer.Clin Cancer Res,2005,11(4):1386-1393
[11]Achcar Rde O,Cagle PT,Jagirdar J.Expression of activated and latent signal transducer and activator of transcription 3in 303non-small cell lung carcinomas and 44malignant mesotheliomas:possible role for chemotherapeutic intervention.Arch Pathol Lab Med,2007,131(9):1350-1360
[12]Jing N,Tweardy DJ.Targeting Stat3in cancer therapy.Anticancer Drugs,2005,16(6):601-607
[13]Wei D,Le X,Zheng L,et al.STAT3activation regulates the expression of vascular endothelial growth factor and human pancreatic cancer angiogenesis and metastasis.Oncogene,2003,22(3):319-329
[14]Jung JE,Lee HG,Cho IH,et al.STAT3is a potential modulator of HIF-1-mediated VEGF expression in human renal carcinoma cells.FASEB J,2005,19(10):1296-1298
