五种药用植物萃取物对四种组织来源肿瘤细胞体外增殖抑制作用的观察
2012-02-02臧文霞韩长日陈光英罗成果吉如倩
臧文霞,王 菁,韩长日,陈光英,罗成果,吉如倩
(海南师范大学热带药用植物化学省部共建重点实验室,海口571158)
天然药物的研究与开发已成为人类寻找新药以及对抗疾病的重要手段。长期以来,作为海南特有植物的白千层、大果榕、山苍子、匍匐滨藜、牛大力,在海南黎族地区作为药物用于多种疾病的治疗。2011年6月10日~7月23日,我们观察了白千层、大果榕、山苍子、匍匐滨藜、牛大力的萃取物对人肺腺癌细胞(SPCA-1)、肝癌细胞(BEL-7402)、胃癌细胞(GSC-7901)和白血病细胞(K562)的体外增殖抑制作用,抑制率超过50%即被确定为抗肿瘤有效活性萃取部位(活性萃取部位:具有抗肿瘤活性的植物乙醇提取物的不同极性有机溶剂萃取物),测定有效活性萃取部位的半数抑制率(IC50)。为进一步研究此五种植物的抗肿瘤作用提供实验依据。
1 材料与方法
1.1 仪器 高压灭菌锅,倒置显微镜,ELx800酶标仪,CO2恒温培养箱,超净工作台,可调式移液器,96孔细胞培养板,电子天平。
1.2 材料 RPMI1640培养液,胰酶,MTT,超级新生牛血清,二甲基亚砜(DMSO)。百千层、大果榕、山苍子、匍匐滨藜、牛大力采自海南,由海南师范大学生命科学学院进行鉴定,其标本保存于海南省热带药用植物化学重点实验室。
1.3 细胞株 细胞株 SPCA-1、BEL-7402、GSC-7901、K562由南方医科大学提供,常规培养。
1.4 样品制备 取白千层叶粗粉7.5 kg,75%乙醇水浴回流4 h,提取3次,合并滤液,旋转蒸发仪回收溶剂,所得浸膏加水溶解,依次用石油醚、氯仿、乙酸乙酯萃取,将萃取物溶剂回收并制成冻干粉,即得粗提物。分别取大果榕的根、茎、叶粗粉1 kg,用95%乙醇分3次回流12 h,旋转蒸发仪回收溶剂,所得浸膏加水溶解,依次用石油醚、氯仿、乙酸乙酯、乙醇、甲醇萃取,回收溶剂冻干处理,4℃储存备用。分别取山苍子叶、枝干粉10 kg,95%闪式提取器提取1次,旋转蒸发仪回收溶剂,浸膏加水溶解,依次用石油醚、氯仿、乙酸乙酯萃取,将萃取物及萃取后剩余水层回收溶剂制成冻干粉,分别得到氯仿、石油醚、乙酸乙酯、水的提取物。取匍匐滨藜全株粗粉7.5 kg,95%乙醇水浴回流提取3次,每次5 h,合并滤液,旋转蒸发仪回收溶剂,所得浸膏加水溶解,依次用石油醚、氯仿、乙酸乙酯萃取,将萃取物及萃取后剩余水层回收溶剂制成冻干粉,即得粗提物。取牛大力根部粗粉35 kg,95%乙醇水浴回流提取3次,每次4 h,合并滤液,旋转蒸发仪回收溶剂,所得浸膏加水溶解,依次用石油醚、氯仿、乙酸乙酯萃取,萃取物回收溶剂冻干,得粗提物。以上浸膏均以50%DMSO为溶剂,精确配制成10 mg/mL供试样储备液,使用时用PBS稀释。
1.5 药物活性初筛 给药组将SPCA-1、BEL-7402、GSC-7901、K562细胞分别以2×104/mL、7×104/ mL、4×104/mL、1×104/mL接种于96孔板,每孔180 μL,在CO2培养箱内培养8~12 h,待细胞贴壁后,加入浓度为100 μg/mL的不同植物粗提物各20 μL,终体积200 μL。加药细胞培养44 h后,每孔加入MTT溶液(1 mg/mL)50 μL[1,2],继续培养4 h,取出后去上清,每孔加入150 μL的DMSO,避光振荡10 min,用酶联免疫检测仪于570 nm测定各孔的光密度值(OD值)。同时设空白组(加入不含细胞的培养液,检验培养基是否感染杂菌)和对照组(加入含有细胞的培养液及药物溶剂)。计算细胞增殖抑制率,根据抗肿瘤药物疗效的评价标准之一[3],设定抑制率>50%为抗肿瘤有效活性萃取部位,细胞增殖抑制率=(对照组OD值-给药组OD值)/对照组OD值×100%。每份样本平行测定5孔,取均值。
1.6 IC50测算 根据药物活性初筛所得数据,选取有细胞增殖抑制活性(浓度为100 μg/mL时细胞增殖抑制率>50%)的样品,稀释成不同浓度(1、10、100 μg/mL),进行二次MTT实验(实验方法同上),并计算IC50:以同一样品的浓度对数值为横坐标,以细胞增殖抑制率为纵坐标,作回归曲线,计算IC50。1.7 统计学方法 采用SPSS19.0统计软件。组间比较用方差分析。P≤0.05为差异有统计学意义。
2 结果
2.1 五种植物经初筛具有抗肿瘤活性的萃取部位对GSC-7901细胞的增殖抑制作用及其IC50五种植物中经初筛对GSC-7901细胞具有抗肿瘤活性的分别为白千层石油醚和氯仿萃取物、大果榕氯仿萃取物、山苍子石油醚和氯仿萃取物(细胞增殖抑制率在65%以上),其对GSC-7901细胞增殖的影响见表1。IC50分别为白千层石油醚萃取物23.50 μg/ mL、氯仿萃取物41.15 μg/mL,大果榕氯仿萃取物37.36 μg/mL,山苍子石油醚萃取物117.67 μg/mL、氯仿萃取物173.66 μg/mL。
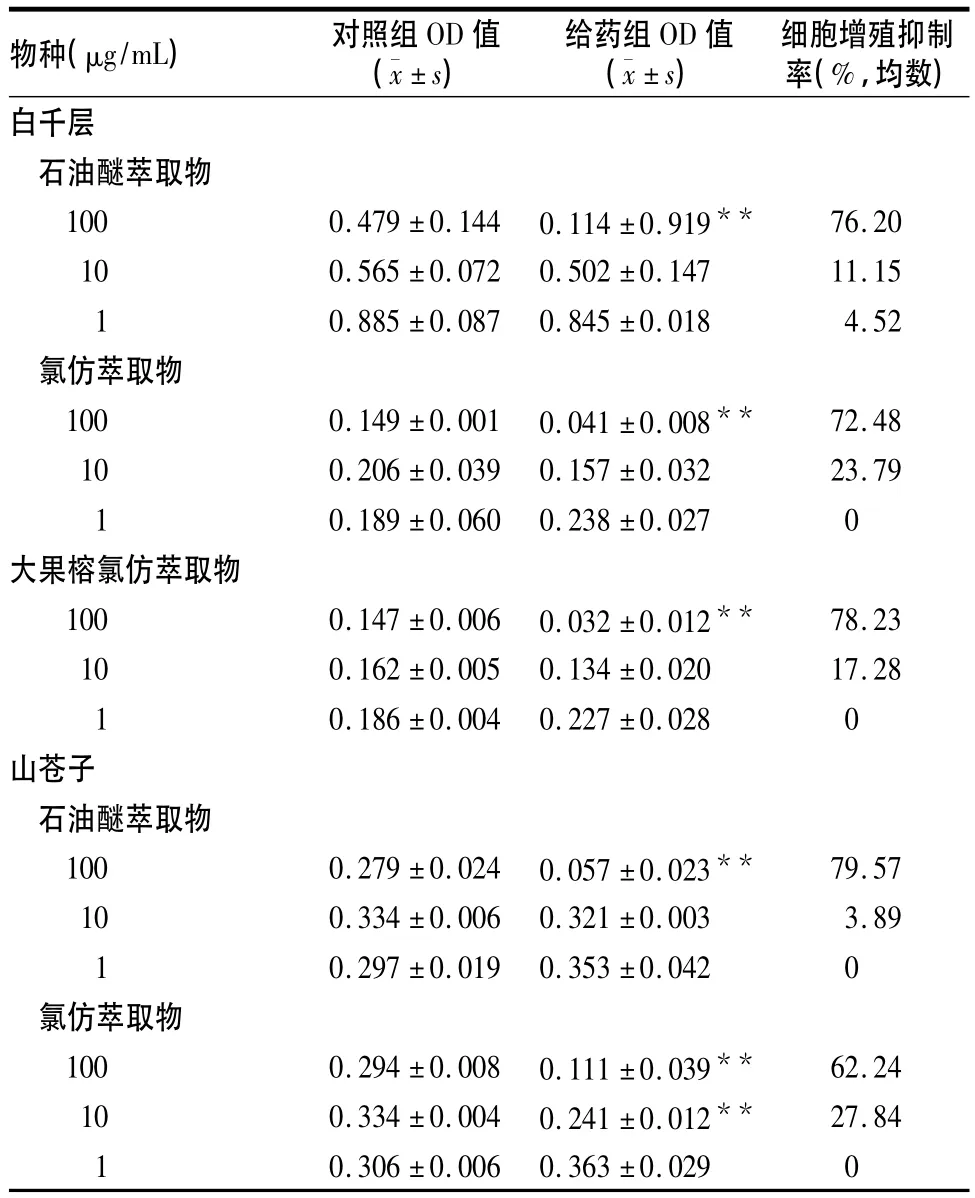
表1 白千层、大果榕、山苍子的活性萃取部位对GSC-7901细胞增殖的影响
2.2 五种植物经初筛具有抗肿瘤活性的萃取部位对SPCA-1细胞的增殖抑制作用及其IC50五种植物中经初筛对SPCA-1细胞具有抗肿瘤活性的分别为白千层石油醚萃取物、大果榕石油醚萃取物、山苍子石油醚萃取物和牛大力的乙酸乙酯萃取物(细胞抑制率在55%以上),其对SPCA-1细胞增殖的影响见表2。IC50分别为白千层石油醚萃取物45.17 μg/ mL,大果榕石油醚萃取物55.89 μg/mL,山苍子石油醚萃取物213.70 μg/mL,牛大力乙酸乙酯萃取物38.77 μg/mL。
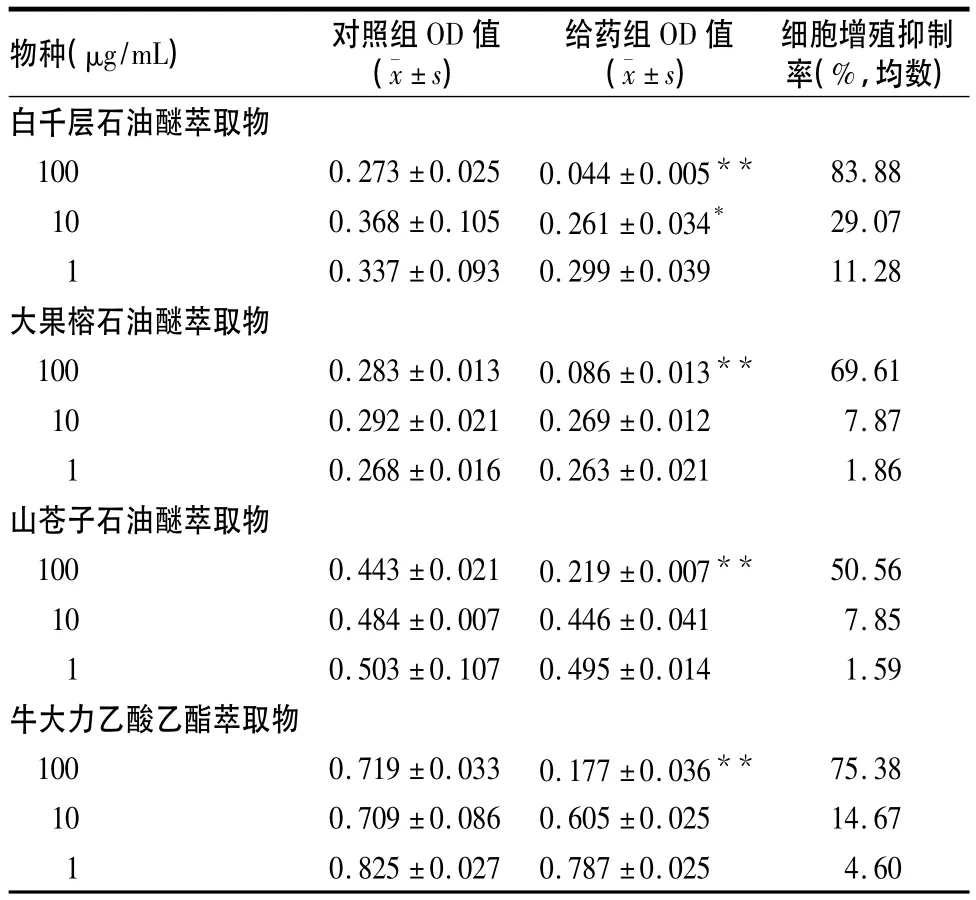
表2 白千层、大果榕、山苍子、牛大力的活性萃取部位对SPCA-1细胞增殖的影响
2.3 五种植物经初筛具有抗肿瘤活性的萃取部位对K562细胞的增殖抑制作用及其IC50五种植物中经初筛对K562细胞具有抗肿瘤活性的分别为大果榕石油醚和氯仿萃取物、山苍子石油醚和氯仿萃取物、牛大力氯仿萃取物(细胞抑制率在50%以上),其对K562细胞增殖的影响见表3(二次MTT实验时大果榕的石油醚萃取物、山苍子氯仿萃取物对K562细胞增值抑制率略低于50%,是因细胞培养批次不同、密度不同所致)。IC50分别为大果榕石油醚萃取物91.61 μg/mL、氯仿萃取物39.29 μg/ mL,山苍子石油醚萃取物9.66 μg/mL、氯仿萃取物65.93 μg/mL,牛大力氯仿萃取物56.50 μg/mL。
2.4 五种植物经初筛具有抗肿瘤活性的萃取部位对BEL-7402细胞的增殖抑制作用及其IC50五种植物中经初筛对BEL-7402具有抗肿瘤活性的分别为白千层石油醚萃取物、山苍子石油醚和氯仿萃取物、匍匐滨藜乙酸乙酯萃取物(细胞抑制率在50%以上),其对K562细胞增殖的影响见表4。IC50分别为白千层石油醚萃取物35.61μg/mL,山苍子石油醚萃取物104.82 μg/mL、氯仿萃取物34.05 μg/ mL,匍匐滨藜乙酸乙酯萃取物52.98 μg/mL。

表3 大果榕、山苍子、牛大力的活性萃取部位对K562细胞增殖的影响
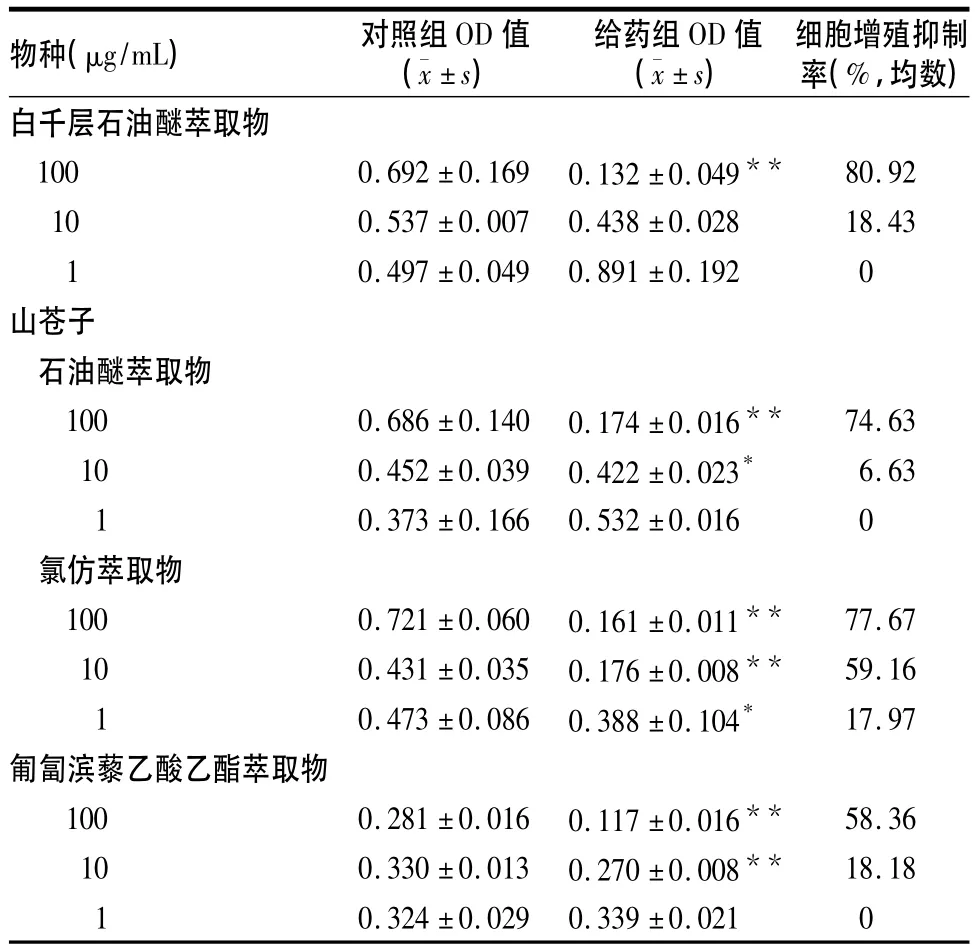
表4 白千层、山苍子、匍匐滨藜的活性萃取部位对K562细胞增殖的影响
3 讨论
从白千层的叶和树枝中能够分离得到具有防腐、杀菌、防霉等作用的白千层油[4]。大果榕,俗称无花果,为桑科榕属。山苍子的根、茎、叶和果实均可入药,有抗血栓、抗哮喘和抗过敏功效[5]。匍匐滨藜可用于治疗风湿痹痛、带下、月经不调、疮疡痈疽、皮炎。牛大力具有保肝、祛痰、镇咳、平喘、提高免疫功能等作用[6]。这五种植物中可能含有生物碱类[7]、萜类、多酚类[8]及其他具有抗癌活性的成分。
本研究结果显示,白千层的石油醚萃取物、大果榕的氯仿萃取物对GSC-7901细胞有较好的增殖抑制作用,其浓度在100 μg/mL时细胞增殖抑制率可达75%以上,IC50<40 μg/mL。白千层的氯仿萃取物、山苍子的石油醚和氯仿萃取物对GSC-7901细胞的抑制作用较弱。活性部位对SPCA-1细胞的增殖抑制作用呈剂量依赖性。其余萃取物对GSC-7901细胞的增殖抑制作用不明显。
白千层的石油醚萃取物、牛大力的乙酸乙酯萃取物对SPCA-1细胞的增殖有较好的抑制作用,其浓度在100 μg/mL时细胞增殖抑制率可达75%以上,IC50<46 μg/mL。大果榕的石油醚萃取物、山苍子的石油醚萃取物对SPCA-1细胞的增殖抑制作用较弱;活性部位对SPCA-1细胞的增殖抑制作用呈剂量依赖性。其余萃取物对SPCA-1细胞的增殖抑制作用不明显。
大果榕的氯仿萃取物、山苍子的石油醚萃取物、牛大力的氯仿萃取物对K562细胞的增殖有较好的抑制作用,其浓度在100 μg/mL时细胞增殖抑制率可达60%以上,IC50<60 μg/mL,其中山苍子石油醚萃取物的IC50达到9.66 μg/mL。其余萃取物对K562细胞的增殖抑制作用不明显。
白千层的石油醚萃取物对BEL-7402细胞的增殖有较好的抑制作用,其浓度在100 μg/mL时细胞增殖抑制率可达80%以上,IC50<40 μg/mL。山苍子的石油醚和氯仿萃取物、匍匐滨藜的乙酸乙酯萃取物对BEL-7402细胞显示了较弱的抑制作用。活性部位对人肝癌细胞的抑制作用呈剂量依赖性,其余萃取物对BEL-7402细胞的增殖抑制作用不明显。
总之,本研究发现,白千层的石油醚萃取物对GSC-7901细胞及山苍子的石油醚萃取物对K562细胞有很好的抑制作用,其IC50<30 μg/mL,且其对肿瘤细胞的毒性呈剂量依赖关系。文献[9]报道,肿瘤药物敏感实验的体外实验结果与体内化疗疗效总符合率达85%。接下来我们将针对这五种植物中活性萃取部位较好的几种植物进行活性成分分析,确定其有效物质成分。
[1]Mosmann T.Rapid colorimetric assay for cellular growth and survival:application to proliferation and cytotoxicity assays[J].J Immunol Meth,1983,65(1-2):55-63.
[2]Zhao MC,Wei WQ,Liu J.Impact of MTT based tumor chemosensitivity assay in vitro[J].Chin-Germ J Clin Onco,2009,9(8).546-548.
[3]张均田.现代药理实验方法[M].北京:北京医科大学中国协和医科大学联合出版社,1998:819.
[4]肖凯军,银玉容,郭祀远,等.白千层油及其在医药上的应用[J].中国现代应用药学杂志,2001,18(6):423-425.
[5]赵婷,陈国华,张鼎华,等.我国山苍子的研究现状及展望[J].福建林业科技,2010,37(2):158-162.
[6]韦玉燕,巫繁菁,曾海生,等.牛大力研究概況[J].广西科学院学报,2010,(3):380-382
[7]Chueh WH,Lin JY.Berberine,an isoquinoline alkaloid in herbal plants,protects pancreatic islets and serum lipids in nonobese diabetic mice[J].J Agric Food Chem,2011,59(14):8021-8027.
[8]孙春燕,胡豫,刘新月,等.白藜芦醇对多发性骨髓瘤细胞的体外抗癌作用[J].中草药,2007,38(1):80-84.
[9]韩锐.肿瘤化学预防及药物治疗[M].北京:北京医科大学中国协和医科大学联合出版社,1991:418.
