不同品系小鼠感染甲型流感病毒肺小血管内血栓形成
2012-02-01徐艳峰马春梅鲍琳琳
刘 颖,徐艳峰,邓 巍,朱 华,黄 澜,马春梅,鲍琳琳,秦 川
(中国医学科学院实验动物研究所,卫生部人类疾病比较医学重点实验室,国家中医药管理局人类疾病动物模型三级实验室)
急性肺动脉栓塞(pulmonary embolism,PE)是指内源性或外源性栓子堵塞肺动脉引起肺循环障碍的临床和病理生理综合征,临床观察和多项种群研究的证据显示静脉血栓栓塞VTE已经成为一种全球性严重的医疗保健问题。近年来众多学者提出深静脉血栓一肺栓塞DVT-PE是由于遗传和(或)环境异常造成的一种多基因、多因素性疾病,并将外伤、手术、高龄、恶性肿瘤、妊娠、心衰、制动及口服避孕药等列为其发生的危险因素。另外临床实验的统计数据表明流行性感冒与急性的肺动脉栓塞风险增加之间虽然还没有明确的相关关系[1],但已有流感病毒感染导致血栓形成的病例报道。2009年10月Agarwal等[2]报告的15例甲型H1N1流感者CT检查中有5例肺栓塞。本研究使用不同免疫状态的小鼠感染甲型流感病毒(H1N1和H3N2),观察病毒感染后血栓形成的情况。
1 材料和方法
1.1 实验动物
雌性4~6周 BALB/C小鼠(40只)和 NODScid小鼠(50只),雌性4~6周Scid小鼠,BALB/C-nu小鼠,NOD/LtJ小鼠(各33只)(由北京华阜康提供,合格证号:SCXK京 2009);icosl-KO小鼠(10只)(由卫生部人类疾病比较医学重点实验室提供)。小鼠按品系分笼饲养,实验前3 d安置于生物实验安全实验室独立送风隔离笼具(IVC)中适应环境,H1N1病毒感染实验在 BSL-3实验室中进行,H3N2病毒感染实验在BSL-2实验室中进行。
1.2 病毒
H1N1病 毒 A/California/7/2009(CA7)株,TCID50为 106。H3N2病毒 A/Brisbane/10/07株,TCID50为107。
1.3 病毒感染
H1N1病毒以106TCID50,对BALB/C小鼠、Scid小鼠、NOD/LTJ小鼠、BALB/C-nu小鼠、NOD-Scid小鼠和icosl-KO小鼠经乙醚麻醉后进行滴鼻攻毒,每只小鼠50μL,攻毒后每天观察小鼠,分别于第4天、第6天、第7天、第8天和第14天处死小鼠取材检测小鼠感染后的肺组织病毒载量和病理改变。实验在中国医学科学院实验动物研究所ABL-3实验室中进行。
H3N2病毒以107TCID50,对BALB/C小鼠、Scid小鼠、NOD/LTJ小鼠、BALB/C-nu小鼠、NOD-Scid小鼠和icosl-KO小鼠经乙醚麻醉后进行滴鼻攻毒,每只小鼠50μL,观察期为14 d。分别于攻毒后第3天、第10天和第14天处死小鼠取材检测感染后的肺组织病毒载量和病理改变。实验在中国医学科学院实验动物研究所ABL-2实验室中进行。
1.4 动物牺牲及标本处理
断颈处死小鼠,打开胸腔,保留肺组织:取右上肺叶于组织裂解液中用于提取组织RNA;取右中肺叶于冻存管置-80℃冰箱中备份保存;其余肺叶与心、肝、脾、肾、脑、胃肠道等组织于10%中性甲醛溶液中固定。
1.5 肺组织总RNA提取及PCR检测
RNeasy Mini Kit试剂盒(QIAGEN,74106)提取肺组织总RNA,反转录成cDNA。使用荧光染料Power SYBR Green PCR Master Mix(ABI,4367659)进行realtime PCR检测(ABI STEPONE PCR仪)。扩增程序94℃3 min;94℃30 s,59℃30 s,72℃30 s,共35个循环;95℃,15 s;60℃ 1 min;95℃ 15 s。每次试验的标准品作106copies/mL、105copies/mL、104copies/mL、103copies/m L、102copies/m L浓度梯度稀释,阴性对照(H2O)与样品一起提取RNA后做real-time PCR。通过读取仪器数据得到病毒载量。
所用 H1N1亚型特异性引物为 SW-H1 F786 5’-AATAACATTAGAAGCAACTGG-3’, SW-H1 R920 5’-AGGCTGGTGTTTATRGCACC-3’,目的片段大小为153 bp;H3N2亚型特异性引物为 BR-10F 5’-GAGAATCCAGCACACAAGAG-3’,BR-10R 5’-TTCTCAGTTCAAGAGTGCTC-3’,目的片段大小为196 bp。
1.6 病理学检查
10%中性甲醛溶液固定组织常规石蜡包埋,常规组织学处理,常规HE染色。肺组织切片纤维素特殊染色(Mallory磷钨酸苏木素改良染色,即PTAH改良染色),抗P选择素抗体(北京瀚天科技有限公司提供)免疫组织化学染色。
2 结果
2.1 小鼠感染后存活情况和大体观察
小鼠感染H1N1病毒后逐渐出现进食减少、消瘦、被毛逆立、弓背、反应迟钝等,感染小鼠后感染死亡情况见表1、表2。剖检时可见感染小鼠肺脏有明显的充血和水肿,肺组织表面有局部实变,其他脏器未见明显改变。
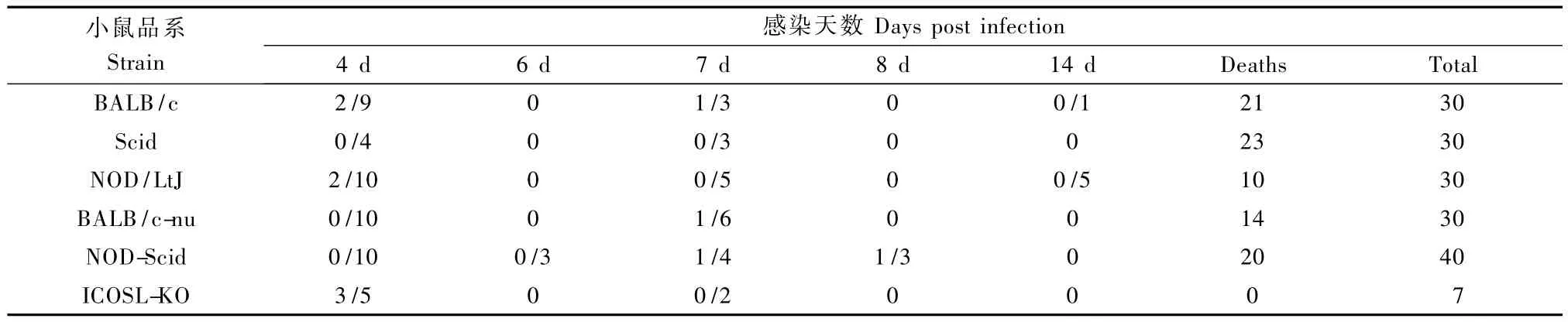
表1 H1N1感染小鼠后观察到血栓形成的小鼠/取材小鼠和感染死亡情况,(单位:只)Tab.1 Observed number ofmice with thrombosis and number of dead m ice infected with H1N1 virus

表2 H3N2感染小鼠后观察到血栓形成的小鼠/取材小鼠和感染死亡情况,(单位:只)Tab.2 Observed number ofmice with thrombosis and number of dead m ice infected with H3N2 virus
小鼠感染H3N2病毒后,一般状态尚好,未见明显的食欲减退和活动减少,观察14 d均无死亡。剖检时各品系感染小鼠肺脏均未见明显的充血水肿,肺组织颜色正常,未见实变等改变,其他脏器未见明显改变。
2.2 小鼠肺组织病毒载量检测结果
攻毒后不同时间点处死小鼠取肺组织RT-PCR检测流感病毒的表达量(表3、表4),各组小鼠均染毒。
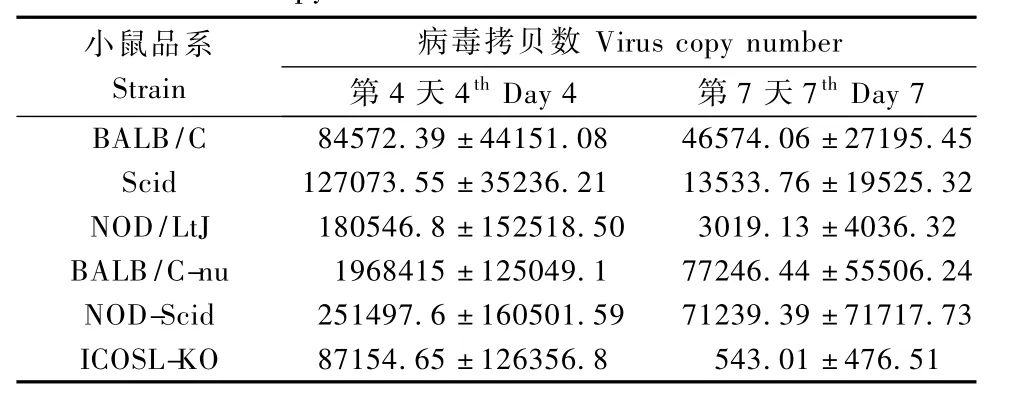
表3 H1N1感染不同品系小鼠肺组织不同时间的病毒拷贝数Tab.3 Virus copy number in mice infected with H1N1 virus

表4 H3N2感染不同品系小鼠肺组织不同时间的病毒拷贝数Tab.4 Virus copy number in m ice infected with H3N2 virus
2.3 小鼠肺组织病理观察结果
H1N1感染小鼠肺部病变较重,肺间质血管高度充血,肺泡间隔度增宽、融合,少量炎细胞浸润,其中BALB/C小鼠和Scid小鼠病变面积较大。13只小鼠肺组织小血管内见血栓形成(图1A、B)(血栓形成的小鼠数和取材小鼠数见表1)。其他脏器未见异常改变。
H3N2感染小鼠后,BALB/C小鼠和 BALB/C-nu小鼠,肺组织病变较重,肺泡间隔明显增宽,血管扩张充血,间质炎细胞浸润,肺泡缩小变形;NODScid小鼠、Scid小鼠、NOD/LTJ小鼠和 icosl-KO小鼠,肺组织病变较轻,肺泡间隔明显增宽,血管扩张充血,间质少量炎细胞浸润。6只小鼠肺组织小血管内见血栓形成(图1C、D)(血栓形成的小鼠数和取材小鼠数见表2)。其他脏器未见异常改变。
PTAH改良染色显示观察到的血栓中有纤维蛋白,P选择素的免疫组织化学染色血栓显色为阳性,即血栓中有活化聚集的血小板(图1E、F)(图1见文后插1)。
3 讨论
本实验中使甲型流感病毒H1N1和H3N2感染小鼠,其中H1N1毒力较强,动物死亡率较高,H3N2毒力较温和,没有动物死亡。两种病毒感染小鼠后取小鼠肺组织提取RNA进行PCR检测,均得到一定数量的病毒RNA拷贝,不同组别在数量上有所差异,但差异无统计学意义。感染小鼠均观察到肺组织病理改变,并在多只动物的肺组织内观察到血栓形成,多位于直径20~60μm的小血管内,最大的见于平均直径90μm血管内。根据特殊染色和免疫组织化学的结果血栓成分主要是纤维素和血小板。所以从成分和形成位置来看与PE体循环来源的混合血栓栓子经肺循环进入肺动脉不同,我们观察到的血栓可能是在肺小血管中原位形成的。另外,不管是H1N1还是H3N2感染小鼠,感染早期在小静脉和毛细血管中出现血栓的可能性相对较大,也可能是由于随着时间延长早期形成的血栓又有部分溶解。这与一项针对2 258名泌尿系统感染和3 375名呼吸道感染的研究显示的结果相一致,感染患者的DVT和PE的发病风险显著上升,并在最初的两周达到高峰,在随后的数月中患病风险逐渐降低,至一年以后降至基线水平[3]。
实验中用到的不同品系的小鼠,其免疫系统状态各有不同:Scid小鼠存在T、B细胞缺陷;NOD/LtJ小鼠存在NK细胞缺陷,也因发生自身免疫常用于1型糖尿病的研究;NOD-Scid小鼠存在T、B、NK细胞缺陷;BALB/C-Nu小鼠存在 T细胞缺陷;Icosl-KO小鼠则有T辅助细胞异常分化,脾脏生发中心数量减少、体积缩小,T、B细胞相互作用异常;BALB/C小鼠作为对照小鼠,其没有免疫细胞种类的缺陷,于6月龄以后可能出现免疫球蛋白增多。不同病毒感染小鼠后,在不同品系小鼠均观察到有血栓的形成。H1N1和H3N2感染小鼠后各品系小鼠血栓出现情况并不完全一致,其中BALB/c小鼠、NOD/LtJ小鼠和NOD-Scid小鼠都观察到血栓的形成,形成比例在两种病毒的感染中略有差异;Scid小鼠仅在H3N2感染后观察到血栓形成,而BALB/c-Nu小鼠和icosl-KO小鼠仅在 H1N1感染后观察到血栓形成,可能与病毒毒力和感染特性有关。比较各品系小鼠血栓形成结果,NK细胞可能在血栓形成过程中的作用不大,T细胞的部分功能,或T细胞与其他免疫成分的相互作用在血栓形成过程中发挥一定作用,但由于样本量较少,影响品系间差异的观察,产生一定的偏差,且免疫系统内的各种成分间相互作用复杂,故对免疫成分参与血栓形成的机制尚需进一步实验证实。
已有研究发现流感引起的炎症反应能够导致血栓调节素水平的下调,抗凝血激活蛋白C水平下降,纤溶酶原激活物抑制剂(plasm inogen activator inhibitor-l,PAI-1)水平升高,从而导致纤维带白溶解作用下降;且炎症本身能够诱导血小板数量的升高[4]。也曾有尸检发现感染 A型 H1N1流感病毒的患者肺周围小血管内见到小血栓形成[5]。也有报道人巨细胞病毒(human cytomegalovirus,HCMV)感染急性期与血栓形成有关,而且抗病毒药物的使用能够抑制HCMV感染引起的血小板的粘附和聚集活性增强;体外HCMV感染人包皮成纤维细胞可使血管假性血友病因子(von W illebrand factor, vWF)、细胞间粘附分子 (intercellular adhesion molecule-1,ICAM-1)和血管细胞粘附分子(vascular cell adhesion molecule-1,VCAM-1)的表达水平增高,从而促进血栓形成[6]。一项对1986年至2004年十多年间发表的文献的总结性研究发现 HIV感染增加了患者的血液凝固性和血管内皮的活化,同时临床也观察到病毒感染还可能引起病人肺动脉压的改变,从而造成HIV感染者血栓性疾病的发病风险升高[7]。所以病毒感染对静脉血栓形成有一定的影响,且某些病毒感染本身即可导致血管内皮的损伤和活化,也与病毒感染后可能引发其他的感染和自身免疫反应有一定的关系。
PE具有多种临床表现谱,发病的危险因素也多种多样,根据 Rudolf Virchow提出的经典的血栓形成三要素学说,将外科术后,创伤,长途飞行造成的制动作用、妊娠状态、肥胖、高龄、恶性肿瘤和口服避孕药等都成为PE的危险因素。但临床上以此为依据制定的发病风险分级和预防性治疗对PE的发病率和病死率的控制效果不明显,且临床上确也观察到有些患者VTE的发生找不到易辨认的危险因素。随着环境的改变和人口流动性的增加,病毒感染在人群中越来越普遍,一些毒力并不强的病毒感染发病隐匿,很容易被临床忽视,但却在很大程度上影响了人体的免疫状态,引起内环境的改变,导致各种免疫细胞和免疫分子的平衡被打破,病毒本身复制也引起血管内皮损伤等组织学改变,最终导致凝血系统和抗凝系统的功能紊乱,从而促使血栓形成。我们的实验结果一定程度上支持病毒感染可作为血栓形成危险因素的观点,但由于实验对象小鼠与人类循环系统有很大区别,我们对小鼠的凝血系统的组成和运作了解也还不多,所以要在动物身上复制真正病因学上的VTE模型,并验证其发生发展的机制还有待于进一步的探索。
[1]van W issen M,Keller TT,Ronkes B,et al.Influenza infection and risk of acute pulmonary embolism[J].Thromb J,2007,16 (5):16.
[2]Agarwal PP,Cinti S,Kazerooni EA.Chest radiographic and CT findings in novel swine-origin influenza A(H1N1)virus(SOIV)infection[J].AJR Am JRoentgenol,2009,193(6):1488 -1493.
[3]Smeeth L,Cook C,Thomas S,et al.Risk of deep vein thrombosis and pulmonary embolism after acute infection in a community setting[J].Lancet,2006,367(9516):1075-1079.
[4]Hultman K, Blomstrand F, Nilsson M, Expression of p lasminogen activator inhibitor-1 and protease nexin-1 in human astrocytes:Response to injury-related factors[J].J Neurosci Res,2010,88(11):2441-2449.
[5]Harms PW,Schmidt LA,Smith LB,Autopsy findings in eight patients with fatal H1N1 influenza[J].Am JClin Pathol,2010,134(1):27-35.
[6]Rahbar A, Söderberg-Nauclér C. Human cytomegalovirus infection of endothelial cells triggers platelet adhesion and aggregation[J].JVirol,2005,79(4):2211-2220.
[7]Klein SK,Slim EJ,de Kruif MD,Is chronic HIV infection associated with venous thrombotic disease?A systematic review[J].Neth JMed,2005,63(4):129-136.
