白细胞介素21对SHIV感染的恒河猴外周血CD8+T细胞分泌γ干扰素的影响
2012-01-30赵长城高锡强吴芳新张伟伦
赵长城,高锡强,吴芳新,张伟伦,薛 婧,魏 强,秦 川
(中国医学科学院医学实验动物研究所,卫生部人类疾病比较医学重点实验室,国家中医药管理局人类疾病动物模型三级实验室,北京 100021)
IL-21是一种新近发现的、具有免疫调节作用的细胞因子,可通过多条途径影响CD8+T细胞介导的抗病原体作用[1],但目前对于 IL-21在抗 SIV/SHIV感染中的作用研究很少。本研究测定了IL-21诱导SHIV感染猴外周血CD8+T细胞分泌 IFN-γ的水平,以期掌握 IL-21体外诱导病毒特异性的细胞免疫的动力学规律,为今后艾滋病发病机制的研究、HIV候选疫苗的筛选提供参考。
1 材料和方法
1.1 标本来源
健康猴和SHIV1157ipd3N4感染的中国恒河猴EDTA抗凝全血。
1.2 主要试剂
Mouse anti-monkey CD3 Ab(Invitrogen),Purified anti-human CD28Ab(BD),APC anti-human IFN-γ Ab(BioLegend),FITC anti-human CD4Ab (BioLegend),PE anti-human CD8a Ab(BioLegend),Brefeldin A(BFA)(BioLegend),Triozol(Invitrogen),AMV反转录酶、RNA酶抑制剂、Ex Taq DNA聚合酶(大连宝生物),rh IL-21(Invitrogen),Monkey IFN-γ ELISAPROkit(Mabtech),淋巴细胞分离液 Ficoll-PaqueTMPLUS(GE),RPMI 1640完全培养基(含10%FCS、2.5%丙酮酸钠、1%非必需氨基酸、2%双抗)。
1.3 RT-PCR引物设计及合成
恒河猴 IFN-γ基因上下游引物序列[2]分别为5'-GCTTTTCAGCTCTGCATTGT-3'和5'-CGACAGTTC AGCCATCATTTG-3',GAPDH上下游引物序列[3]分别 为5'-ACCACCATGGAGAAGGCTGG-3'和 5'-GGATGATGTTCTGGAGAGCC-3',所有引物均由Invitrogen公司合成。
1.4 外周血CD8T淋巴细胞的分离
分离猴外周血单个核细胞(PBMCs),用CD8+T细胞阳性磁珠 CD8microbead kit nonhuman-primate (Miltenyi Biotec)分选出CD8+T细胞。再用 RPMI 1640完全培养基培养于37℃、5%CO2孵箱,备用。
1.5 ELISA检测IL-21诱导CD8T细胞培养上清液中IFN-γ浓度
用RPMI 1640完全培养基调PBMCs浓度为1.0×106/mL,24孔板中每孔加入1m L。每孔分别加入0、1、5、10和 15ng/m L IL-21和 1μg/m L anti-CD3刺激 48h后,收集细胞培养上清液。应用Human IL-21ELISA MAXTMDeluxe SET(BioLegend)检测上清液中IFN-γ的浓度。
1.6 RT-PCR检测IL-21诱导CD8T细胞IFN-γ m RNA的表达水平
加入1μg/m L anti-CD3和10ng/m L IL-21刺激5.0×105个健康猴和感染猴 CD8+T细胞48h,同时以未刺激的CD8+T细胞作为阴性对照。TRIzol法提取细胞总RNA。将RNA逆转录合成cDNA,以cDNA为模板,PCR扩增 IFN-γ基因片段。扩增体系为20μL,其中10×Ex Taq buffer 2μL、dNTPs 2μL、Ex Taq DNA聚合酶 0.2μL、上下游引物(20μM/μL)各0.8μL、cDNA 2μL、灭菌去离子水12.2μL。反应条件为94℃5min,94℃30s(×35),60℃30s(×35),72℃ 1min(×35),72℃延伸5min。取PCR产物5μL,在2%琼脂糖凝胶上电泳。
1.7 流式细胞术分析 IL-21诱导 IFN-γ阳性CD8T细胞百分比
用完全培养基调PBMCs浓度为1.0×106/m L。实验一:预先用1μg/m L anti-CD3和1μg/m L anti-CD28孵育 PBMC 1h,接着分别在加入 10μg/m L BFA后1、2、3、4、5和6h加入10ng/m L IL-21。实验二:设CD3/CD28组、IL-21组、CD3/CD28+IL-21组,并设空白对照组。CD3/28组和 CD3/28+ IL-21组分别加入 1μg/m L anti-CD3 +1μg/m L anti-CD28孵育 48h后,IL-21组和 CD3/CD28 + IL-21组分别加入10ng/m L IL-21,以上四组均在实验前5h加入1μg/mL BFA。
孵育结束后,首先进行胞外 anti-CD8、CD3Ab染色,接着固定细胞、渗透。最后,染胞内anti-IFN-γ抗体。检测分泌 IFN-γ的CD8+T细胞所占的百分比。
1.8 统计学方法
数据以均数±标准差表示,应用Prism 5.0统计软件进行分析。各组间指标比较用 t检验,***表示P<0.0001,**表示P <0.05。
2 结果
2.1 IL-21诱导 SHIV感染的CD8T细胞分泌IFN-γ的最佳作用浓度分析
未用IL-21刺激时,CD8+T细胞分泌 IFN-γ的量为1046.97±60.61pg/m L。当IL-21的浓度从1ng/m L增加到10ng/m L时,其诱导感染的CD8+T细胞分泌IFN-γ的量也相应增加,并在IL-21为10 ng/m L时IFN-γ分泌量达到峰值(3280.17±267.42pg/m L)。与 5ng/m L IL-21诱导的IFN-γ分泌量(1406.93±345.84pg/mL)相比,10ng/mL IL-21诱导的IFN-γ分泌量明显增加,两者之间的差异有统计学意义(P=0.0018)。但15ng/mL IL-21诱导的IFN-γ分泌量(2964.40±135.92pg/m L)与 10ng/m L IL-21组比较,差异无统计学意义(P = 0.1423)(图1)。
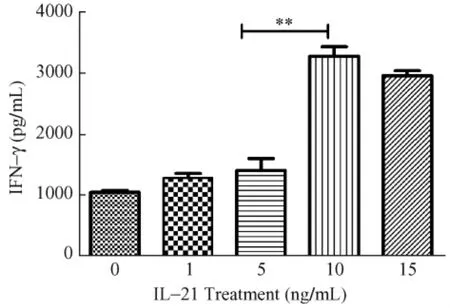
图1 不同剂量IL-21处理的CD8+T细胞培养上清液中IFN-γ浓度Fig.1 IFN-γ concentrations in the culture supernatant of CD8+T cells stimulated with IL-21at different doses
2.2 相同浓度IL-21刺激正常和感染 CD8T细胞效果的比较
在没有加入 IL-21之前,不论是正常还是感染的CD8+T细胞,均产生一定基础水平的IFN-γ (972.39±262.36pg/m L vs.1118.32±232.31pg/m L),且两者差异不显著(P>0.05)。10ng/m L IL-21处理后,感染的CD8+T细胞分泌的IFN-γ量(3019.58±203.09 pg/m L)明显低于正常的CD8+T细 胞(7510.25 ± 437.76 pg/m L)(P <0.0001)(图2)。

图2 IL-21诱导正常和感染CD8+T细胞培养上清液中IFN-γ浓度Fig.2 IFN-γ concentrations in the culture supernatant of healthy and infected CD8+T cells induced with IL-21
2.3 IL-21处理后正常和感染 CD8T细胞分泌IFN-γ的比较
RT-PCR方法检测结果证实,IL-21诱导组IFN-γ mRNA的表达较未刺激组明显增加(图3)。
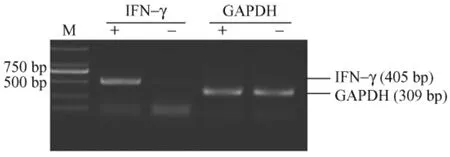
图3 RT-PCR检测感染CD8+T细胞中IFN-γ mRNA的表达Fig.3 Expression of IFN-γ mRNA in the infected CD8+T cells by assayed by RT-PCRM.2000bp marker;“+”:Stimulated with IL-21;“-”:Unstimulated with IL-21
2.4 IL-21处理后 CD8T细胞分泌 IFN-γ的分析
适当的刺激时间是检测细胞因子的关键。因此,我们选择了不同时间点进行检测。结果显示,随着IL-21刺激时间的延长,分泌IFN-γ的CD8+T细胞的百分比逐渐增加(图4),并在刺激4h时达到最高,随后逐渐下降。图5即为IL-21刺激CD8+T细胞4h时的流式图。

图4 不同时间刺激后IFN-γ阳性CD8+T细胞的百分比Fig.4 The percentage of IFN-γ-positive CD8+Tcells after different times of IL-21stimulation
IL-21诱导培养PBMCs 48h后,应用流式技术检测不同刺激条件下,分泌 IFN-γ的CD8+T细胞所占全部 CD8+T细胞的百分比。与阴性对照组[(0.28±0.08)%]相比,CD3/CD28组[(1.55± 0.15)%]、IL-21组[(0.74±0.10)%],CD3/CD28+IL-21联合组[(2.04±0.20)%]均能诱导 IFN-γ阳性CD8+T细胞所占的比例增加,且存在统计学上的差异(P<0.0001)。单独 IL-21组诱导 IFN-γ表达的作用弱于CD3/CD28组,但在CD3/CD28的
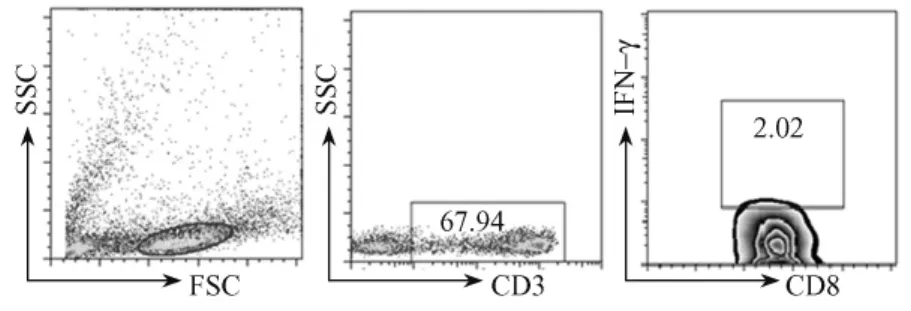
图5 IL-21刺激CD8+T细胞4h后IFN-γ阳性细胞百分率Fig.5 The percentage of IFN-γ-positive CD8+T cells stimulated with IL-21for 4h

图6 不同刺激源诱导的IFN-γ阳性CD8+T细胞的比较Fig.6 Comparison of the percentages of IFN-γ-positive CD8+T cells treated by different stimulators(CD3/CD28,IL-21,CD3/CD28+IL-21mixture),detected by flow cytometry.协同下,IL-21可以显著诱导IFN-γ的表达(图6)。
3 讨论
适应性免疫反应在机体抗 HIV/SIV感染中具有非常重要的作用。细胞免疫在控制病毒复制,延缓疾病进程的作用已得到证实[4]。SHIV/恒河猴模型体内存在特异性CD8+T淋巴细胞参与的抗病毒免疫反应,IFN-γ是免疫系统中非常重要的免疫调节因子,具有抗病毒,免疫调节和抗细胞异常增殖的作用,与病毒性疾病的严重程度戚戚相关。CD8+T细胞是 IFN-γ合成的主要细胞[5]。本文研究了IL-21对 SHIV感染 CD8+T细胞分泌 IFN-γ的作用,以及不同的条件培养基对于产生IFN-γ的影响。这些结果证实IL-21能调节IFN-γ的产生,提示IL-21在机体抗HIV/SIV感染中发挥积极的影响。
IL-21具有促进感染CD8+T细胞分泌IFN-γ的作用。CD8+T淋巴细胞是体内主要的效应细胞,研究表明,体外实验中IL-21可诱导CD8+T细胞产生IFN-γ[6]。据报道,IL-21对正常的CD8+T细胞诱导IFN-γ呈剂量相关性[7]。但本文应用 IL-21刺激SHIV感染恒河猴外周血 CD8+T细胞,研究 IL-21对SHIV感染的CD8+T淋巴细胞诱导IFN-γ的能力,从图1可知,10ng/m L IL-21诱导SHIV感染恒河猴外周血 CD8+T细胞分泌 IFN-γ效果最佳,并不呈剂量相关性。由图2可见,使用相同浓度的IL-21分别诱导正常和感染的CD8+T细胞,两者产生的IFN-γ均有不同程度的提高。但正常的CD8+T细胞分泌的IFN-γ量显著高于感染的CD8+T细胞。结果提示,SHIV的感染部分影响了CD8+T细胞的效应功能。本研究结果一方面证实了IL-21的确可以在一定程度上恢复缺失的CD8+T细胞功能,同时也说明,单独IL-21尚不能完全纠正缺失的功能,以后需在IL-21与其协同作用物上深入研究。有报道证实,当它与IL-15或 IL-18组合应用时,显示出明显的协同作用,强烈诱导细胞分泌IFN-γ[8]。但其中机制尚不明了。应用RT-PCR方法从mRNA水平检测的结果,与应用ELISA方法从蛋白质水平检测的结果是一致的。
不同的条件培养基和刺激时间影响IL-21诱导的感染CD8+T细胞产生 IFN-γ的能力。目前,对细胞免疫的研究已经存在多种替代方法,而流式细胞术具有多色荧光染色的优势。应用其检测胞内细胞因子,特别是对 IFN-γ的检测可以用来评价抗原特异性的细胞免疫水平。本研究应用流式技术检测IL-21诱导 PBMCs后,结果证实,与对照组相比,IL-21组、CD3/CD28+IL-21联合组中分泌IFN-γ的CD8+T细胞所占比例明显增加,且存在统计学上的差异(P<0.0001)。此外,在本次试验中我们也比较了不同的刺激时间产生 IFN-γ的能力。结果表明4h为刺激CD8+T细胞胞内IFN-γ合成的最佳时间。因而推测IL-21对SHIV/恒河猴模型的免疫水平有调节作用,其机制与诱导IFN-γ产生有关,但要充分理解IL-21的抗病毒作用尚需进行进一步的研究。
综上所述,本研究发现IL-21通过改善CD8+T细胞的功能从而发挥重要的保护性作用,其作用机制可能与诱导 IFN-γ分泌有关。本研究结果为HIV/SIV感染的治疗提供了新的思路。
[1]Hogg AE,Bowick GC, Herzog NK, et al. Induction of granulysin in CD8+T cells by IL-21and IL-15is suppressed by human immunodeficiency virus-1[J].J Leukoc Biol,2009,86(5):1191-1203.
[2]Huang D,Qiu L,Wang R,et al.Immune gene networks of mycobacterial vaccine-elicited cellular responses and immunity[J].J Infect Dis,2007,195(1):55-69.
[3]Nam K,Akari H,Terao K,et al.Peripheral blood extrathymic CD4+CD8+T cells with high cytotoxic activity are from the same lineage as CD4+CD8-T cells in cynomolgus monkeys[J].Int Immunol,2000,12(7):1095-1103.
[4]White L,Krishnan S,Strbo N,et al.Differential effects of IL-21and IL-15on perforin expression,lysosomal degranulation,and proliferation in CD8 T cells of patients with human immunodeficiency virus-1(HIV)[J].Blood,2007,109(9):3873-3880.
[5]Melvin MJ,MeGurn ME,Bort SJ,et al.Hypomethylation of the interferon gamma gene correlates with its expression by primary T -lineage cells[J].Eur J Immunol,1995,25:246-230.
[6]Zeng R,Spolski R,Finkelstein SE,et al.Synergy of IL-21and IL-15in regulating CD8+T cell expansion and function[J].J Exp Med,2005,201(1):139-148.
[7]Barker BR,Parvani JG,Meyer D,et al.IL-21induces apoptosis of antigen-specific CD8+T lymphocytes[J].J Immunol,2007,179(6):3596-3603.
[8]Mari Strengell,Sampsa Matikainen,Jukka Sirén,et al.IL-21in synergy with IL-15or IL-18enhances IFN-γ production in human NK and T cells[J].J Immunology,2003,170:5464-5469.
