针铁矿和蒙脱石对菲的吸附解吸行为与热力学研究
2012-01-30刘晓华吴宏海管玉峰曾丽璇邓达义何广平
刘晓华,吴宏海,管玉峰,曾丽璇,邓达义,何广平
(华南师范大学化学与环境学院,广东广州 510006)
0 引 言
多环芳烃(PAHs)是具有致畸、致癌、致突变作用的毒害有机污染物[1],且具有生物难降解性[2],在环境中分布广泛,因而引起广泛关注[3]。前人研究认为,土壤/沉积物中天然有机质(NOM)对PAHs的吸附作用是控制其在环境中迁移、转化与归宿的重要因素[4-5]。这些研究忽略了土壤矿物质对PAHs的吸附贡献。已有文献报道认为,矿物对PAHs也具有很好的吸附性能。Hundal等研究表明,在NOM含量低的地下含水层,矿物的吸附行为对PAHs在环境中的迁移、转化产生重要影响[6]。
铁氧矿物和黏土矿物在土壤矿物中最为重要,对水体中毒害有机污染物有很好的吸附能力。其中铁氧矿物针铁矿(尤其存在于热带、亚热带土壤中)具有较大的比表面积、强电子运输能力和高表面氧化还原活性,对水体中重金属和有机污染物有较好的吸附能力,在环境地球化学中起着重要作用[7-8]。而蒙脱石为冷干气候带土壤的代表性黏土矿物,具有巨大的比表面积、良好的阳离子交换性能和特殊的层间域结构,这些特性都有利于其对有机污染物的吸附[9-10]。Ma等研究表明,在低水化能的阳离子(软阳离子)存在的条件下,黏土矿物层间域、矿物微孔或微管等的内外表面中阳离子与有机分子中π电子之间存在一种较强的阳离子-π键作用[11]。Zhu等开展了这种阳离子-π键对黏土矿物吸附PAHs的作用研究[12]。Haderlein等发现黏土矿物可以通过层间域中阳离子-π键作用来控制PAHs的环境行为与归宿[13]。因此,研究对比针铁矿和蒙脱石矿物对PAHs的吸附共性和差异并探讨其原因,以及考察软阳离子对蒙脱石吸附PAHs性能的影响具有重要意义。
笔者选择一种典型的多环芳烃菲作为研究对象,研究在不同温度下针铁矿、蒙脱石以及软阳离子K+存在的条件下蒙脱石对菲的吸附特性以及热力学特征,以便更好地了解针铁矿和蒙脱石矿物对PAHs的吸附规律,进而探索矿物学因素和温度因素对土壤中PAHs环境行为的影响。
1 试验材料和方法
1.1 试验材料
菲购自日本Fluka公司(HPLC级),纯度大于97%;蒙脱石购自内蒙古赤峰,为钙基蒙脱石;甲醇(天津市科密欧化学试剂有限公司,HPLC级);其他试剂均为AR级国产试剂;试验用水为二次蒸馏水。表1列出蒙脱石矿物的理化性质。
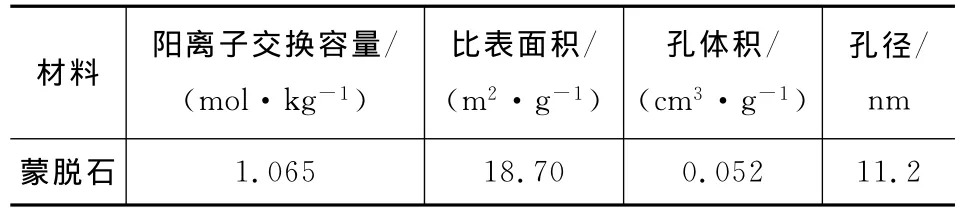
表1 蒙脱石的理化性质Tab.1 Physical and chemical properties of turface
1.2 菲的测定条件
使用岛津LC-10AT型高效液相色谱仪、SPD-10Avp紫外-可见光检测器和C18反相色谱柱(250×4.6mm)进行液相中菲浓度的测定。测定条件为:体积比为85∶15的甲醇与水组成流动相,相流速为1.00mL/min,进样体积为20μL,检测波长为254nm。
1.3 针铁矿的制备
本试验所用的针铁矿(α-FeOOH)在碱性介质中合成[14],将100mL浓度为1mol/L的Fe(NO3)3溶液和180mL浓度为5mol/L的KOH溶液迅速混合并搅拌,置于2L的聚乙烯容器中,用二次水稀释至2L,于70℃下恒温60h,生成的沉淀用二次水洗涤至电导率小于50×10-4S/m,最后在-48℃下真空干燥针铁矿样品。
1.4 吸附解吸试验
准确称取一定量的菲,溶解在甲醇中,配制成1g/L的菲标准储备溶液,于冰箱内保存备用。背景溶液分别为0.005mol/L的CaCl2溶液(保持试验溶液中一定的离子强度),100mg/L的NaN3溶液(抑制微生物降解),5mg/L的NaHCO3溶液(保证试验溶液pH值在7.0左右)。将菲标准储备溶液按比例分别加入背景溶液中,配制成一系列不同浓度的菲使用液。其中甲醇的浓度控制在0.2%以下[15],以防止共溶质效应。
笔者采用批量振荡吸附平衡法,准确称取一定量的矿物于一系列玻璃瓶(US EPA)中,分别加入不同浓度的菲使用液20mL,保留最小顶空,瓶内不留气泡,立即盖上内衬聚四氟乙烯的胶塞,并用铝盖密封,在一定的温度下置于150r/min恒温振荡器上避光(防止菲的挥发和光解)振荡一定时间达到平衡,后于3 500r/min转速下离心30min,上清液过0.45μm滤膜后用高效液相色谱仪测定。同时,选择2种不同浓度的K+溶液(0.5mol/L、1.0mol/L的KCl溶液),研究溶液存在K+时对蒙脱石吸附菲的影响。
解吸试验采取一次性取出-重注技术[16],在吸附试验结束后马上进行,尽可能将吸附瓶中残留溶液吸出,然后加入等量背景溶液,试验方法与条件同上。所有试验均做平行样和空白样。菲溶液的空白试验表明,菲的光解、挥发和容器吸附等可以忽略不计。
吸附阶段矿物对菲的平衡吸附量为

式中:q为平衡吸附量;V为试验溶液体积;C0、Ce分别为试验溶液初始浓度和平衡浓度;m为吸附剂质量。
解吸阶段固相中菲的残留量为
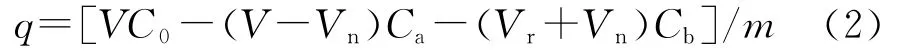
式中:Vn为玻璃小瓶内溶液被吸走后残留溶液体积;Vr为玻璃小瓶内重新加入的背景溶液体积;Ca、Cb分别为达到吸附平衡和解吸平衡时溶液浓度。
2 试验结果与分析
2.1 针铁矿表征
采用X射线衍射分析(XRD)、透射电镜(TEM)对合成针铁矿进行了表征。XRD图谱(图1)中出现了3个明显的尖锐衍射峰,通过3个尖锐衍射峰的2θ及d分析结果,与XRD标准卡片29-0713对照,合成产物为纯度极高的针铁矿(α-FeOOH)。图2为合成针铁矿的TEM图像。

图1 针铁矿的XRD图谱Fig.1 XRD spectrum of goethite
2.2 吸附平衡时间的确定
分别称取一定质量的蒙脱石和针铁矿,在303K温度下按上述试验条件考察矿物对菲的吸附率随振荡时间的变化情况(图3)。从图3可以看出,菲的吸附率在30min左右即达到平衡。
2.3 吸附剂质量的确定

图2 针铁矿的TEM图像Fig.2 TEM photograph of goethite

图3 时间对菲吸附的影响Fig.3 Effects of time on sorption of minerals to phenanthrene

图4 吸附剂质量对菲吸附的影响Fig.4 Effects of dosage of sorbents on sorption of minerals to phenanthrene
分别称取一系列蒙脱石和针铁矿,在303K温度下按上述试验条件考察其吸附量以及吸附率随吸附剂质量的变化(图4)。从图4可以看出,当菲的初始浓度一定时,随着吸附剂质量的增加,蒙脱石以及针铁矿对菲的吸附率增加,但平均吸附量下降,主要原因是随着吸附剂的增加,单位吸附剂上吸附菲的量减少了。
2.4 吸附等温线
矿物对菲的吸附等温线通常可以用线性吸附模型、Freundlich吸附模型来描述。线性吸附模型等温式为

Freundlich吸附模型等温式为

式中:Kd为化合物在液相溶液和吸附介质中的分配系数;1/n为非线性吸附强度的参数;KF为非线性吸附能力常数,KF越大,吸附能力越强。
从表2可以看出,Freundlich吸附模型较线性吸附模型能更好地拟合试验数据。由Freundlich吸附模型中1/n参数可以看出,所有吸附等温线均呈现出明显的非线性吸附特征(1/n<1),在同一温度下,其非线性程度从强到弱分别为针铁矿、蒙脱石、蒙脱石0.5K+、蒙脱石1K+,说明针铁矿吸附菲的非线性程度比蒙脱石强,同时随着K+浓度的增加,蒙脱石的非线性程度下降,这是因为吸附剂结构越紧致,其非均质性越强,非线性程度就越高[17]。Freundlich吸附模型中针铁矿KF比蒙脱石高,并且蒙脱石中KF从大到小分别为蒙脱石1K+、蒙脱石0.5K+、蒙脱石,说明针铁矿的吸附能力比蒙脱石强,而软阳离子K+能强化蒙脱石对菲的吸附作用。另外,对同一种矿物来说,KF随温度的升高而降低,说明温度明显影响着吸附过程,矿物对菲的吸附能力随温度升高而降低。
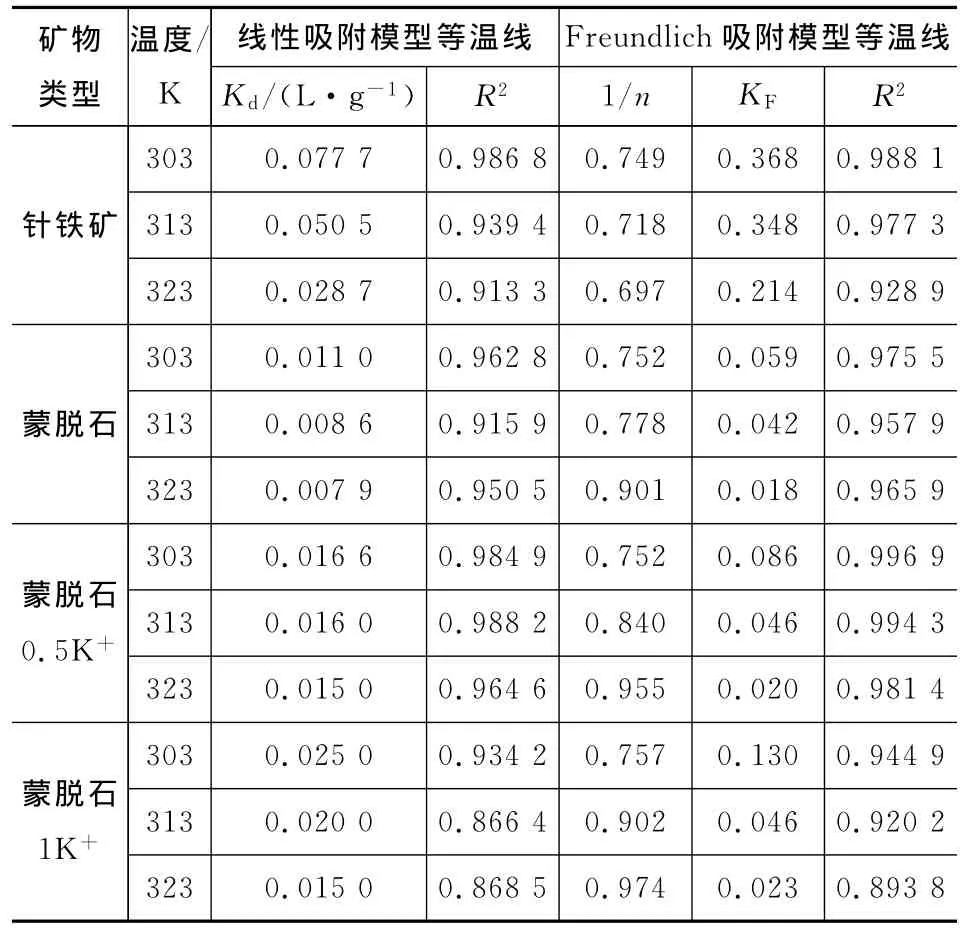
表2 不同矿物对菲的吸附等温线拟合参数Tab.2 Fitting parameters of sorption isotherms of minerals to phenanthrene
图5显示303K温度下用Freundlich吸附模型拟合获得的吸附等温线。从图5可以看出,在同一温度下,针铁矿对菲的吸附量大于蒙脱石,这是因为针铁矿表面羟基的活性比蒙脱石高,从而有更多的表面羟基参与了吸附反应。此外,试验条件中pH值为7,正好位于针铁矿的零电荷点附近,此时针铁矿表面净电荷近于零,其疏水性表面的水化膜减薄或消失,因而有利于疏水性有机物菲分子进入针铁矿表层,从而使得菲吸附增强[18]。而蒙脱石层间域和扩散层存在亲水性的Na+和Ca2+等硬阳离子,这些水合离子半径较大的硬阳离子会阻挡菲在蒙脱石上的吸附。另外,蒙脱石对菲的吸附量随着K+浓度的增加而增强。这是因为当溶液中存在软阳离子K+时,由于发生类质同象置换以及离子交换作用,蒙脱石中水合离子半径较大的硬阳离子易被半径较小的K+取代,从而减小了水化膜的阻挡作用,有利于菲在蒙脱石上的吸附。同时,蒙脱石表面的阳离子K+与菲间存在着一种较强的非共价键力(即阳离子-π键作用[11]),使得菲在蒙脱石表面上发生强吸附现象。

图5 Freundlich吸附模型拟合菲在不同矿物上的吸附等温线Fig.5 Sorption isotherms of minerals to phenanthrene calculated by Freundlich sorption model
2.5 解吸滞后
滞后系数IHI为

式中:qs为在一定的温度和浓度下,吸附过程中菲在矿物上的吸附量;qd为在一定的温度和浓度下,解吸过程中菲在矿物上的吸附量[19]。IHI≤0表明解吸滞后现象不显著,IHI>0则表明存在迟滞现象。表3列出了在303K温度下,当Ce分别为100、200、300μg/L时,针铁矿和蒙脱石作为吸附剂时的滞后系数。从表3可以看出,滞后系数均大于0,表明存在迟滞现象,且滞后系数随着平衡浓度的增加而增加,其中针铁矿的滞后系数大于蒙脱石。相比蒙脱石,针铁矿的吸附能力更强,非线性程度更高,其滞后现象更明显。这种现象与矿物的性质和结构差异有关,这也表明了针铁矿对菲的吸附能力更强、更稳定。吸附质不可逆地吸附在矿物的特殊位点上,并且由于矿物的表面存在微孔导致慢解吸速率,从而引起解吸滞后[20]。菲在针铁矿和蒙脱石这两种矿物上的吸附解吸等温线也显示出这两种矿物对菲的吸附解吸存在滞后现象(图6)。
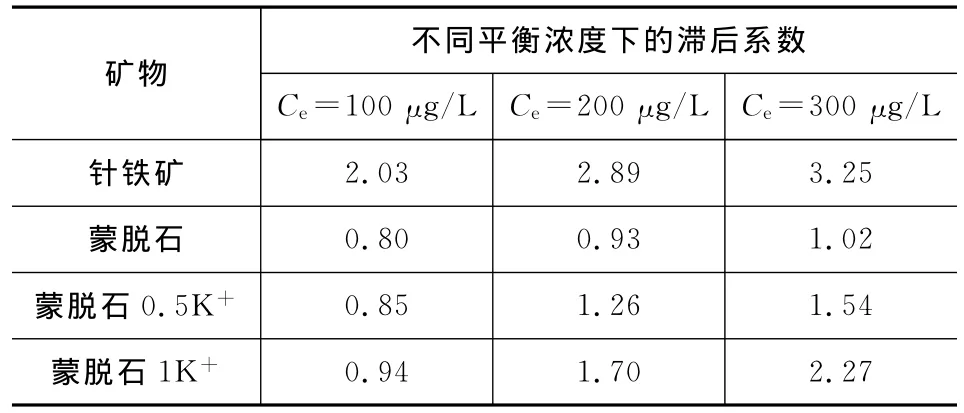
表3 矿物吸附解吸菲的滞后系数Tab.3 Hysteresis indexes of sorption and desorption of minerals to phenanthrene
2.6 吸附热力学方程
本研究考察了温度(303K、313K、323K)对矿物吸附菲的影响。
根据Van't Hoff方程[21-22]计算等量吸附焓变

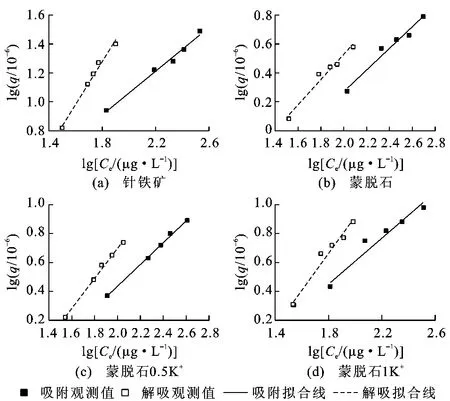
图6 矿物对菲的吸附解吸等温线Fig.6 Sorption and desorption isotherms of minerals to phenanthrene
用Gibbs方程[21,23]计算吸附自由能变

根据Gibbs-Helmholtz方程[21,24]计算吸附熵变

式中:ΔH为等量吸附焓变;r为气体常数;K0为常数;T为绝对温度;ΔG为吸附自由能变;ΔS为吸附熵变。
从图7可知,ln[Ce/(μg·L-1)]对1/T呈现良好的线性关系,说明吸附过程服从Van't Hoff方程。由式(6)~(8)计算得到在不同吸附量时矿物对菲的吸附热力学参数(表4)。

表4 矿物对菲的吸附热力学参数Tab.4 Sorption thermodynamic parameters of minerals to phenanthrene

图7 矿物对菲的吸附等量线Fig.7 Sorption isosters of minerals to phenanthrene

图8 不同温度下矿物对菲的吸附等温线Fig.8 Sorption isotherms of minerals to phenanthrene in different temperatures
由表4可知,ΔG为负值,表明此反应是一个自发的吸附过程;ΔG的变化比较小,表明吸附过程在较低的吸附量下熵具有补偿作用,在吸附反应中,ΔH和ΔS对ΔG起着相反的作用,这种互补关系的微观本质与分子间作用力、分子运动自由度有关[25]。
ΔS为负值,主要因为吸附质被吸附在矿物表面后其运动受到限制,使吸附熵减小;在一定的吸附量下,ΔS均随着温度升高而呈减小趋势;但在同一温度下,对于针铁矿,ΔS随吸附量增加而增加,即表明随着吸附的进行,菲在针铁矿上的吸附受到更大的限制,因此焓变是吸附的主要驱动力[26]。
ΔH为负值,说明该吸附是放热过程,矿物对菲的吸附作用力随着温度升高而减小,这与式(4)中KF随着温度升高而降低保持一致;对于针铁矿,ΔH绝对值随吸附量增加而增加,与ΔS的变化规律一致;而对于蒙脱石以及K+改性蒙脱石,ΔH绝对值随着吸附量增大而减小,这是因为蒙脱石表面能量不均匀。在刚开始吸附时,吸附质首先吸附在矿物吸附中心能量较高的位点上,此时放出的热量最大。随着吸附的进行,高能量的吸附位点逐渐被占据,后来吸附质只能吸附在能量较低的位点上,此时放出的热量减少。图8为不同温度时,上述矿物对菲的Freundlich吸附模型等温曲线。从图8可以看出,在试验浓度范围内,菲在矿物上的吸附量随着温度升高而降低,这进一步说明温度升高不利于吸附的进行。
3 结 语
(1)菲在针铁矿和蒙脱石上的吸附解吸等温线均表现出明显的非线性和解吸滞后现象。Freundlich吸附模型可较好地描述菲的吸附解吸行为。
(2)与蒙脱石相比,针铁矿对菲的吸附能力更强,非线性程度更高,解吸滞后也愈明显,表明针铁矿对菲的吸附能力更强、更稳定。
(3)在同一温度下,蒙脱石对菲的吸附能力随着K+浓度的增加而增强,说明软阳离子K+对蒙脱石吸附菲的强化作用明显。
(4)在试验温度范围内,菲在矿物上的吸附量随着温度升高而降低。吸附自由能变ΔG<0,表明矿物对菲的吸附是一个自发的过程;等量吸附焓变ΔH<0,吸附表现为放热过程,适当降低温度有利于吸附;吸附熵变ΔS<0,说明菲被吸附在矿物表面后其运动受到限制。
[1] VOICE T C,WEBER J W J.Sorption of hydrophobic compounds by sediments,soils and suspended solids I:theory and background[J].Water Research,1983,17(10):1433-1441.
[2] SORRELL R K,BRASS H J,REDING R.A review of occurrences and treatment of polynuclear aromatic hydrocarbons in water[J].Environment International,1980,4(3):245-254.
[3] BRUN G L,VAIDYA O C,LEGER M G.Atmospheric deposition of polycyclic aromatic hydrocarbons to Atlantic Canada:geographic and temporal distributions and trends 1980-2001[J].Environmental Science and Technology,2004,38(7):1941-1948.
[4] LUTHY R G,AIKEN G R,BRUSSEAU M L,et al.Sequestration of hydrophobic organic contaminants by geosorbents[J].Environmental Science and Technology,1997,31(12):3341-3347.
[5] ALLEN-KING R M,GRATHWOHL P,BALL W P.New modeling paradigms for the sorption of hydrophobic organic chemicals to heterogeneous carbonaceous matter in soils,sediments,and rocks[J].Advances in Water Resources,2002,25(8/9):985-1016.
[6] HUNDAL L S,THOMPSON M L,LAIRD D A,et al.Sorption of phenanthrene by reference smectites[J].Environmental Science and Technology,2001,35(17):3456-3461.
[7] 鲁安怀,卢晓英,任子平,等.天然铁锰氧化物及氢氧化物环境矿物学研究[J].地学前缘,2000,7(2):473-483.LU An-huai,LU Xiao-ying,REN Zi-ping,et al.New advances in environmental mineralogy of natural oxides and hydroxides of iron and manganese[J].Earth Science Frontiers,2000,7(2):473-483.(in Chinese)
[8] 吴大清,刁桂仪.含铁矿物的表面催化氧化作用及其环境意义[J].矿物岩石,2003,23(4):11-14.WU Da-qing,DIAO Gui-yi.The surface catalyzed oxidation of iron-bearing minerals and their environmental significations[J].Journal of Mineralogy and Petrology,2003,23(4):11-14.(in Chinese)
[9] 高海英,杨仁斌,龚道新.蒙脱石的吸附行为及其环境意义[J].农业环境科学学报.2006,25(增):438-442.GAO Hai-ying,YANG Ren-bin,GONG Dao-xin.Adsorption behavior of microorganisms and environmental significant[J].Journal of Agro-environment Science,2006,25(S):438-442.(in Chinese)
[10] 吴平霄.污染物与蒙脱石层间域的界面反应及其环境意义[J].环境污染治理技术与设备,2003,4(5):37-41.WU Ping-xiao.The interface reaction between pollutants and montmorillonite interlayer and its environmental significance[J].Techniques and Equipment for Environmental Pollution Control,2003,4(5):37-41.(in Chinese)
[11] MA J C,DOUGHERTY D A.The cation-πinteraction[J].Chemical Reviews,1997,97(5):1303-1324.
[12] ZHU D,HERBERT B E,SCHLAUTMAN M A,et al.Cationπbonding:a new perspective on the sorption of polycyclic aromatic hydrocarbons to mineral surfaces[J].Journal of Environmental Quality,2004,33(4):1322-1330.
[13] HADERLEIN S B,WEISSMAHR K W,SCHWARZENBACH R P.Specific adsorption of nitroaromatic explosives and pesticides to clay minerals[J].Environmental Science and Technology,1996,30(2):612-622.
[14] SCHWERTMANN U,CORNELL R M.Iron oxides in the laboratory:preparation and characterization[M].2nd ed.Weinheim:Wiley-VCH,2000.
[15] NKEDI-KIZZA P,RAO P S C,HORNSBY A G.Influence of organic cosolvents on sorption of hydrophobic organic chemicals by soils[J].Environmental Science and Technology,1985,19(10):975-979.
[16] HUANG W L,WEBER J W J.A distributed reactivity model for sorption by soils and sediments 10:relationships between sorption,hysteresis and the chemical characteristics of organic domains[J].Environmental Science and Technology,1997,31(9):2562-2569.
[17] 杨 琛,傅家谟,盛国英,等.地质吸附剂对萘的吸附与解吸行为研究[J].环境化学,2006,25(1):32-36.YANG Chen,FU Jia-mo,SHENG Guo-ying,et al.The sorption and desorption of naphthalene on geosorbents[J].Environmental Chemistry,2006,25(1):32-36.(in Chinese)
[18] BACHMANN J,GUGGENBERGER G,BAUMGARTL T,et al.Physical carbon-sequestration mechanisms under special consideration of soil wettability[J].Journal of Plant Nutrition and Soil Science,2008,171(1):14-26.
[19] CHIOU C T,KILE D E,RUTHERFORD D W,et a1.Sorption of selected organic compounds from water to a peat soil and its humic-acid and humin fractions:potential sources of the sorption nonlinearity[J].Environmental Science and Technology,2000,34(7):1254-1258.
[20] WEBER J W J,HUANG W L,YU H.Hysteresis in the sorption and desorption of hydrophobic organic contaminants by soils and sediments 2:effects of soil organic matter heterogeneity[J].Journal of Contaminant Hydrology,1998,31(1/2):149-165.
[21] GARCIA-DELGADO R A,COTORUELO-MINGUEZ L M,RODRIGUEZ J J.Equilibrium study of single-solute adsorption of anionic surfactants with polymeric XAD resins[J].Separation Science and Technology,1992,27(7):975-987.
[22] JUANG R S,CHOU T C.Sorption of citric acid from aqueous solutions by macroporous resins containing a tertiary amine equilibria[J].Separation Science and Technology,1996,31(10):1409-1425.
[23] KOSTURA B,KULVEITOVA H,LESKO J.Blast furnace slags as sorbents of phosphate from water solutions[J].Water Research,2005,39(9):1795-1802.
[24] JUANG R S,SHIAU J Y,SHAO H J.Effect of temperature on equilibrium adsorption of phenols onto nonionic polymeric resins[J].Separation Science and Technology,1999,34(9):1819-1831.
[25] 袁彦超,陈炳稔,王瑞香,等.新型交联壳聚糖树脂的制备及其对苯甲酸的吸附行为研究[J].化学学报,2004,62(8):842-846.YUAN Yan-chao,CHEN Bing-ren,WANG Rui-xiang,et al.Studies on preparation of the novel crosslinked chitosan resin and adsorption of benzoic acid[J].Acta Chimica Sinica,2004,62(8):842-846.(in Chinese)
[26] 赵振国,赵子建,顾惕人.自溶液中的吸附Ⅻ:活性炭自水中吸附芳香化合物的热力学研究[J].化学学报,1985,43(9):813-818.ZHAO Zhen-guo,ZHAO Zi-jian,GU Ti-ren.Adsorption from solutionⅫ:thermodynamic study of adsorption of aromatic compounds from water onto activated carbon[J].Acta Chimica Sinica,1985,43(9):813-818.(in Chinese)
