NaAlO2溶液中铝酸根离子的微观结构
2012-01-29曾双亲杨清河陈小新
曾双亲,杨清河,陈小新,聂 红
(中国石化石油化工科学研究院,北京100083)
NaAlO2溶液是氧化铝工业生产的重要中间产物[1-2],也是碱法 (NaAlO2-Al2(SO4)3法[3-4]和NaAlO2-CO2法[5-6])制备γ-氧化铝载体前驱物拟薄水铝石的重要原料。在NaAlO2-Al2(SO4)3法拟薄水铝石工艺开发过程中发现,当NaAlO2溶液中氧化铝浓度、氧化钠浓度等化学组成基本相同的条件下,NaAlO2溶液的制备方式严重影响制备出的拟薄水铝石产品的性质,因此研究NaAlO2溶液微观结构组成具有重要意义。
NaAlO2溶液是过饱和Al2O3-Na2O-H2O体系,溶液中的NaAlO2实际上完全离解为钠离子和铝酸根阴离子[2],通常所说的NaAlO2溶液的微观结构,指的是铝酸根阴离子的组成和结构。鉴于NaAlO2溶液结构的复杂性,经历了一个多世纪的研究,提出了许多观点,但往往不同研究者的结论难以一致。原因可能是NaAlO2溶液的微观结构不仅与Al2O3浓度、苛性系数等有关,还可能与配制方式、储存方式等有关。1952年,Lippincott等[7]根据铝酸钠溶液的拉曼光谱特性,提出其中铝酸根离子的基本形态为[Al(OH)4]-。Maltsev等[8-9]通过测定饱和以及不饱和铝酸钠溶液中23Na、27Al的核磁共振谱后提出,低浓度NaAlO2溶液中铝酸根离子为[Al(OH)4]-,高浓度(cNa2O≥4mol/L)NaAlO2溶液中[Al(OH)4]-脱水形成AlO2-。Carreira等[10-13]研究了pH值为8~14的过饱和NaAlO2溶液的光谱性质后提出,铝酸根离子的性质随时间而变化,形成(OH)2[Al(OH)4]n(n+2)-类型的聚合离子;pH≥13时,AlO2-为溶液主要成分。Moolenaar等[14]通过研究高浓度(cNa2O≥4mol/L)和低浓度(cNa2O≤1mol/L)铝酸钠溶液的红外、拉曼、核磁共振谱后提出,低浓度过饱和铝酸钠溶液中[Al(OH)4]-占绝对主要成分,而高浓度溶液中部分[Al(OH)4]-脱水形成Al—O—Al桥联的[Al2O(OH)6]2-二聚离子。Chen等[15-16]通过对铝酸钠溶液物理化学性质和光谱性质的研究,得到了与Moolenaar等[14]相似的结论,同时指出铝酸钠溶液的结构性质与制备方式、存放时间有关[17-18],另外提出在高苛性比溶液中[Al(OH)6]3-与[Al(OH)4]-平衡共存。Heien等[19-21]通过对Na2O浓度大于4mol/L铝酸钠溶液的红外和拉曼光谱的全面研究后提出,铝酸根离子的存在形态与氧化铝的浓度有关,氧化铝浓度为2~2.5mol/L时,溶液中[Al(OH)4]-含量达到最大,而其他浓度条件下,[Al(OH)4]-脱水聚合以Al—O—Al桥联的铝酸根离子较多;苛性比极高时,溶液中可能存在[Al(OH)6]3-[22-23]。Tamas等[24]应用X射线衍射法排除溶液中有AlO2-和[Al(OH)6]3-存在的可能性。
在本研究中,笔者以不同的方式制备了4种Al2O3浓度、苛性系数基本相同的NaAlO2溶液,采用IR、27Al NMR和紫外UV光谱法3种表征方法对不同方式配制的NaAlO2溶液的微观结构进行了详细的分析表征。
1 实验部分
1.1 试剂
浓NaOH溶液,取自催化剂长岭分公司工业40%离子膜液碱;氢氧化铝粉:中国铝业广西平果铝厂产品,w(Al2O3)=65%。
1.2 NaAlO2溶液配制
分别在工业溶解釜(5m3)和实验室溶解釜(10L)中,搅拌条件下在浓NaOH溶液中加入去离子水,得到一定浓度的NaOH溶液,然后在搅拌下加入一定量的氢氧化铝粉,加热升温至预定温度,保持温度恒定适当时间,配制得到NaAlO2溶液。按不同升温、恒温方式,配制出4种NaAlO2溶液(编号Ⅰ、Ⅱ、Ⅲ、Ⅳ),其中溶液Ⅰ、Ⅱ为一段恒温方式配制,溶液Ⅲ、Ⅳ为两段恒温方式配制[25]。
1.3 分析与表征
1.3.1 化学分析方法
采用EDTA络合滴定法和酸碱中和滴定法测定NaAlO2溶液中的Al2O3和Na2O质量浓度(c(Al2O3)和c(Na2O),g/L),根据公式αk=1.645 c(Na2O)/c(Al2O3)计算NaAlO2溶液的苛性系数(αk)。
1.3.2 光谱表征方法
(1)红外吸收光谱法(IR):采用薄膜法制样,用刮刀取适量的试样均匀涂于KBr晶片上,然后将另一块窗片盖上,稍加压力,来回推移,使之形成一层均匀无气泡的液膜,然后采用Bruker公司IFS113V红外光谱仪进行红外光谱测试。得到400~2000cm-1范围内的红外吸收光谱,以表征溶液中含铝阴离子的红外吸收特征。
(2)核磁共振谱法(27Al NMR):采用Varian INOVA 500M核磁共振仪,在500MHz、脉冲宽度0.800μs、脉冲延迟1.0s、转速20kHz的条件下测定,扫描次数1224次。
(3)紫外吸收光谱法(UV):采用美国Perkin-Elmer公司Lambda 35紫外/可见光分析仪,在氖灯光源、测量波长286nm、狭缝宽度1.0nm、样品检测时间4.5min、检测步长2.0s的实验条件下测定样品在190~400nm范围内的紫外吸收光谱。
2 结果与讨论
2.1 NaAlO2溶液的化学组成
采用EDTA络合滴定法、酸碱中和滴定法测得的4种溶液的Na2O和Al2O3浓度及苛性系数列于表1。
从表1可以看出,4种NaAlO2溶液的c(Al2O3)、c(Na2O)、αk相近,说明溶液的化学组成基本相同。
2.2 NaAlO2溶液的IR表征结果
4种NaAlO2溶液的FT-IR谱见图1。从图1可以看出,4种溶液在630、720和880cm-1左右均有较清晰的吸收峰,其中,720cm-1处的红外吸收峰最为显著,而630和880cm-1处的红外吸收峰较弱;低于630cm-1的红外吸收峰无法准确分辨。溶液I在880cm-1左右的红外吸收峰强度相比其他3种溶液更弱。杨金秀等[26]认为,720cm-1左右的吸收峰对应于[Al(OH)4]-的反对称伸缩振动,柳妙修、Robert等[27-28]通过实验证明,880cm-1左右的吸收峰对应于二聚[Al2O(OH)6]2-离子的振动吸收,Tarte[29]将630cm-1左右的吸收峰归因于[Al(OH)6]3-基团缩合离子(如[Al2(OH)10]4-等)的振动吸收,Moolenaar等[30]认为500~600cm-1左右的吸收峰为AlO6和缩聚AlO6八面体的特征吸收。借鉴上述各作者的结果及图1可知,4种NaAlO2溶液在720cm-1左右均存在主要吸收峰,说明4种NaAlO2溶液均以四配位[Al(OH)4]-为主。溶液I在880cm-1左右的吸收峰基本不可见,说明溶液I中不存在或者只含有很少量的二聚四配位[Al2O(OH)6]2-离子,其他3种溶液在880cm-1左右吸收峰清晰可见,说明3种溶液中均含有二聚四配位[Al2O(OH)6]2-离子。

表1 不同方式配制的NaAlO2溶液的Na2O和Al2O3浓度和苛性系数(αk)Table 1 Concentration of Na2O and Al2O3and caustic ratio(αk)of NaAlO2solution prepared by different procedures

图1 不同方式制备的NaAlO2溶液的FT-IR谱Fig.1 FT-IR spectra of NaAlO2solutions prepared by different procedures
2.3 NaAlO2溶液的27Al NMR表征结果
4种NaAlO2溶液的27Al NMR谱如图2所示。

图2 不同方式配制的NaAlO2溶液的27 Al NMR谱Fig.2 27 Al NMR profiles of NaAlO2solutions prepared by different procedures
从图2可以看出,4种NaAlO2溶液在化学位移δ为80左右均有1个非常显著的谱峰,在δ=0处没有谱峰,δ为20~70范围内的谱峰虽然不明显,但溶液Ⅰ的明显低。27Al NMR是区分铝的配位数的有效手段[31],许多研究工作者使用27Al NMR对NaAlO2溶液进行过详细的研究,表2列出了前人研究的与NaAlO2溶液相关的Al(Ⅲ)离子特征与27Al NMR化学位移δ的关系。
结合表2和图2可知,δ=80处对应的离子应为四配位[Al(OH)4]-,说明4种NaAlO2溶液中的主体离子都是四配位[Al(OH)4]-,均无六配位[Al(OH)6]3-离子,而且溶液Ⅱ、Ⅲ、Ⅳ中还有可能存在着其他27Al NMR不易检测到的多核络合铝阴离子(δ在20~70范围内,如[Al2(OH)2(H2O)8]4+、[Al(OAlO)4]-、Al13、Al30等),而溶液Ⅰ中不存在或含量极低。
2.4 NaAlO2溶液的UV表征结果
4种NaAlO2溶液的UV光谱如图3所示。
由图3可以看出,在~230nm处,4种NaAlO2溶液均存在吸收峰,峰形显著;在~270nm处,溶液Ⅰ无吸收或者吸收不明显,而其他3种溶液吸收显著,并且溶液Ⅳ的吸收峰高于溶液Ⅱ、Ⅲ;在~370nm处,溶液Ⅱ、Ⅲ存在吸收峰,溶液Ⅰ、Ⅳ无吸收。

表2 Al(Ⅲ)离子27 Al NMR的化学位移(δ)Table 2 27 Al NMR chemical shift(δ)of Al(Ⅲ)ion

图3 不同方式配制的NaAlO2溶液的UV谱Fig.3 UV spectra of NaAlO2solutions prepared by different procedures
NaAlO2溶液的铝酸根阴离子由于产生n→π*的电子跃迁,在190~400nm范围内存在较明显的UV吸收。一般而言,UV光谱吸收强度上升,表明对应离子的浓度增大,反之亦然。刘洪霖等[20]认为,在~230nm和~270nm的紫外吸收峰分别为[Al(OH)4]-和[Al2O(OH)6]2-离子的最高占有轨道电子向最低空轨道跃迁时产生的吸收峰。Ma等[43]通过研究认为,NaAlO2溶液中~370nm的紫外吸收峰是由于在高苛性比条件下[Al(OH)4]-与OH-形成六配位[Al(OH)6]3-,再形成二聚六配位[(OH)4AlO2Al(OH)4]6-离子而引起的。本研究中的4种溶液的苛性比基本相同,而且通过27Al NMR可以排除六配位[Al(OH)6]3-的存在,由[Al(OH)6]3-二聚成[(OH)4AlO2Al(OH)4]6-离子的可能性因此也不大,所以尚不能完全确定处于~370nm处紫外吸收所属离子的结构。通过以上分析可以认为,4种溶液中主要离子都是[Al(OH)4]-,溶液Ⅰ中基本不含二聚[Al2O(OH)6]2-离子,而其他3种溶液中含有少量二聚[Al2O(OH)6]2-,且溶液Ⅳ中二聚[Al2O(OH)6]2-离子的浓度最高,说明采用两段恒温方法在实验室中制备出的溶液二聚[Al2O(OH)6]2-浓度最大;溶液Ⅱ、Ⅲ中可能还含有结构尚不能完全确定的离子。
将上述3种光谱表征结果汇总得到4种NaAlO2溶液的主要光谱特征及其对应的微观结构信息列于表3。
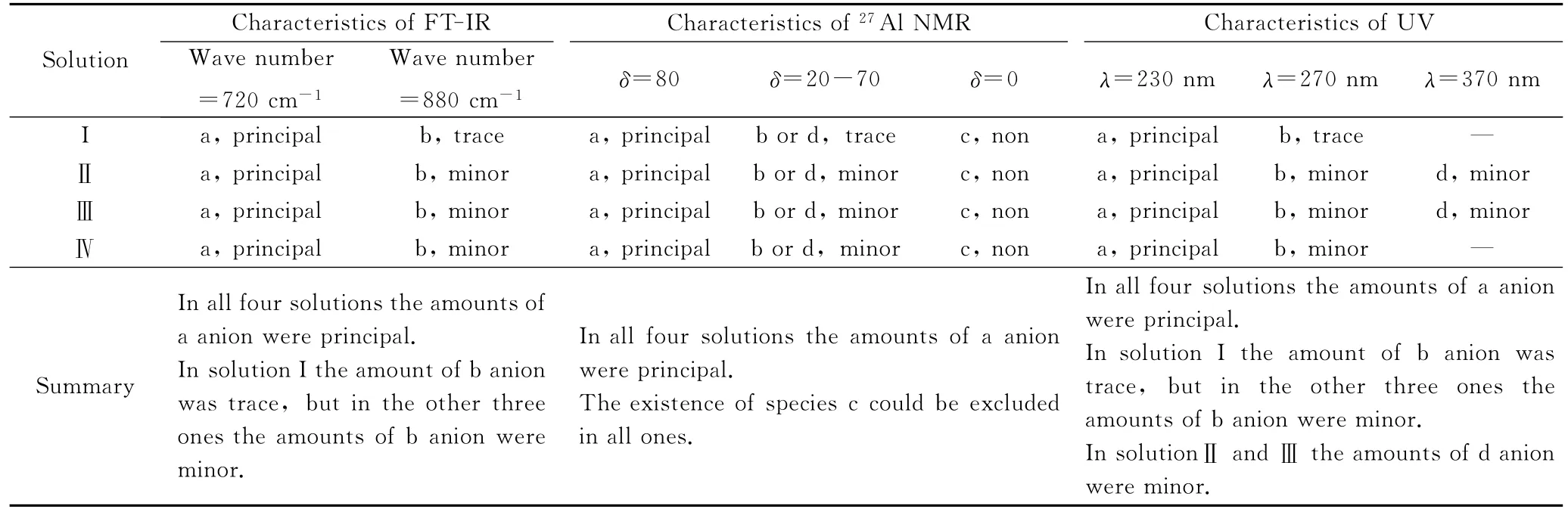
表3 不同方式配制的NaAlO2溶液的主要光谱特征Table 3 Spectral characteristics of NaAlO2solutions prepared by different procedures
从表3可以看出,IR、27Al NMR和UV 3种光谱方法的表征结果可以相互补充、支持,共同给出NaAlO2溶液的微观粒子组成信息。
3 结 论
(1)IR、27Al NMR和UV 3种光谱方法给出的信息可以相互补充、支持,共同给出NaAlO2溶液中铝酸根的微观结构信息。
(2)NaAlO2溶液的配制方式对溶液中铝酸根离子的微观结构影响显著。
(3)不同方式配制的NaAlO2溶液中铝酸根均以四配位[Al(OH)4]-为主体离子,不存在六配位[Al(OH)6]3-,但是二聚[Al2O(OH)6]2-含量因配制方式不同而有差别,在方式I配制的溶液中[Al2O(OH)6]2-含量很少或不存在,在方式Ⅱ、Ⅲ、Ⅳ配制的溶液中[Al2O(OH)6]2-显著存在,另外溶液Ⅱ、Ⅲ中还存在紫外~370nm处有吸收的离子。
[1]毕诗文.氧化铝生产工艺[M].北京:化学工业出版社,2006:17-30.
[2]杨重愚.氧化铝生产工艺学[M].北京:冶金工业出版社,1982:8.
[3]长岭炼油厂加氢催化剂会战组.硫酸铝-偏铝酸钠法制备γ-Al2O3的研究[J].石油炼制,1978,11-12:50-57.(Hydrotreating catalyst battle group of Changling refinery.Study of preparationγ-Al2O3by aluminum sulfate-sodium aluminate method[J].Petroleum Processing,1978,11-12:50-57.)
[4]李国印,支建平,张玉林.大孔体积低密度活性氧化铝的制备与表征[J],石油炼制与化工,2007,38(5):28-33.(LI Guoyin,ZHI Jianping,ZHANG Yulin.Preparation and characterization of active alumina with high porosity and low bulk density[J].Petroleum Processing and Petrochemicals,2007,38(5):28-33.)
[5]周峰,张艳,樊慧芳.拟薄水铝石的偏铝酸钠-二氧化碳法制备[J].世界有色金属,2008,(5):31-33.(ZHOU Feng,ZHANG Yan,FAN Huifang.Researches on the preparation of pseudo-boemite with sodium aluminate-carbon dioxide process[J].World Nonferrous Metals,2008,(5):31-33.)
[6]杨清河,李大东,庄福成,等.NaAlO2-CO2法制备拟薄水铝石规律的研究[J].石油炼制与化工,1999,30(4):59-63.(YANG Qinghe,LI Dadong,ZHUANG Fucheng,et al.Studies on preparation of pseudoboehmite from neutralization of NaAlO2aqueous solution by CO2[J].Petroleum Processing and Petrochemicals,1999,30(4):59-63.)
[7]LIPPINCOTT E R,PSELLOS J A,TOBIN M C.The Raman spectra and structures of aluminate and zincate ions[J].J Chem Phys,1952,20(3):536.
[8]MALTSEV G Z,MALININ G V.Thermodynamic properties and H1and Na23NMR spectra of sodium hydroxide solutions[J].Journal of Structural Chemistry,1965,6(3):353-358.
[9]MALTSEV G Z,MALINING V.The structure of aluminate solutions[J].Journal of Structural Chemistry,1965,6(3):359-362.
[10]CARREIRA L A,MARONI V A.Raman and Infrared spectra and structures of the aluminate ions[J].J Chem Phys,1966,45(6):2216-2220.
[11]MIRONOV V E,PAVLVOV L V.The structure of aluminate ions[J].Tsvetnye Metally,1969,42(7):56-57.
[12]PAVLOV L N,EREMIN N I.Raman spectra of aqueous solutions of lithium,sodium and potassium aluminates[J].Tsvetnye Metally,1969,42(8):56-58.
[13]陈念贻.氧化铝生产的物理化学[M].上海:上海科技出版社,1962.
[14]MOOLENAAR R J,EVANS J C,MCKEEVER L D.The structure of the aluminate ion in solutions at high pH[J].J Phys Chem,1970,74(20):3629-3636.
[15]CHEN N Y,LIU M X.Studies on the anionic species of solutions[J].Science in China,Series B,1993,36(1):32-38.
[16]CHEN Nianyi,LIU Miaoxiu.Activity of NaOH in solution aluminate solutions[J].Journal of Materials Science &Technology,1992,8(5):376-378.
[17]CHEN Nianyi,LIU Miaoxiu,YANG Jinxiu.Influence of preparative history on structure and properties of sodium aluminate solution[J].Transactions of Nonferrous Metals Society of China,1992,2(2):28-31.
[18]CHEN Nianyi,LIU Miaoxiu,YANG Jinxiu.Influence of preparative history on physico-chemical properties of sodium aluminate solutions[J].Journal of Materials Science &Technology,1992,8(2):135-137.
[19]HELEN W.Spectroscopy of concentrated sodium aluminate solution[J].Applied Spectroscopy,1998,52(2):250-258.
[20]刘洪霖,曹益林,陈念贻.铝酸钠溶液的紫外吸收峰[J].物理化学学报,1992,8(4):441-444.(LIU Honglin,CAO Yilin,CHEN Nianyi.The absorption peaks of sodium aluminate solutions[J].Acta Physico-Chemica Sinica,1992,8(4):441-444.)
[21]洪梅,曹益林,柳妙修,等.铝酸钠溶液的27Al核磁共振谱研究[J].轻金属,1994,(5):26-27.(HONG Mei,CAO Yilin,LIU Miaoxiu,et al.Study of27Al NMR spectra on sodium aluminate solutions[J].Light Metal(Chinese),1994,(5):26-27.)
[22]柳妙修,曹益林,陈念贻,等.高苛性比铝酸钠溶液的光谱研究[J].金属学报,1991,27(6):443-445.(LIU Miaoxiu,CAO Yilin,CHEN Nianyi,et al.On the Raman spectra of sodium solution with high-caustic ratio and high concentration[J].Acta Metalurgica Sinica,1991,27(6):443-445.)
[23]EREMIN N I,VBIOKHOV Y A.Structure and behavior of aluminate solutions[J].Russian Chemical Reviews,1974,43(2):224-251.
[24]RADNAI T,PETER M,HEFTER G T,et al.Structure of aqueous sodium aluminate solutions:A solution X-ray diffraction study[J].J Phys Chem A,1998,102(40):7841-7850.
[25]陈小新,杨清河,聂红,等.一种铝酸钠溶液的制备方法:中国,CN 2010101470843[P].2010.
[26]杨金秀,陈建棠,陈念贻,等.LiAl2(OH)7·2H2O等的红外光谱研究[J].化学物理学报,1993,6(3):244-247.(YANG Jinxiu,CHEN Jiantang,CHEN Nianyi,et al.IR spectra of solid compound LiAl2(OH)7·2H2O[J].Chinese Journal of Chemical Physics,1993,6(3):244-247.)
[27]柳妙修.氧化铝生产过程的几个物理化学问题研究和模式识别工业优化[D].上海:中国科学院上海冶金研究所,1991.
[28]MOOLENAAR R J,EVANS J C,MCKEEVER L D.The structure of the aluminate ion in solutions at high pH[J].J Phys Chem,1969,74(20):3629-3636.
[29]TARTE P.Infra-red spectra of inorganic aluminates and characteristic vibrational frequencies of AlO4tetrahedra and AlO6octahedra[J].Spectrochimica Acta Part A:Molecular Spectroscopy,1967,23(7):2127-2143.
[30]MOOLENAAR R J,EVANSJ CL,MCKEEVER L D.The structure of the aluminate ion in solutions at high pH[J].J Physical Chemistry,1970,74(20):3629-3636.
[31]AKITT J W,GESSNER W,WEINBERGER M.Highfield aluminium-27nuclear magnetic resonance investigations of sodium aluminate solutions[J].Magnetic Resonance in Chemistry,1988,26(12):1047-1050.
[32]AKITT J W.Multinuclear studies of aluminum compounds[J].Progress in Nuclear Magnetic Resonance Spectroscopy,1989,21(1-2):1-149.
[33]陈朝阳,栾兆坤,张忠国,等.总铝浓度对纳米Al13向Al30形态转化的影响[J].科学通报,2005,50(14):1445-1449.(CHEN Zhaoyang,LUAN Zhaokun,ZHANG Zhongguo,et al.Effect of total aluminum concentration on the formation and transformation of nanosized Al13and Al30in hydrolytic polymeric aluminum aqueous solutions[J].Chinese Science Bulletin,2005,50(14):1445-1449.)
[34]BERTSCH P M,BARNHISEL R I,THOMAS G W,et al.Quantitative determination of aluminum-27by high-resolution nuclear magnetic resonance spectrometry[J].Analytical Chemistry,1986,58(12):2583-2585.
[35]KLAUS R K.Quantitative determination of aluminum in tea by means of aluminum-27nuclear magnetic resonance spectroscopy[J].Analyst,1990,115(6):823-825.
[36]WILSON M A,COLLIN P J,AKITT J W.Composition of aluminum phosphate solutions:Evidence from aluminum-27and phosphorus-31nuclear magnetic resonance spectra[J].Anal Chem,1989,61(11):1253-1259.
[37]冯利,栾兆坤,汤鸿霄.铝的水解聚合形态分析方法研究[J].环境化学,1993,12(5):373-379.(FENG Li,LUAN Zhaokun,TANG Hongxiao.The study on the speciation analysis methods for hydrolysis polymerization of aluminum[J].Environmental Chemistry,1993,12(5):373-379.)
[38]AKITT J W,FARTHING A.Aluminum-27NMR studies of the hydrolysis aluminum(Ⅲ)Part 4 Hydrolysis using sodium carbonate[J].J Chem Soc,Dalton Trans,1981,9(7):1617-1623.
[39]KUNWAR A C,THOMPSON A R,GUTOWSKY H S,et al.Solid state aluminum-27NMR studies of tridecameric Al-oxo-hydroxy clusters in basic aluminum selenate,sulfate,and the mineral zunyite[J].Journal of Magnetic Resonance,1984,60(3):467-472.
[40]AKITT J W,GESSNER W.Aluminum-27nuclear magnetic resonance investigations of highly alkaline aluminate solutions[J].J Chem Soc Dalton Trans,1984,12(2):147-148.
[41]HEATH S L,JORDAN P A,JOHNSON I D,et al.Comparative X-ray and27Al NMR spectroscopic studies of the speciation of aluminum[J].Journal of Inorganic Biochemistry,1995,59(4):785-794.
[42]BERTSCH PAUL M,THOMAS GRANT W,BARNHISEL RICHARD I Characterization of hydroxyaluminum solutions by aluminum-27nuclear magnetic resonance spectroscopy[J].Soil Science Society of America Journal,1986,50(3):825-830.
[43]MA Shuhua,ZHENG Shili,XU Hongbin,et al.Spectra of sodium aluminate solutions[J].Transactions of Nonferrous Metals Society of China,2007,17(4):853-857.
