紫檀芪对人乳腺癌MDA-MB-231细胞系增殖及凋亡的影响
2012-01-29黄海进何秀芝
黄海进,焦 峰,何秀芝
(中国人民解放军第82医院,江苏淮安223001)
乳腺癌是常见且高发的恶性肿瘤之一,严重危害女性健康,目前治疗主要通过手术和放化疗,而大多化疗药物都有严重的不良反应[1~3]。一些天然物质(白藜芦醇、青蒿琥酯、雷公藤内酯醇等)由于有抗肿瘤作用且几乎无不良反应,近年来人们越来越重视其在抗乳腺肿瘤方面的研究和应用[4,5]。目前关于白藜芦醇抗肿瘤效果和机制的研究很多,其可抑制多种恶性肿瘤细胞生长。紫檀芪(PTE)广泛存在于多种小浆果和红酒中,其与白藜芦醇都属于芪类化合物。研究表明,甲基化的芪类化合物比羟基化的芪类化合物具有更高的生物活性。PTE除具有降血脂、降血糖、抗氧化作用,还能显著抑制多种肿瘤细胞增殖、侵袭和转移[6]。目前关于PTE治疗乳腺癌的研究尚无报道,2010年2月~2011年10月,本研究将以体外培养的人乳腺癌MDA-MB-231细胞系作为研究对象,观察PTE对其增殖及凋亡的影响,从而为临床药物治疗乳腺癌提供新的思路。
1 材料与方法
1.1 细胞和材料 乳腺癌MDA-MB-231细胞购自中国科学院上海细胞研究所细胞库。PTE(Santa Cruz公司,美国),Caspase-Glo®3/7定量试剂盒(Promega公司,美国),TUNEL检测试剂盒(碧云天公司,上海),DMEM低糖培养液(Hyclone公司,美国),胎牛血清(杭州四季青公司),MTT、胰蛋白酶、DMSO(Sigma,美国)。CO2细胞培养箱、酶标仪(Thermo,美国),超净工作台(苏州净化设备仪器厂,苏州),倒置荧光显微镜(Nikon,日本),ZW-A微量振荡器(常州国华公司,常州),低速离心机(Beckman Coulter公司,美国)。
1.2 方法
1.2.1 细胞培养 MDA-MB-231细胞用含10%小牛血清的DMEM在37℃、5%CO2培养箱内培养3~4 d。细胞融合后,用0.25%胰蛋白酶消化。根据实验需要细胞接种于不同的培养板或培养瓶中。细胞长到实验需要的密度,换用无血清的DMEM培养24 h,即可进行实验。
1.2.2 MTT法检测不同浓度PTE对MDA-MB-231细胞增殖的影响 实验分为5组(对照组,PTE 10、20、40、80 μmol/L组),每组10个复孔。各组细胞孵育24、48、72 h后,弃去培养液,加入100 μL的DMEM和10 μL的0.5%MTT,培养箱内孵育4 h后,弃培养液,加入100 μL的DMSO原液,振荡5 min,使结晶完全溶解,然后用酶标仪(波长为490 nm)测定吸光值(OD值),实验重复3次。
1.2.3 黏附实验测定细胞黏附能力 实验方法参照文献报道[7],稍作改动。具体如下:将细胞种于75 mL培养瓶中,各组处理结束后,PBS洗3遍,0.25%胰蛋白酶进行消化,离心、重悬,每组细胞计数1×105/mL,种于96孔板,每组10个复孔。接种0.5 h后弃去培养液和未贴壁的细胞,加入100 μL的DMEM和10 μL的0.5%MTT,培养箱内孵育4 h,然后倒置显微镜拍照,不同观察者对同一视野的细胞计数,实验重复3次。
1.2.4 TUNEL法检测细胞凋亡率 制作各组细胞爬片,处理结束后4%的多聚甲醛固定15 min。PBS洗涤(5 min×3次),0.1%的Triton X-100打孔5 min,PBS洗涤(5 min×3次)。严格按照试剂盒说明书操作,按每玻片2 μL的TdT酶、48 μL的荧光标记液配制TUNEL检测液,操作过程中严格避光。每张玻片加50 μL的TUNEL检测液,37℃避光孵育60 min,PBS洗涤(5 min×3次)。用石蜡封片后荧光显微镜下观察,红色荧光为染色阳性,随意选取10个视野计数。
1.2.5 Caspase3/7活性测定 96孔板内的各组细胞处理结束后,加入Caspase-Glo®3/7工作液,每孔100 μL,室温下避光孵育1 h,酶标仪检测荧光强度。凋亡系数设为:实验组荧光强度/对照组荧光强度×100%。
1.2.6 统计学方法 采用SPSS12.0统计软件进行统计分析,实验结果以±s表示。差异显著性检验采用单因素方差分析,比较2组间差异用t检验。以P≤0.05为差异有统计学意义。
2 结果
2.1 MTT结果 不同浓度 PTE(10、20、40、80 μmol/L)孵育24、48、72 h后细胞存活率,见表1。可见PTE可以有效抑制MDA-MB-231细胞的增殖,并呈浓度时间依赖性。
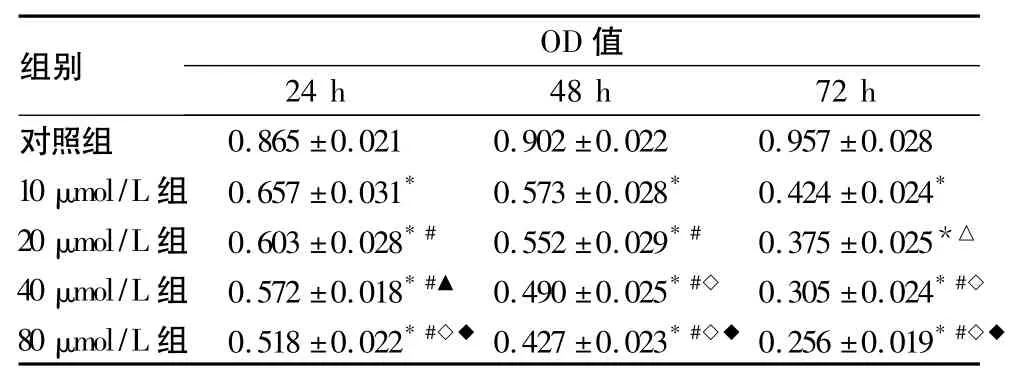
表1 不同浓度PTE处理24、48、72 h后对MDA-MB-231细胞存活率的影响
2.2 黏附实验结果 各组细胞经48 h处理,黏附0.5 h后细胞染色所得显微镜下照片(插页Ⅱ图12)。对照组、10 μmol/L PTE组、20 μmol/L PTE组、40 μmol/L PTE组、80 μmol/L PTE组细胞数分别为696.8±11.2、374.5±9.3、273.2±8.1、224.3 ±6.6、162.2±5.1个/视野。结果表明PTE可以有效抑制MDA-MB-231细胞的黏附能力(P<0.01),并呈浓度依赖性。
2.3 细胞凋亡率检测结果 对照组、10 μmol/L PTE组、20 μmol/L PTE组、40 μmol/L PTE组、80 μmol/L PTE组细胞凋亡率分别为 2.04% ± 0.76%、19.63% ±3.48%、34.23% ±2.95%、42.44%±2.57%、56.40% ±2.38%。与对照组比较,不同浓度PTE可以有效诱导MDA-MB-231细胞凋亡(P<0.01),并呈浓度依赖性。见插页Ⅱ图13。2.4 Caspase3/7活性测定 对照组、10 μmol/L PTE组、20 μmol/L PTE组、40 μmol/L PTE组、80 μmol/L PTE组 Caspase3/7活性分别为 100%、193.6% ±6.4%、272.8% ±12.7%、441.5% ± 19.3%、625.9%±40.4%。与对照组比较,不同浓度PTE可以使MDA-MB-231细胞Caspase3/7活性升高(P<0.01),并呈浓度依赖性。
3 讨论
随着国民经济发展和人民生活水平提高,乳腺癌的发病率和病死率都呈迅猛上升趋势,有报告显示乳腺癌已成为我国妇女发病率第一和病死率第二的恶性肿瘤[8]。乳腺癌手术治疗虽然有一定的治疗效果,但是手术后化疗及手术切口会给广大女性带来很大的生理和心理的痛苦,严重危害女性健康和家庭的稳定[1]。因此,人们越来越重视天然物质在抗乳腺肿瘤方面的研究和应用。
PTE广泛存在于自然界中,是植物在受到外来侵害时所产生的一种抗体性物质,是一种植物抗毒素。研究证实PTE对肝癌、结肠癌等多种肿瘤具有抗癌活性[9~11]。本研究通过MTT和黏附实验发现,PTE可以显著抑制乳腺癌MDA-MB-231细胞的存活率和黏附能力,并表现为药物浓度和作用时间依赖性。肿瘤的发生发展与细胞凋亡有着密切的关系[12,13]。大量研究证实,细胞凋亡与乳腺癌的关系非常密切,并直接影响其预后[7,8]。Caspase3/7属于半胱氨酸天冬氨酸蛋白酶家族,它的激活是细胞进入凋亡阶段最关键的因素之一。本研究发现,PTE在抑制乳腺癌MDA-MB-231细胞增殖、促进细胞凋亡同时,可明显上调Caspase3/7活性。据此我们推断,PTE正是通过对凋亡信号通路的影响发挥抗乳腺癌的作用。
研究证实,PTE的多种生物活性优于或至少不低于白藜芦醇[14]。更值得一提的是,PTE作为天然物质,其药物安全范围很大,较传统的抗肿瘤药物其基本无不良反应[19]。可见,PTE在乳腺癌药物治疗领域将有广阔的研究和开发前景。
[1]Clive KS,Tyler JA,Clifton GT,et al.The GP2 peptide:a HER2/ neu-based breast cancer vaccine[J].J Surg Oncol,2012,105 (5):452-458.
[2]Romero-Cordoba S,Rodriguez-Cuevas S,Rebollar-Vega R,et al.I-dentification and pathway analysis of microRNAs with no previous involvement in breast cancer[J].PLoS One,2012,7(3):e31904.
[3]Rana P,Sridhar SS.Efficacy and tolerability of lapatinib in the management of breast cancer[J].Breast Cancer(Auckl),2012,6:67-77.
[4]Gage M,Wattendorf D,Henry LR.Translational advances regarding hereditary breast cancer syndromes[J].J Surg Oncol,2012,105 (5):444-451.
[5]de Oliveira AM,Pozer MZ,da Silva TA,et al.Extension activities aimed at the prevention and treatment of gynecological and breast cancer:an experience report[J].Rev Esc Enferm USP,2012,46 (1):240-245.
[6]Wang Y,Ding L,Wang X,et al.Pterostilbene simultaneously induces apoptosis,cell cycle arrest and cyto-protective autophagy in breast cancer cells[J].Am J Transl Res,2012,4(1):44-51.
[7]Huang PH,Chen YH,Chen YL,et al.Vascular endothelial function and circulating endothelial progenitor cells in patients with cardiac syndrome X[J].Heart,2007,93(9):1064-1070.
[8]Tang J,Wu CC,Xie ZM,et al.Comparison of Clinical Features and Treatment Outcome of Breast Cancers in Young and Elderly Chinese Patients[J].Breast Care(Basel),2011,6(6):435-440.
[9]Remsberg CM,Yáñez JA,Ohgami Y,et al.Pharmacometrics of pterostilbene:preclinical pharmacokinetics and metabolism,anticancer,antiinflammatory,antioxidant and analgesic activity[J]. Phytother Res,2008,22(2):169-179.
[10]Chiou YS,Tsai ML,Nagabhushanam K,et al.Pterostilbene is more potent than resveratrol in preventing azoxymethane(AOM)-induced colon tumorigenesis via activation of the NF-E2-related factor 2(Nrf2)-mediated antioxidant signaling pathway[J].J Agric Food Chem,2011,59(6):2725-2733.
[11]Nutakul W,Sobers HS,Qiu P,et al.Inhibitory effects of resveratrol and pterostilbene on human colon cancer cells:a side-by-side comparison[J]. JAgric Food Chem,2011,59(20): 10964-10970.
[12]Park HJ,Kim MJ,Ha E,et al.Apoptotic effect of hesperidin through caspase3 activation in human colon cancer cells,SNU-C4[J].Phytomedicine,2008,15(1-2):147-151.
[13]Trouillas M,Saucourt C,Duval D,et al.Bcl2,a transcriptional target of p38alpha,is critical for neuronal commitment of mouse embryonic stem cells[J].Cell Death Differ,2008,15(9):1450-1459.
[14]Ruiz MJ,Fernández M,Picó Y,et al.Dietary administration of high doses of pterostilbene and quercetin to mice is not toxic[J]. J Agric Food Chem,2009,57(8):3180-3186.
