紫外分光光度法在制霉菌素油中制霉素含量测定中的应用
2012-01-29李丽萍张杜娟崔秀君
李丽萍,张杜娟,崔秀君
(济南市妇幼保健院,济南250001)
制霉素为抗真菌类药,能与真菌细胞膜上的特异甾醇结合,使细胞膜破坏,通透性改变,内容物外漏而致细胞死亡,用于治疗皮肤、黏膜等念珠菌感染[1]。制霉菌素油是本院自制外用制剂,由制霉素和甘油混合而成。本实验采用紫外分光光度法测定制霉素含量,用于制霉菌素油的质量控制。
1 仪器与药品
1.1 仪器 UV-2102PCS型紫外分光光度仪(上海龙尼柯仪器有限公司),AL104电子天平(瑞士梅特勒—托利多)。
1.2 药品 制霉素标准品(批号130344-201002,5 341 U/mg,中国食品药品检定研究院),制霉菌素油(鲁药制 ZBH0212,8.7 g/L,批号 20120808,20120814,20120817,济南市妇幼保健院),制霉素原料(批号110908,5 000 U/mg,浙江震元制药有限公司),甘油(批号20120118,湖南尔康制药股份有限公司),甲醇(分析纯,批号T20061214,国药集团化学试剂有限公司)。
2 方法与结果
2.1 制霉菌素油样品制备 取制霉素原料8.7 g,研细,加甘油适量,充分研匀,加甘油至1 000 mL即得。
2.2 溶液配制
2.1.1 储备液配制 精密称取制霉素标准品12 mg,置100 mL棕色量瓶中,加甲醇溶解并定容至刻度,混匀,得120 μg/mL制霉素标准储备液,于4℃冰箱储存。
2.1.2 样品溶液配制 取制霉菌素油样品,摇匀,精密量取1 mL,置50 mL量瓶中,用甲醇洗涤吸管内壁3次,洗液并入量瓶中,加甲醇稀释至刻度,摇匀;精密量取稀释液2 mL,置25 mL量瓶中,加甲醇稀释至刻度,摇匀,即得制霉菌素油样品溶液。
2.3 波长选择 分别取制霉素标准溶液(12 μg/ mL)、制霉菌素油样品溶液,以甲醇为基线,以甘油加甲醇稀释为空白基质,采用紫外分光光度法,在200~400 nm波长范围内扫描。紫外吸收图谱(图1)显示,空白基质基本无吸收,制霉素标准溶液、制霉菌素油样品溶液的紫外吸收光谱一致,有3个吸收峰,分别为290、304、318 nm,在304 nm波长处吸光度最大,故选择304 nm为检测波长。

图1 不同溶液的紫外吸收图谱注:A:甲醇(基线);B:空白基质;C:制霉素标准溶液(12 μg/mL);D:制霉菌素油样品溶液
2.4 线性关系观察 分别精密量取制霉素标准储备液1.5、2.0、2.5、3.0、3.5 mL,置于25 mL量瓶中,加甲醇定容,得7.2、9.6、12.0、14.4、16.8 μg/ mL制霉素系列标准溶液。以甲醇为空白,在304 nm波长处测定吸光度值,以吸光度值对浓度(C)进行线性回归,在浓度7.2~16.8 μg/mL范围内,回归方程为吸光度 =0.009 80+0.047 25C,r= 0.999 6(n=5),表明线性关系良好。
2.5 精密度 分别精密量取制霉素标准储备液适量,用甲醇稀释至高(14.4 μg/mL)、中(12.0 μg/ mL)、低(9.6 μg/mL)3个浓度,测定日内精密度。连续测定3 d,测得日间精密度,结果见表1。由表1数据可知,制霉素测定方法精密度良好。
2.6 重复性与中间精密度 ①重复性:精密量取同一批号的制霉菌素油6份,各1 mL,分别加甲醇稀释定容至50 mL;取稀释液2 mL,加甲醇稀释至25 mL,测定吸光度,计算含量及RSD值。结果见表2。由表2数据可知,该方法重复性良好。②中间精密度:不同分析人员、不同日期分别精密量取同一批号的制霉菌素油6份,各1 mL,用甲醇稀释(方法同重复性试验),测定吸光度,计算含量及RSD值,结果见表3。由表3数据可知,该方法中间精密度良好。
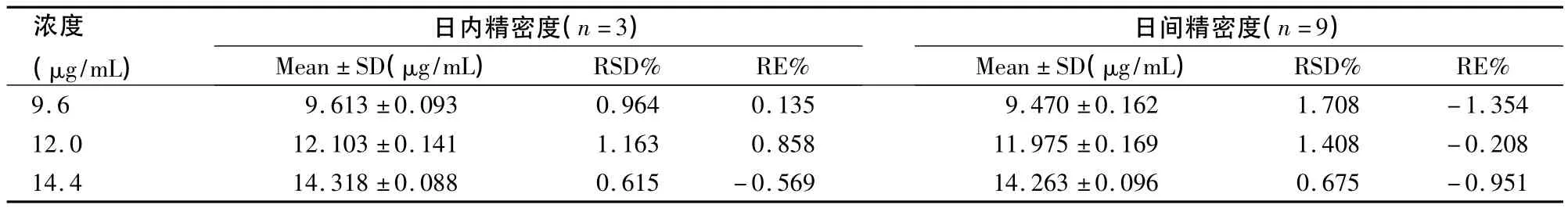
表1 制霉素含量测定日内与日间精密度
2.7 加样回收率 分别精密称取制霉素标准品,加适量甘油,混匀,按处方比例分别配制高(120%)、中(100%)、低(80%)分别为6.96、8.70、10.44 mg/ mL的制霉菌素油样品,每个浓度各3份。分别用甲醇稀释625倍,分别得11.136、13.920、16.704 μg/ mL的制霉素标准溶液,测定吸光度,计算含量及RSD值。结果见表4。由表4数据可知,该方法回收率在98%~102%,符合测定要求。
2.8 稳定性 取制霉菌素油样品溶液和制霉素标准溶液(12 μg/mL)各3份,分别于室温避光放置2、4、8、12 h后,测定吸光度,并计算含量,考察制霉素

表2 制霉素含量测定重复性
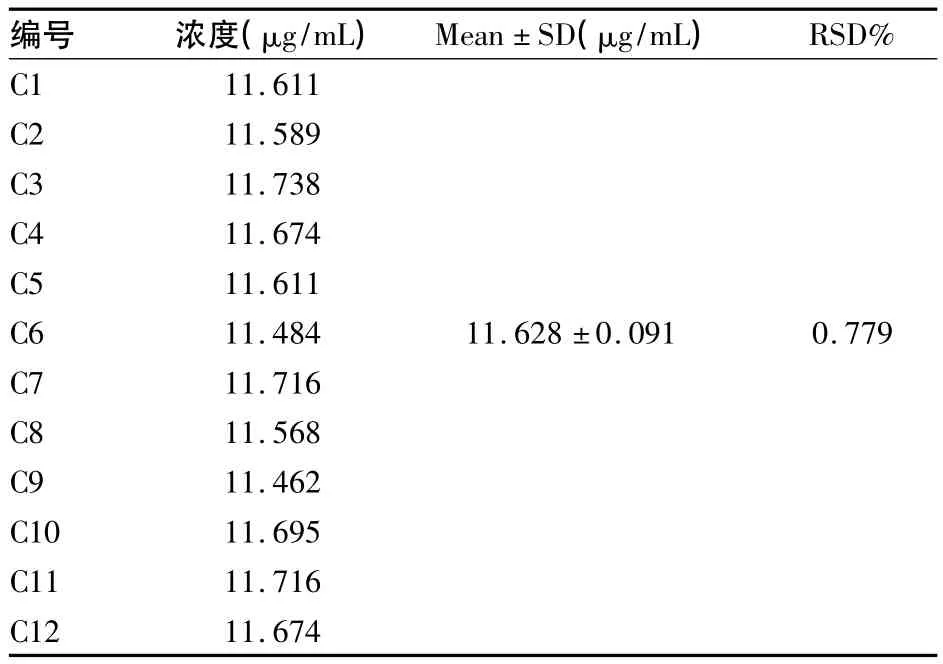
表3 制霉素含量测定中间精密度

表4 制霉素含量测定加样回收率
室温避光放置稳定性。结果见表5。由表5数据可知,制霉菌素油样品溶液和制霉素标准溶液室温避光放置12 h稳定。

表5 制霉素含量测定稳定性
2.9 样品测定 精密称取制霉素标准储备液适量,加甲醇稀释,配制成12 μg/mL制霉素标准溶液。取3个批次制霉菌素油样品各1 mL,按2.1.2方法分别配制成制霉菌素油样品溶液,每个批次各3份。以甲醇为空白,分别测定制霉素标准溶液和样品溶液在304 nm波长处的吸光度,用对照法计算含量,结果见表6。结果表明,制霉菌素油含量在90%~110%,符合要求。
3 讨论
3.1 含量测定方法的选择 制霉素中主要包括制霉菌素A1、A3和多真菌素B[2]。根据国家药品标准WS1-C2-0025-89,制霉素含量测定采用抗生素微生物检定法,但该方法耗时、烦琐、整个实验过程中影响因素多,且采用的啤酒酵母菌的抑菌圈边缘清晰度不高,影响测定;刘兴兰等[3]等采用比浊法,该方法较管碟法简便,但影响因素较多;林艳等[4]采用高效液相色谱法测定制霉素的含量,用3个主峰的面积进行定量,因制霉素包含多种组分,此方法不够准确;文献多采用紫外分光光度法[5~10]测定制霉素的含量,该方法简便、快速和定量准确。本实验也采用紫外分光光度法,经验证,该法线性关系良好,精密度、重复性、稳定性均符合要求,可用于制霉菌素油的质量控制。

表6 样品含量测定结果(n=3)
3.2 溶剂选择 制霉素在甲醇中微溶,在水中极微溶解,在氯仿、乙醚中不溶,所以本实验采用甲醇作溶剂。
3.3 操作注意事项 制霉素具有引湿性,对光、空气、酸或碱均不稳定,制霉菌素油样品在长期放置后,颜色变深,所以本实验在操作过程中应注意避光,并缩短操作时间。制霉菌素油黏稠度较大,在吸取样品时,吸管内壁易残存样品溶液,使取样量误差较大,须用甲醇洗涤,以降低误差。
[1]陈钟英,刘天培,杨玉.临床药物手册[M].3版.上海:上海科学技术出版社,1995:62.
[2]凌大奎,陈苏,王绍文,等.国产制霉菌素中两个主成分的结构鉴别[J].药学学报,1986,21(6):54.
[3]刘兴兰,汤玖安,文小玲.比浊法测定制霉素含量的研究[J].药物分析杂志,2005,25(3):358-359.
[4]林艳,盛炳义,王珏.HPLC法考察制霉素甘油的稳定性[J].中国现代应用药学杂志,2001,18(6):485-487.
[5]郑桂英.紫外分光光度法快速测定复方制霉素栓的含量[J].中国药品标准,2000,1(2):29-30.
[6]陈富超,方宝霞,李开俊,等.紫外分光光度法测定制霉素栓中制霉素含量[J].中国药业,2007,16(16):27.
[7]周修森.制霉素软膏中制霉素含量测定方法的研究[J].中国医药导报,2011,8(11):52-53.
[8]蒋正立,何仁,张芳.制霉素软膏的质量控制及稳定性研究[J].海峡药学,2009,21(12):83-85.
[9]方顺干,赵荣伟,宗永辉,等.制霉素凝胶的制备与质量控制[J].医药导报,2008,27(1):81-82.
[10]蒋正立,朱萍,何仁.制霉素搽剂质量控制与稳定性研究[J].海峡药学,2010,22(7):18-20.
