大环糊精包埋制霉菌素的研究
2013-02-21王金鹏焦爱权赵建伟田耀旗金征宇
王金鹏,焦爱权,周 星,赵建伟,田耀旗,金征宇
(江南大学食品科学与技术国家重点实验室,江南大学食品学院,江苏无锡214122)
大环糊精(LR-CD)是由α-1,4糖苷键链接构成的、聚合度大于9的环状葡聚糖总称,具有不同于常见环糊精的结构特征,例如CD10呈现马鞍形,CD26呈现双螺旋型[1],这些特殊的结构使得大环糊精具有极高的水溶性(>1.5mg/m L)。目前已经有少量研究报道证实了大环糊精能够显著增加客体分子的溶解度,例如Furuishi[2]报道了采用CD9包埋富勒烯(C60)能够极好地增加其水溶性,Dodziuk[3]报道了CD12能够与十二烯形成稳定的复合物,Tomoono等研究了DPs 20-50 LR-CD对强的松龙、胆固醇、地高辛、洋地黄毒苷、硝化甘油等物质的包埋增溶效果[4],Machida等将DPs 20-45 LR-CD用做辅助人工蛋白折叠[5],Mun等将DPs 22-44的LR-CD用做表面活性剂的包埋[6]。这些报道为大环糊精的应用提供了参考。
然而,与常见环糊精的诸多应用报道相比,大环糊精的应用报道还非常少。为进一步扩展大环糊精的应用范围,充分发挥大环糊精的高水溶特性,本文以制霉菌素为客体,研究大环糊精对制霉菌素的增溶效果。制霉菌素是广谱的抗真菌剂,然而制霉菌素的不饱和双键结构在空气中很容易被氧化降解,并且,制霉菌素的水溶性特别差,这大大降低了其药物效果[7]。本文作者研究发现常见环糊精能够在不改变制霉菌素本身结构的情况下促进制霉菌素水溶性提高[8],除此之外,未见其他不改变制霉菌素结构以增加其水溶性的相关报道。而LR-CD具有显著优于常见环糊精的水溶特性,将会造成制霉菌素显著的增溶效果,这对于改善制霉菌素的局部抗菌作用、治疗真菌感染类疾病将具有重要意义。
1 材料与方法
1.1 材料与仪器
LR-CD混合物日本格力高有限公司,平均分子量为7720u;制霉菌素 分析纯,购自国药集团;α-、β-、γ-环糊精 为分析纯,购自Sigma公司;乙醇等其他试剂 均为分析纯,购自国药集团。
AB104-N电子天平 美国梅特勒托利多公司;KQ5200超声波清洗器 昆山市超声仪器有限公司;HZS-H超级水浴恒温振荡器 哈尔滨东联电子技术公司;RJ-TDL-50A低速台式大容量离心机 RUIJIANG;TU-1900双光束紫外可见分光光度计 北京普析通用仪器有限责任公司。
1.2 制霉菌素的定量分析
采用紫外分光光度法对制霉菌素进行定量测定[8]。首先制作制霉菌素标准曲线,具体步骤如下:分别取0.5、1.0、1.5、2.0、2.5m L 50%乙醇溶解的制霉菌素(2mg/m L)到10m L试管中,再分别添加50%乙醇4.5、4.0、3.5、3.0、2.5m L使溶液总体积为5m L,漩涡混合器上混合均匀后测定305nm处的吸光值,以制霉菌素的浓度为横坐标,吸光值为纵坐标绘制标准曲线。
1.3 包埋时间的确定
称取LR-CD 0.1g,加水定容至100m L容量瓶,配制成1mg/m L的溶液,转移至棕色试剂瓶中超声5m in,充氮,40℃、150r/min振荡水浴荡摇,每隔2、4、6、8、10、12、24、48、72h用10m L针筒抽取4m L上清液过0.45μm针头式滤器过滤注入10m L容量瓶,加50%乙醇定容稀释至刻度,用紫外分光光度计于304nm波长处测其吸光值。
1.4 相溶解度图的测定
为进一步解析大环糊精对于制霉菌素的包埋特点,以常见三种环糊精的相溶解度图作为对照进行对比研究。准确称取1gα-CD、β-CD、γ-CD,加去离子水使之溶解,装入100m L容量瓶,定容使其浓度为10mg/m L,然后分别稀释成浓度为0、100、300、500、700、900μg/m L,3、5mg/m L各10m L装入棕色瓶中,准确称取制霉菌素0.01g,置于各个瓶中,摇匀,充氮排尽瓶中空气,然后放入电热恒温振荡水槽,于40℃、150r/m in振荡48h。振荡结束后取出样品,经0.45μm滤膜过滤,取300μL过滤液加2700μL 50%的乙醇溶液,测定305nm下的吸光度值,代入制霉菌素标准曲线回归方程,求出溶解在水中的制霉菌素的量,以三种环糊精的浓度为横坐标,制霉菌素的浓度为纵坐标绘制曲线,即为相溶解度图。
测定LR-CD时,准确称取0.1g LR-CD,加去离子水使之溶解并装入100m L容量瓶定容使其浓度为为1mg/m L,然后分别稀释成浓度为0、100、300、500、700、900μg/m L,各取10m L装入棕色瓶中,准确称取制霉菌素0.01g置于各个瓶中,摇匀,充氮排尽瓶中空气,然后放入电热恒温振荡水槽,于40℃、150r/m in振荡48h,振荡结束后取出并采用0.45μm滤膜过滤处理,分别取300μL滤液,加2700μL 50%的乙醇溶液,测定305nm下的吸光度值,并依据制霉菌素标准曲线回归方程计算制霉菌素的量,以大环糊精的浓度为横坐标,制霉菌素的浓度为纵坐标绘制曲线,即为相溶解度图。对曲线进行回归,则回归方程的最高次幂即为大环糊精对制霉菌素的包埋比。
1.5 包合常数的测定
环糊精(CD)在水溶液中包合物的形成是一个平衡过程,符合质量作用定律。当形成1∶1包合物时,可以用下列通式表征这一过程:

则反应平衡常数可以按照式(1)计算:

式中,K11为包合常数;[SL]为平衡时生成包合物的浓度,一般以物质的量浓度表示;[S]、[L]则分别表示平衡时游离的底物与客体的浓度。
报道指出[9],利用相溶解度图的起始线性阶段,可以计算包合物组成1∶1的稳定常数见式(2):

1.6 环糊精-制霉菌素包合物的制备
依据袁超等的报道[10],称取200mg的α-CD、β-CD、γ-CD以及LR-CD,溶于10m L的50%乙醇溶液中,加入2mg的制霉菌素,将该混合物置于棕色试剂瓶中,超声处理5m in,吹氮以赶走试剂瓶中的空气,马上盖上试剂瓶盖,于35℃的振荡水浴中100r/m in振荡48h,真空干燥,将所得粉末用无水乙醇洗涤3次,干燥所得产品即为大环糊精-制霉菌素包合物。
1.7 复合物的红外光谱鉴定
分别取适量的制霉菌素及制霉菌素的α-CD、β-CD、γ-CD、LR-CD包合物,分别与六倍质量的KBr混匀,制作压片,进行500~4000cm-1的红外光谱扫描。
1.8 数据处理
采用Orign软件对数据进行作图,所有数据均为三次重复所求平均值,采用单因素方差分析统计学计算差异的显著性,显著水平为0.05。
2 结果与讨论
2.1 制霉菌素紫外扫描图谱
制霉菌素是一类大环内酯,在其结构中,在环的一边是疏水性的共轭双键结构,另一侧是羟基、羧基、胺等亲水性基团,制霉菌素的紫外吸收光谱如图1所示。
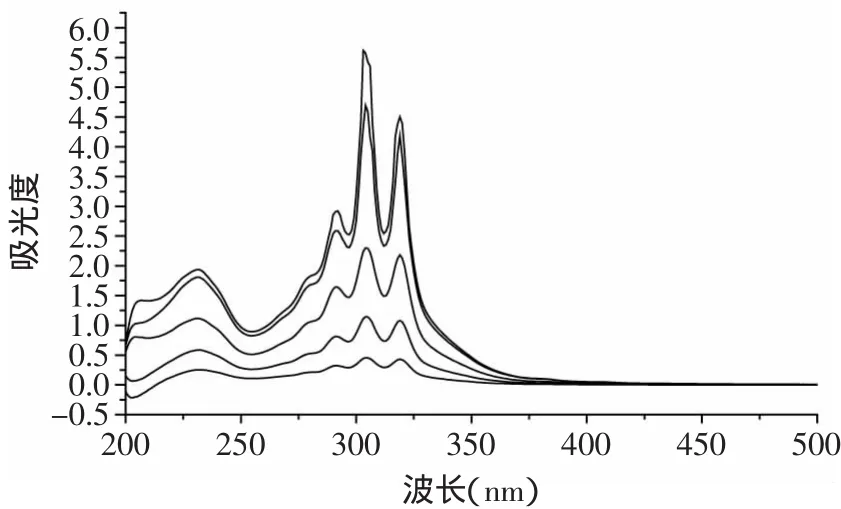
图1 不同浓度制霉菌素的紫外吸收光谱图Fig.1 The absorption curve of nystatin with various contents
由图1可以看出,制霉菌素在295、305、320nm处具有三个特征吸收峰,且在232nm处具有较宽的弱吸收。根据电子能级跃迁理论[11],推测232nm处的弱吸收为π-π*跃迁造成的共轭二烯K带吸收,295nm为n-σ*跃迁造成的羰基R带吸收,305nm为π-π*跃迁造成的共轭四烯K带吸收,320nm为四烯环的特征吸收。
2.2 包埋时间的确定
为确定合适的包埋条件,研究了制霉菌素的含量随包埋时间变化,结果如图2所示。
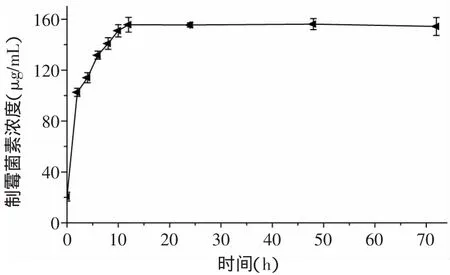
图2 制霉菌素的包埋时间曲线图Fig.2 Inclusion time for nystatin
从图2可以看出,在包埋的最初阶段,随着包埋时间的延长,包合物中制霉菌素的含量呈线性增加,但当包埋时间超过20h时,制霉菌素的含量基本维持在恒定水平,当包埋时间达到72h时,制霉菌素的含量有所下降。为了更好的保持实验的重复性,选择48h作为包埋时间。
2.3 相溶解图
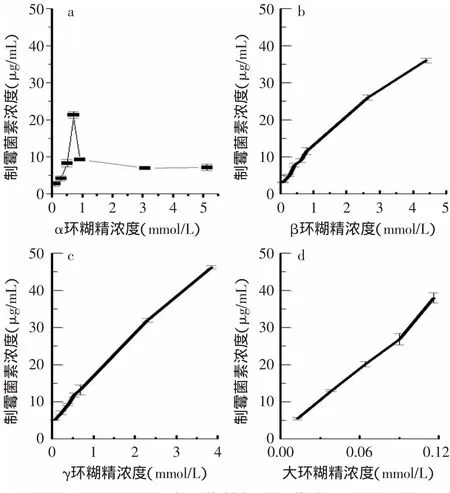
图3 各环糊精相溶解曲线Fig.3 Phase solubility curves for various CD
根据LR-CD包结物的相溶解等温线,将CD包合物分为五种类型:AP、AL、AN、BS、BI[9]。AP类型指包合物中客体的含量随CD浓度的增加呈指数增加趋势;AL类型指包合物中客体的含量随CD浓度的增加呈线性增加趋势,表明形成1∶1的包合物;AN类型指包合物中客体的含量随CD浓度的增加呈对数增加趋势;对于BS类型,客体的溶解度先随CD浓度的增大而增大,随后在某一CD浓度范围内维持在某一固定的值,当所有客体全部转化成包结物时,进一步加LR-CD的量,反而使客体物质结晶,减小其溶解度;BI类型表明形成的包结物不溶,客体分子的溶解度不变,直到全部形成包结物后,溶解度开始下降。
依照实验方法,计算出制霉菌素在CD水溶液中的溶解度。以CD的浓度为横坐标,药物溶解度为纵坐标,绘制相溶解度曲线,如图3所示。
从图3可以看出,CD对制霉菌素有明显增溶效果,且溶解度随CD浓度增大而线性增加,根据Higuchi的报道[12],β-CD、γ-CD以及LR-CD的相溶解曲线归属AL型,说明这三种CD和制霉菌素形成的都是1∶1的包合物,而α-CD的相溶解曲线属于BS型,可以推断,α-CD分子较小的空腔结构不适于制霉菌素客体分子进入,而β-CD、γ-CD及LR-CD均可以和制霉菌素形成稳定的包合物。
2.4 包合常数的计算
对图3中的曲线求斜率,计算包合常数,结果如表1所示。
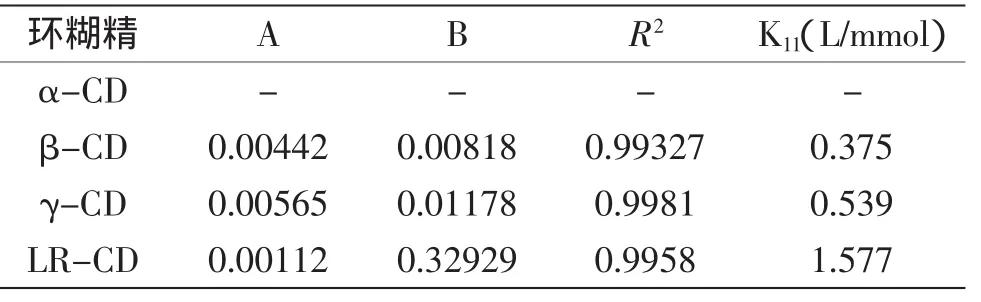
表1 各环糊精包合常数Table1 Inclusion constants for various cyclodextrins
由表1可以看出,LR-CD的包合常数远远大于α-CD及β-CD,表明LR-CD对于包埋分子量较大的大环内酯类物质具有更高的优势。
2.5 增溶常数和增溶倍数的预测
根据参考资料提供的CD在水中的最大溶解度[13],根据图3的相溶解度图,对其进行线性回归,按照1∶1的包埋比对制霉菌素的最大溶解度进行预测,则饱和LR-CD溶液对制霉菌素的增溶倍数达到2958.87倍,这为制霉菌素由外敷使用为主拓展为注射用针剂提供了可能,对于扩大制霉菌素等大环内酯类抗生素的应用范围提供了有价值的参考。
2.6 包合物的鉴定
为进一步研究大环糊精对制霉菌素的包埋特点,本文以常见环糊精-制霉菌素包合物作为对照,进行了四种包合物的红外光谱鉴定,结果如图4所示。
制霉菌素(a)的红外光谱图中,3415cm-1为-OH伸缩振动,3024cm-1为N-H的伸缩振动,2851cm-1为亚甲基的C-H伸缩振动,1723cm-1为C=O伸缩振动,1630cm-1为共轭双键的伸缩振动,1449、1381cm-1为甲基中C-H弯曲振动,963cm-1为共轭键中C-H的弯曲振动。对比a、c、d、e的红外吸收图谱发现,3024cm-1处的吸收峰隐没,1723cm-1处的吸收峰强度变小,1449、1381cm-1处吸收峰隐没,2851、1630cm-1处的吸收峰向高波数方向发生位移;此外,对比b的红外光谱与c、d、e的红外光谱图,发现1723cm-1处的吸收峰隐没,说明制霉菌素的酯键进入到α-CD空腔,而共轭四烯部分未进入CD空腔;此外,制霉菌素的羧基及氨基可能与CD表面的羟基以氢键的方式发生作用,对于维持稳定的复合物构象起到重要作用。
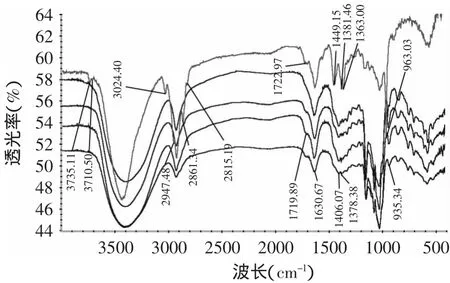
图4 包合物的红外图谱Fig.4 FTIR of complexes
3 结论
LR-CD对制霉菌素的相溶解曲线归属AL型,表明大环糊精与制霉菌素的包埋比为1∶1;计算得到LR-CD包埋制霉菌素的包合常数为1.577L/mmol,远远大于β-环糊精和γ-环糊精对制霉菌素的包埋常数(0.375L/mmol和0.539L/mmol);预测得到饱和LR-CD溶液对制霉菌素的增溶倍数为2958.87倍;IR分析表明制霉菌素的酯键部分进入到CD的空腔,而共轭四烯部分及羧基、氨基部分在CD腔体表面。本研究对于提高制霉菌素的溶解度、扩大制霉菌素的应用范围以及扩大大环糊精的应用范围提供了有益参考。
[1]Ellouze F,Amar NB,Deratani A.Large ring cyclodextrins:Synthesis,purification and applications[J].Comptes Rendus Chimie,2011(14):967-971.
[2]Furuishi T,Endo T,Nagase H et al.Solubilization of C70 into water by complexation with δ-cyclodextrin[J].Chemical Pharmaceutical Bulletin,1998,46:1658-1659.
[3]Dodziuk H,EjchartA,AnczewskiW,etal.Watersolubilization,determination of the number of different types of single-wall carbon nanotubes and their partial separation with respect to diameters by complexation withη-cyclodextrin[J].Chemical Communications,2003:986-987.
[4]Tomono K,Mugishima A,Suzuki T,et al.Interaction between cycloamylose and various drugs[J].Journal of Inclusion Phenomena,2002(4):267-270.
[5]Machida S,Ogawa S,Xiaohua S,et al.Cycloamylose as an efficient artificial chaperone for protein refolding[J].FEBS Letters,2000,486:131-135.
[6]Mun S,Rho SJ.Study of inclusion complexes of cycloamylose with surfactantsby isothermal titration calorimetry[J].Carbohydrate Polymers,2009,77:223-230.
[7]Akaike N,Harata N.Nystatin perforated patch recording and its applications to analyses of intracellular methanisms[J].Japanese Journal of Physiology,1994,44:433-473.
[8]Wang J,Jin Z,Xu X.Gamma-cyclodextrin on enhancement of water solubility and store stability of nystatin[J].Journal of Inclusion Phenomena and Macrocyclic Chemistry.DOI:10.1007/ s10847-012-0281-y.
[9]Martin DVEM.Cyclodextrins and their uses:A review[J].Process Biochemistry,2004,39:1033-1046.
[10]Yuan C,Jin Z,Xu X,et al.Preparation and stability of the inclusion complex of astaxanthin with hydroxypropyl-βcyclodextrin[J].Food Chemistry,2008,109:264-268.
[11]高向阳.新编仪器分析[M].北京:北京科学出版社,2004:14.
[12]Higuchi T,Connors K.Phase-solubility techniques[J].Advances in Analytical Chemistry and Instrumentation,1965(4):117-212.
[13]Endo T,Zheng MY,Zimmermann W.Enzymatic synthesis and analysis of large-ring cyclodextrins[J].Australian Journal of Chemistry,2002,55:39-48.
