2种不同试剂检测血清免疫球蛋白结果的可比性及偏倚评估
2012-01-26李海炜张绍峰赖战峰
李海炜,李 山,秦 雪△,张绍峰,赖战峰
(1.广西医科大学研究生学院 530021;2.广西医科大学第一附属医院检验科 530021)
2种不同试剂检测血清免疫球蛋白结果的可比性及偏倚评估
李海炜1,李 山2,秦 雪2△,张绍峰2,赖战峰2
(1.广西医科大学研究生学院 530021;2.广西医科大学第一附属医院检验科 530021)
目的进行2种不同免疫球蛋白诊断试剂对血清免疫球蛋白测定结果的可比性及偏倚评估研究,为血清免疫球蛋白测定的标准化和临床实验室认可提供实验数据。方法 参考美国临床和实验室标准协会(CLSI)的EP9A2文件,分别用执诚试剂和优利特试剂在HITACHI7600-010全自动生化分析仪上测定免疫球蛋白IgG、IgA和IgM,以执诚试剂为对照组,优利特试剂为实验组。用线性回归统计法分析对照组(Y)和实验组(X)测定结果决定水平处的方法间误差,以美国临床实验室修正法规(CLIA′88)规定的室间质量评价允许误差范围的1/2为标准,判断不同试剂的临床可接受性。结果两种试剂对患者血清免疫球蛋白测定结果显示,方法内重复性良好,无离群点,除IgA在决定水平处的系统误差不能被接受外,其余项目测定结果的偏差临床可以接受。结论当同一实验室同一检验项目存在2个或以上的试剂时,应进行方法比对和偏差评估,判断其临床可接受性,以保证检验结果的可比性。
免疫球蛋白类;血清;试剂盒,诊断
血清免疫球蛋白(immunoglobulin,Ig)水平测定由于对疾病诊疗和疗效观察具有重要的临床意义而愈来愈受到重视,成为临床实验室的常规项目[1-4],其测定结果的准确性也受到广泛重视。中国生物医学经过多年的发展,已有多家试剂厂家生产免疫球蛋白测定的试剂。不同厂家的试剂在测定免疫球蛋白时是否存在差异以及测定结果的可比性是广受关注的问题。本文按照美国临床和实验室标准协会(CLSI)指南文件EP9-A[5]的要求对两种不同试剂检测免疫球蛋白结果进行比对及偏倚的评估,现报道如下。
1 资料与方法
1.1 一般资料 收集广西医科大学门诊及住院患者当日进行免疫球蛋白检测的血清,要求新鲜、无溶血、无黄疸。
1.2 仪器与试剂 采用日本日立公司生产的HITACHI7600-010全自动生化分析仪。执诚免疫球蛋白诊断试剂来自上海执诚生物技术有限公司,均采用免疫比浊法进行测定,试剂批号分别为:IgG,JANK021;IgA,MAYK035;IgM,JANK012。优利特免疫球蛋白诊断试剂来自桂林优利特集团有限公司,均采用免疫比浊法测定,IgG、IgA、IgM 试剂批号分别为:20110224、20110224、20110224。
1.3 方法 各选取8个患者血清分别在各浓度范围内不同浓度值的标本,首先用2种试剂标准液各自进行校准,再使用RANDOX特殊蛋白质控品(试剂1、2、3批号分别为196LPC、212LPC、198LPC)进行检测,在控后将每例样本随机与常规标本在同样条件下测定,具体操作如下:每个样本分装成两份,分别在日立7600自动生化分析仪上使用两种不同的检测试剂对IgG、IgA、IgM各测定2次。上海执诚试剂长期运用于本科室7600生化分析仪,室内质控日间CV均小于1/3CLIA′88室间质评允许误差,故以执诚试剂作为比较方法(X),优利特试剂为实验方法(Y),进行方法间的比对试验。实验前对仪器进行常规维护与保养,按常规方法进行校准和质控,室内质控在控时进行样本测定。每个项目的检测严格按厂商试剂盒的说明书进行。2h内测定完毕,每份样本测定2次。其中第2次测定次序与第1次相反,中间间隔不少于2h,双份测定取均值为比对数据,连续测定5d。

表1 2种试剂检测结果各统计量的计算
1.4 统计学处理 2种诊断试剂对免疫球蛋白测定结果的统计分析按照CLSI EP9-A2指南要求进行分析,不采用已明确有人为误差的结果。主要内容包括(1)两种试剂均值结果;(2)方法内重复性检查;(3)离群点检查;(4)计算线性回归;(5)标准误差的计算;(6)计算系统误差的估计值及评价不同试剂间的偏倚。数据录入和统计分析均采用Excel 2003和SPSS13.0进行。
2 结 果
2.1 2种试剂均值结果 采用上海执诚免疫球蛋白诊断试剂对IgG、IgA、IgM 3个免疫球蛋白进行测定,结果的均值分别为12.649、2.512、1.592g/L。采用桂林优利特免疫球蛋白试剂对上述3个免疫球蛋白进行测定,结果的均值分别为13.154、2.801、1.481g/L,见表1。2.2 方法内重复性检查 计算方法X和Y各2次测定值之差;Y2次测定值之差与X2次测定值之差的平均值;Y2次测定值之差的平均值;X2次测定值的标准化值;Y2次测定值的标准化值。算出X2次测定值的标准化值的均值,=,同时算出Y2次测定值的标准化值的均值,=,所得值详见表1。以4和4作为控制限,方法X和Y测定值的标准化值均在控制限内,说明两方法均重复性好,符合相关性实验要求。
2.3 离群值检查 计算X和Y之间的绝对偏差、相对偏差,
2.4 线性回归及散点图分析 通过将数据导入SPSS13.0进行线性回归与散点图分析,结果见图1~3。由散点图可知两试剂免疫球蛋白测定值线性关系良好。通过线性回归得到直线回归方程和相关系数,IgG:Y=0.21+1.024X,r=0.992;IgA:Y=0.19+1.039X,r=0.986;IgM:Y= -0.018+0.941X,r=0.981。

图2 2种试剂IgA测定结果散点图

图3 2种试剂IgM测定结果散点图
2.5 标准误差的计算和可接受性能的评价。两种试剂间测定结果的相关系数大于0.975,回归统计的斜率和截距均可靠,可用回归统计的方法计算系统误差及进行临床可接受性偏倚分析。根据IgG、IgA和IgM的直线回归方程,计算两种试剂在决定水平Xc处测定结果的相对偏差[6],评估试剂的临床可按受性能。结果见表2。
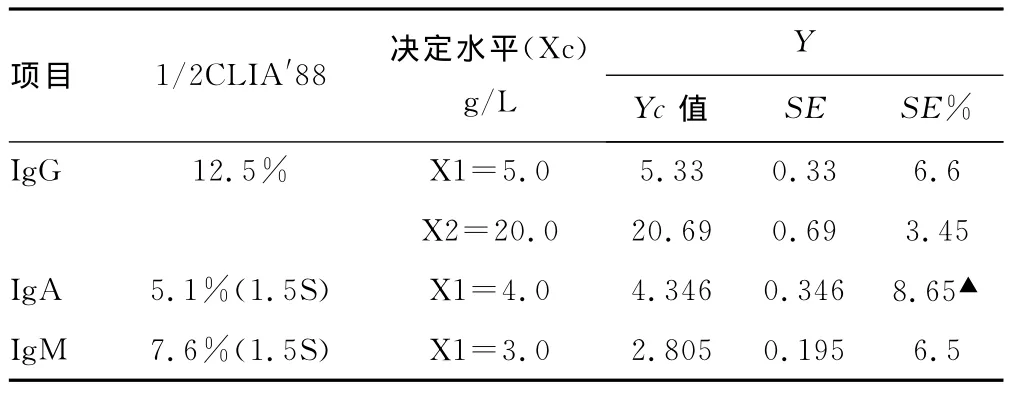
表2 2种试剂免疫球蛋白测定结果的临床可接受性偏倚分析
3 讨 论
检验医学的飞速发展加速了生物试剂产业的发展。不同诊断试剂对同一项目检测结果的可比性检验和偏倚评估是申请临床医学实验室认可必不可少的内容,检测结果的可比性为不同种试剂间检测结果的互认提供了保障[7,8]。检验技术的不断分支,检测项目的不断增多,检验质量的控制变得越来越重要,IS015189文件指出:"当同样的检验应用不同程序或设备,或在不同地点进行,或以上各项均不同时,应有确切机制以验证在整个临床适用区间内检验结果的可比性。"[9]由于中国检验试剂的生产和临床实验室参考系统并不十分完善,多数实验室按照自己的意愿和实际情况,选择需要的仪器、试剂、质控和操作程序等随意组合而成的检测系统。怎样寻找这些检测结果溯源性和可比性,是一个极大的现实问题[10-12]。方法学比对实验通过自建实验方法(试剂)与具有溯源性的比较方法(试剂)进行方法学比对,找出两种检测结果间的总偏差是否可以被接受,间接保证了自建方法(试剂)检测结果的准确
性[13-15]。
本研究通过用CLSI的标准化文件 EP9A2[1]对IgG、IgA和IgM 2种试剂进行方法比对和偏倚评估。由于CLIA′88中对IgG的可接受偏倚为25%,而对IgA和IgM的可接受偏倚标准为3S,并未给出确切数值,故分别采用两种试剂对RANDOX特殊蛋白质控品进行检测累计40d所得的标准差SD均值作为判断标准S,其中IgA的SD为0.034,IgM的SD为0.051,1/2CLIA′88即为0.051和0.076,换算成百分比,为5.1%和7.6%。笔者发现除IgA外,其余项目测定结果的偏差均在可接受的范围,即2种试剂的检测结果基本一致。IgG在两个不同的决定水平时两试剂的相关性均较好。
免疫比浊测定法(immunoturbidimetry)因同时具备生化检测的快速性和免疫反应的特异性,可进行血清Ig的快速、准确定量,临床实验中应用较广泛[16-17]。虽然本文研究的2种试剂均使用免疫比浊法对免疫球蛋白进行测定,但由于制作工艺、适用仪器等方面的细微差别,检测结果不可能完全一致。同时随着生物制剂产业的高速发展,实验室可选用的生化诊断试剂也越来越多。本研究根据CLSI EP9-A相关文件,并结合临床实际工作情况选择新鲜病人血清样品,使用执诚免疫球蛋白诊断试剂和优利特免疫球蛋白诊断试剂,对3个免疫球蛋白的检测结果进行比对及偏倚评估研究的结果,为不同免疫球蛋白诊断试剂的临床应用及可靠性提供了科学依据。
[1] 张卉,冯瑞.免疫球蛋白G4相关性肺疾病研究进展[J].中华结核和呼吸杂志,2011,7(34):528-531.
[2] 付金龙,刘沛.SC结构、功能及其临床研究进展[J].世界华人消化杂志,2009,17(3):293-298.
[3] Ali AA,Diebel LN,Liberati DM.Estrogen modulation of pneumonia?An immunoglobulin A effect[J].Trauma A-cute Care Surg,2012,72(4):908-915.
[4] Wang B,Tang X,Xu J,Yao H.Differential expression of Immunoglobulin A in the adenoids of children with and without exudative otitis media.[J]Int J Pediatr Otorhinolaryngol,2012,76(5):728-730.
[5] The National Conmmittee for Clinical Laboratory Standards.Method Comparison and Bias Estimation Using Patient Sampale;Approved guideline-second edition[S].NCCLS,EP9-A2,2002.
[6] 叶应妩,王毓三,申子瑜.全国临床检验操作规程[S].3版.南京:东南大学出版社,2006:82-83.
[7] 张海莹,季颖,朱凌,等.两种HBV DNA检测试剂的比较[J].中华检验医学杂志,2011,34(5):459-464.
[8] 阳苹,张莉萍,肖勤,等.实验室内不同检测系统比对周期及比对方案探讨[J].重庆医学,2011,40(3).
[9] 张莉,吴炯,郭玮,等.医学检验检测系统应用前的性能评价[J].检验医学杂志,2006,11,(21):561-562.
[10]魏昊,丛玉隆.医学实验室质量管理与认可指南[M].北京:中国计量出版社,2004:72-75.
[11]刘怀平,孙金芳,陈欣.不同检测系统21项常规生化结果的比对与临床可接受性评价[J].中国实验诊断学,2009,13(10):1406-1409.
[12]陈锐,王治海,金静.不同进口试剂在罗氏检测系统上检测结果的可比性分析及偏倚评估[J].中国实验诊断学,2010,14(8):1320-1321.
[13]苏荣,张劲丰,黄瑞勋,等.不同检测系统对多项生化指标结果的可比性试验[J].现代预防医学,2008,4(35):771-772.
[14]姚庆,袁红.两种仪器不同检测原理测定免疫球蛋白G的比对分析[J].检验医学与临床,2009,6(19):1623-1629.
[15]林高贵,陈筱菲,陈以勒,等.实现自建检测系统与标准检测系统检验结果的可比性[J].检验医学,2011,26(3):180-184.
[16]罗浔阳,孙兵,胡金曹,等.全自动免疫透射比浊法测定血清免疫球蛋白应考虑的问题及解决方法[J].现代检验医学杂志,2008,23(4):127-128.
[17]Dupuy AM,Debarge L,Poulain M,et al.Determination of serum ferritin using immunoturbidimetry or chemiluminescent detection in comparison with radioimmunoassay a compendium of a methodological juxtaposition[J].Clin Lab,2009,55(5/6):207-215.
Comparability and bias evaluation of serum immunoglobulin levels determined by two different regents
ObjectiveTo evaluate the comparability and the bias of serum immunoglobulinResultsdetermined by two different diagnostic regents,whether the outcome of the immunoglobulin comparable to the standardization of serum immunoglobulins and clinical laboratory authorized to provide the experimental data.MethodsAccording to the NCCLS EP9-A2document,the immunoglobulin concentrations determination were carried out by HITACHI7600-010automatic biochemical analyzer with zhicheng regent and youlite regent respectively,the control group was zhicheng reagent,the experimental group was youlite reagent.By linear regression analysis method(Y)and comparison(X)determined the relative mean Office deviation or medicine department decided to approach the level of inter-error in order to amend legislation in the U.S.clinical laboratory(CLIA′88)provides quality assessment of the permissible error range of 1/2as the standard,a different detection regent to determine the clinical acceptability.Results
Two types of immunoglobulin diagnostic regents showed that,there were not existence outlier.Detection regents in addition to the IgAResultsand comparison between the error or the mean relative deviation of the department can not be accepted,the remaining items of the deviation of clinical measurements is acceptable.ConclusionWhen the same laboratory the same tests over the existence of two detection regents,should be carried out and bias than on assessment,to determine its clinical acceptability,in order to ensure comparability of testResults.
immunoglobulins;serum;reagent kits,diagnostic
10.3969/j.issn.1671-8348.2012.18.014
A
1671-8348(2012)18-1827-03
△通讯作者,Tel:13977163919;E-mail:qinxue919@163.com。
2011-12-09
2012-02-22)
•论 著•
