溶剂热法制备Cd(OH)2和CdO纳米盘研究性实验
2012-01-26刘伟霞孙言飞
李 锦,张 川,刘伟霞,孙言飞
(新疆大学 物理科学与技术学院,新疆 乌鲁木齐830046)
1 引 言
纳米材料按维数可划分为3大类:零维、一维和二维.二维纳米材料包括纳米片、纳米薄膜、二维超晶格等,是研究量子限域效应的理想体系,是构建纳米器件的理想平台.纳米片由于具有高的各向异性,被认为是新一类的纳米材料.由于其独特的物理形态和物化性质,以及潜在的巨大应用前景,成为当前学术界研究的热门领域[1-4].在众多制备纳米材料的方法中,溶剂热法以其高效、低成本而一直倍受关注,已经被证明是非常有效的方法[5-8].可以应用于金属、半导体、绝缘体等诸多材料的制备.溶剂热法是在水热法的基础上发展起来的,以有机溶剂代替了水热法中的水,大大拓宽了应用范围.近20年来溶剂热合成法得到了长足的发展,并在纳米材料制备中显示出越来越重要的作用.
Cd(OH)2作为一种阴极添加物能够有效地增强镍镉电池的放电容量并能减少电极本身的自放电,延长电池的使用寿命并保持较高的稳定性;同时,Cd(OH)2还是一种重要的前驱体,是制备其他含镉物质(如CdS,CdSe,Cd O等)的重要过渡产物[9-10].CdO 可通过 Cd(OH)2高温煅烧分解得到,属于直接禁带半导体,禁带宽度为2.26 eV,是一种极具应用潜力的光电材料[11].Cd O作为镍镉系列碱_性可充电电池的负极活性物质,其性能的优劣直接影响电池的质量,是制约镍镉电池综合性能指标的关键材料.近年来,Cd O广泛用于场发射栅板显示器,被认为是最有前途的导电氧化物.作为一种良好的催化剂,Cd O能催化多种有机物的热分解[12].
Cd(OH)2和CdO纳米材料的制备方法主要为水相法.如刘俊渤等报道了以NaNO3作为矿化剂,水热法制备了六方形Cd(OH)2纳米盘[13];Shi等人通过控制溶液p H值水热合成Cd(OH)2六方形纳米盘[14];Zhang等人以柠檬酸作为调节剂,水热法合成 Cd(OH)2纳米片、纳米晶须[15];张兰月等人采用阳极氧化铝(AAO)模板法制备了Cd(OH)2和Cd O纳米棒[10].可以看出,在已有的研究报道中,多是水热合成配以矿化剂、调节剂或模板法得到Cd(OH)2纳米结构.本文利用简单的溶剂热法合成了Cd(OH)2和Cd O正六方形纳米盘,实验工艺简单,所得产物形貌规则,分散性好,产量大.
2 实 验
2.1 实验原理
溶剂热法制备半导体化合物纳米结构,一般在简易水热反应釜中进行.釜体和釜盖用不锈钢制造,反应釜体积较小(<100 m L),也可以直接在釜体和釜盖设计丝扣,直接相连,以达到比较好的密封性能.内衬材料是聚四氟乙烯.采用外加热方式,以烘箱或马弗炉为加热源.由于内衬材料为聚四氟乙烯,使用温度应该低于聚四氟乙烯的软化温度(250℃).釜内压力由加热介质产生,可以通过装填度在一定范围内加以控制,室温开釜取样.
溶剂热法是将水热法中的水换成有机溶剂或非水溶媒(例如:有机胺、醇、氨、四氯化碳或苯等),采用类似于水热法的原理,以制备在水溶液中无法长成,易氧化、易水解或对水敏感的材料,例如III-V族半导体化合物、氮化物、硫族化合物、新型磷(砷)酸盐分子筛三维骨架结构等.这一改进大大拓宽了该溶液相法制备纳米材料的应用范围.本文采用溶剂热方法合成Cd(OH)2和CdO的纳米结构.图1给出了典型的溶剂热合成的工艺流程.
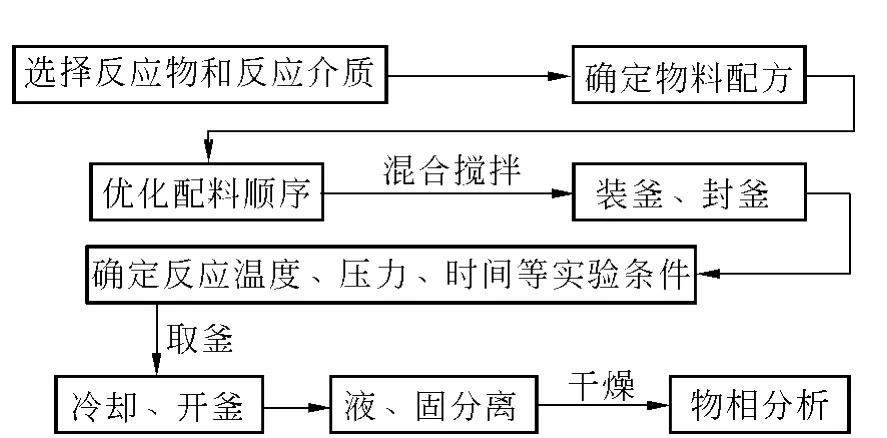
图1 溶剂热合成的一般工艺流程图
2.2 实验方法
实验所用仪器为国内实验室常用于无机合成的简易水热反应釜和普通干燥箱.实验所需原料包括:硝酸镉[Cd(NO3)2·4H2O,分析纯]、氯化镉(Cd Cl2·2.5 H2O,分析纯)、硫酸镉(3CdSO4·8H2O,分 析 纯 )、乙 酸 镉 [Cd(CH3COO)2·2 H2O,分析纯]、氢氧化钠(NaOH,分析纯)、乙二醇(HOCH2CH2OH,分析纯)、去离子水.
典型的实验过程描述如下:称量一定物质的量的乙酸镉(如1.25 mmol)和氢氧化钠(如25 mmol),分别溶于盛有一定体积(如10 m L)的去离子水的烧杯中,振荡使其充分溶解.将NaOH溶液缓慢地加入到 Cd(CH3COO)2·2H2O的水溶液中,然后加入乙二醇(如20 m L的体积),将混合液体磁搅拌30 min后转移到50 m L的聚四氟乙烯水热反应釜中.密封,静置于一定温度(如200℃)下的干燥箱中4 h.反应后取出,在自然冷却之后,将沉淀物用无水乙醇和去离子水离心洗涤4~5次,并置于60℃的真空干燥箱中干燥4 h,得到白色产物.将得到的白色样品一部分送去检测,另一部分样品放置于干燥箱中在220℃下退火24 h,得到另一种棕红色样品.表1给出了所有Cd(OH)2和Cd O样品的具体合成条件.
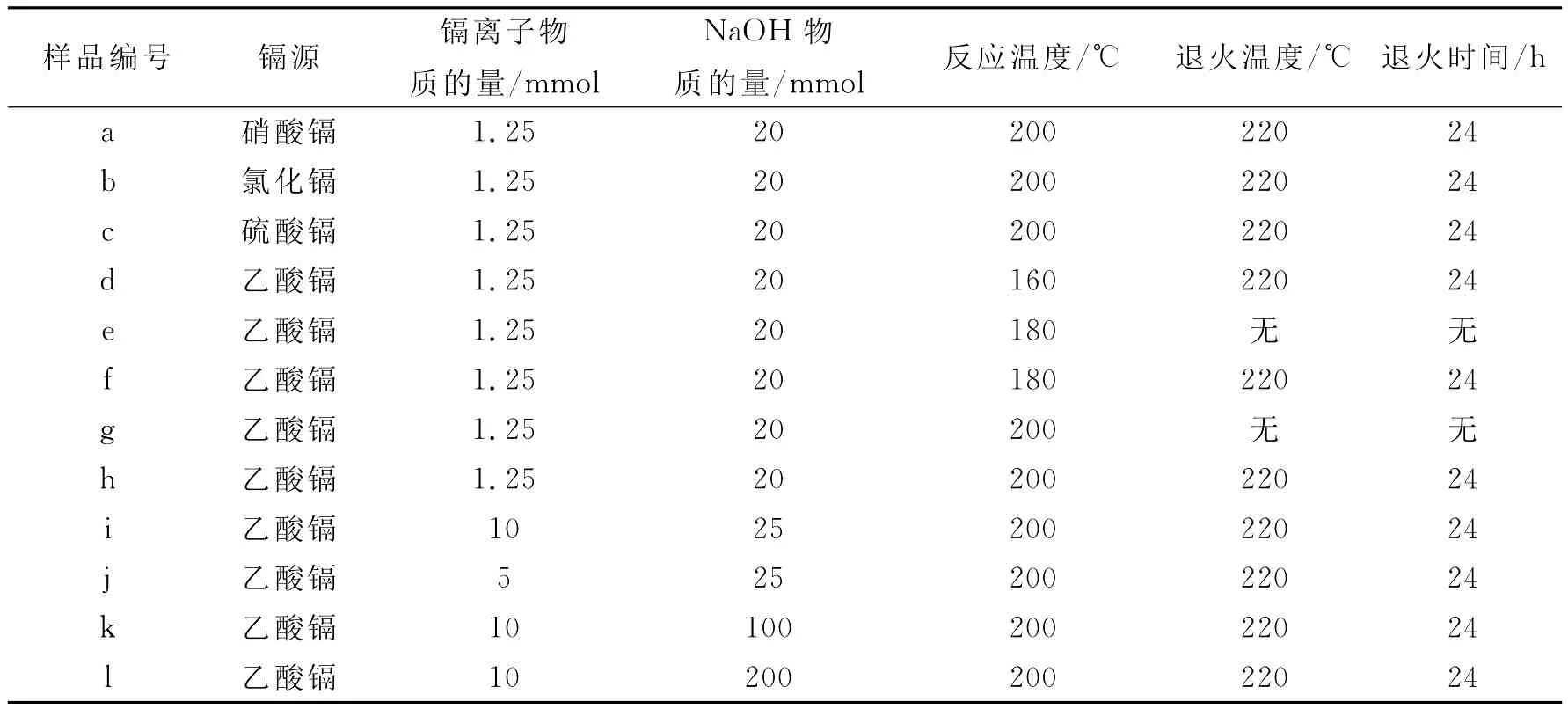
表1 Cd(OH)2和CdO样品的具体合成条件
3 实验结果与讨论
3.1 XRD分析
图2给出了中间产物和最终产物的XRD图.从图2(a)中可以看出所得中间产物所有的XRD衍射峰的峰位与六方相Cd(OH)2的标准谱(No.31-0228)峰位一一对应,表明产物为六方纤锌矿结构Cd(OH)2,沿(001)晶面择优取向.由图中无其他杂峰存在,衍射峰尖锐光滑可知中间产物为纯的结晶性良好的Cd(OH)2.
将上述Cd(OH)2样品置于220℃下的空气气氛中退火24 h,白色粉末变为棕红色的粉末.图2(b)显示的是最终产物的XRD图,其所有的衍射峰都与PDF卡片库(No.65-2908)中立方相Cd O标准谱的峰位一致,没有其他杂质峰,衍射峰尖锐,表明最终产物为纯的结晶性良好的立方闪锌矿Cd O.将图2(a)与图2(b)对比可以发现,六方相Cd(OH)2完全分解为立方相CdO,同时晶体的择优取向消失.
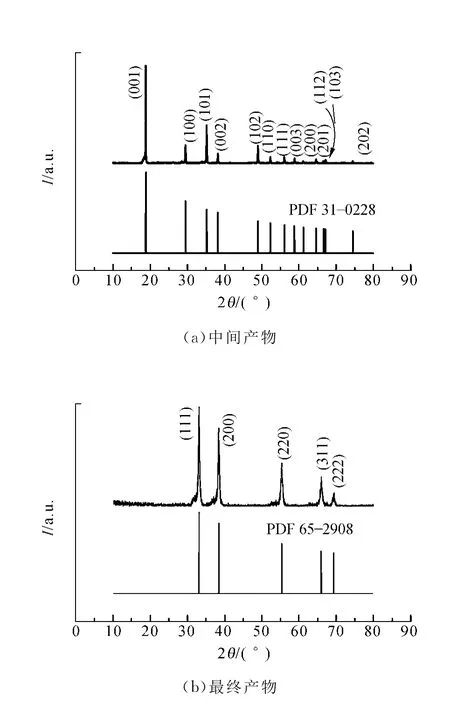
图2 中间产物和最终产物的XRD图
3.2 SEM 分析
与表1对应的各样品的SEM照片如图3所示.通过若干组对比实验,发现产物的形貌主要与以下几个因素有关:反应温度;镉源的种类及镉离子与氢氧根离子的比例,而这反映了Cd2+的浓度与溶液p H值的关系.而与反应时间、水与乙二醇的比例、退火温度与时间等因素关系不大.
对比图3(a)~(c)与(h)发现,不同镉源对产物形貌影响较大.在其他实验条件不变的情况下,只有以乙酸镉为镉源时所得产物为较理想的正六边形纳米盘.


图3 与表1对应的各样品的SEM照片
对比图3(d)~(h)发现,退火前后产物的形貌并未发生大的改变,均呈现出正六边形状,纳米盘的尺寸大小在100~600 nm之间,厚度在50~100 nm范围内.结合XRD分析可知,所得的中间产物Cd(OH)2和最终产物Cd O均为正六边形纳米盘.而反应温度对中间产物Cd(OH)2的形貌有较大影响.180℃时Cd(OH)2纳米盘的形貌不甚均匀规则,而200℃时其形貌则变得形状规整,大小均匀,表面光滑.反应温度对最终产物CdO的形貌亦有较大影响.在160~200℃的反应温度梯度内,Cd O的形貌从一团凝聚,到逐渐分开形成较厚的大颗粒,到最终生长为清晰的正六边形形貌的纳米盘,结果表明200℃时得到的产物最为理想.
对比图3(i)~(l)发现,Cd2+与 OH-的浓度比对CdO形貌有较大影响.随着Cd2+与OH-的浓度比由1∶2.5,1∶5,1∶10到1∶20,CdO产物的形貌由不规则到规则的正六边形转变,纳米盘的大小由差别较大到逐渐均匀,再到不均匀,浓度比1∶10较为合适,纳米盘边长在500 nm~2μm之间,厚度约为100 nm.
3.3 反应方程
当NaOH与Cd(CH3COO)2混合后,反应釜中发生的化学反应为:
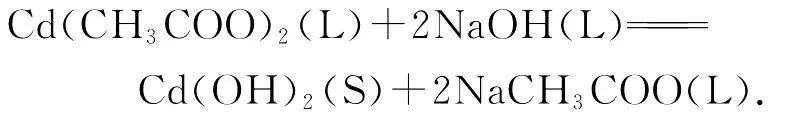
即初步反应得到的中间产物为Cd(OH)2.该中间产物经过退火煅烧得到最终产物CdO,发生另一反应:
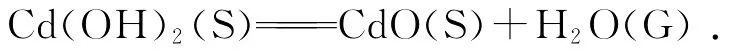
4 结束语
利用溶剂热法成功地合成了Cd(OH)2和Cd O纳米盘,实现了大学生创新实验和先进科研成果的结合[16-17].该实验所用设备、基本实验步骤和操作过程都非常简单,非常适合初涉研究领域的本科生通过这一简单的溶剂热体系,学习到科学研究的一般方法.通过该实验研究,能够加深学生对相关化学反应、物理原理的理解,提高学生的创新能力和科研素质.
[1] Takayoshi S,Mamoru W.Semiconductor nanosheet crystallites of quasi-TiO2and their optical properties.Semiconductor nanosheet crystallites of quasi-TiO2and their optical properties [J].J.Phys.Chem.B,1997,101(49):10159-10161.
[2] Takayoshi S,Yasuo E,Yoshizo K,et al.Two-dimensional diffraction of molecular nanosheet crystallites of titanium oxide [J].J.Phys.Chem.B,2001,105(26):6116-6121.
[3] Hu J Q,Bando Y,Zhan J H,et al.Two-dimensional micrometer-sized single-crystalline ZnO thin nanosheets[J].Appl.Phys.Lett.,2003,83(21):4414-4416.
[4] Atsushi T,Mariko S,Lu D,et al.Exfoliated nanosheets as a new strong solid acid catalyst[J].J.Am.Chem.Soc.,2003,125(18):5479-5485.
[5] Tang K B,Qian Y T,Zeng J H,et al.Solvothermal route to semiconductor nanowires [J].Adv.Mater.,2003,15(5):448-450.
[6] Li Ya-dong,Liao Hong-wei,Ding Yi,et al.Nonaqueous synthesis of CdS nanorod semiconductor[J].Chem.Mater.,1998,10(9):2301-2303.
[7] Deng Z X,Li L B,Li Y D,et al.Novel inorganicorganic-layered structures:crystallographic understanding of both phase and morphology formations of one-dimensional Cd E (E=S,Se,Te)nanorods in ethylenediamine [J].Inorg.Chem.,2003,42(7):2331-2341.
[8] Du G H,Chen Q,Che R C,et al.Preparation and structure analysis of titanium oxide nanotubes[J].Appl.Phys.Lett.,2001,79(22):3702-3704.
[9] 彭银,鲍玲,刘正银,等.千层饼状Cd(OH)2微米结构的合成与表征[J].无机材料学报,2008,23(5):1054-1058.
[10] 张兰月,李兴华,赵华涛,等.阳极氧化铝(AAO)模板法制备Cd(OH)2和Cd O纳米棒[J].无机化学学报,2008,24(11):1919-1922.
[11] Liu Xiao-lei,Li Chao,Han Song,et al.Synthesis and electronic transport studies of Cd O nanoneedles[J].Appl.Phys.Lett.,2003,82(12):1950-1952.
[12] Singh G,Kapoor I P S,Dubey R,et al.Synthesis characterization and catalytic activity of CdO nanocrystals[J].Mater.Sci.Engin.B,2011,176(2):121-126.
[13] 刘俊渤,常海波,窦森,等.水热合成法制备六方形纳米盘 Cd(OH)2[J].吉林大学学报(理学版),2009,47(3):605-608.
[14] Shi Wei-dong,Wang Cheng,Wang Hai-shui,et al.Hexagonal nanodisks of cadmium hydroxide and oxide with nanoporous structure[J].Crystal Growth & Design,2006,6(4):915-918.
[15] Zhang Hui,Ma Xiang-yang,Ji Yu-jie,et al.Synthesis of cadmium hydroxide,nanoflake and nanowisker by hydrothermal method[J].Mater.Lett.,2005,59(1):56-58.
[16] 简基康,吴荣,尚飞,等.真空热蒸发生长Cd X(X=S,Te)纳线研究性实验[J].物理实验,2010,30(8):1-4.
[17] 孙言飞,杨玮,简基康.化学气相淀积法制备CaN纳米结构设计性实验[J].物理实验,2011,31(2):1-5.
