丁苯酞预处理对大鼠脑缺血再灌注损伤的神经保护作用
2012-01-26辛世萌
殷 雁, 辛世萌
缺血性脑血管病是神经系统的常见病、多发病。脑缺血再灌注损伤是多数缺血性脑血管疾病的主要病理生理过程,其中主要的发病机制之一是细胞凋亡[1,2]。caspase-3 是一种凋亡执行因子[3],在缺血缺氧的条件下起到诱导细胞凋亡的作用。而bcl-2基因是bcl-2家族的一员,已有研究表明,其在体外能够抑制神经元凋亡[4],可在缺血缺氧所造成的神经细胞损伤中起保护作用。丁苯酞(商品名为恩必普NBP),是我国第一个拥有自主知识产权的国家Ⅰ类化学新药,其通过阻断缺血性脑卒中所致脑损伤的多个病理环节起作用,可改善脑能量代谢和缺血脑区的微循环和血流量,用于治疗轻、中度急性缺血性脑卒中。本实验应用药物预处理的方法,通过对脑梗死体积及凋亡相关因子的检测,观察丁苯酞在神经保护方面的作用。
1 材料和方法
1.1 实验动物分组 健康成年SD雄性大鼠48只,大连医科大学动物实验中心提供,体重200~250g,清洁级,室温环境饲养,自由进食水。随机分为假手术组、缺血再灌注组、丁苯酞预处理组,每组各16只。
1.2 主要试剂 丁苯酞软胶囊(0.2克/粒,石药集团恩必普药业有限公司);兔抗大鼠caspase-3和bcl-2抗体(Bioworld technology公司);SP试剂盒和DAB显色剂(北京中杉金桥生物技术有限公司)。
1.3 方法
1.3.1 预处理 丁苯酞预处理组于术前5d开始用丁苯酞溶剂(以丁苯酞胶囊溶于生理盐水配成10mg/ml混悬液,用前充分摇匀)以50mg/kg/d的剂量进行灌胃。其余两组相应给予等体积生理盐水。
1.3.2 MCAO 模型的制备 线栓法[5]制作右侧大脑中动脉栓塞(MCAO)模型:SD大鼠腹腔注射10%的水合氯醛(0.35ml/100g),背部固定后,颈部剪毛消毒,取颈正中切口,钝性分离右侧颈总动脉(CCA),颈内动脉(ICA)和颈外动脉(ECA)并挂线备用,结扎CCA和ECA,用动脉夹夹闭ICA远心端后,迅速于ICA上做一切口,从切口插入备好的鱼线,鱼线插入ICA后,打开夹闭ICA的动脉夹,轻柔送线接近18mm处,感觉有阻力时停止,固定拴线。缺血2h后拔除鱼线实施再灌注24h。假手术组仅暴露右侧颈总动脉,不做其余处理。
1.3.3 神经功能缺损评分 (按 Zea Long[5]5分制标准评分)于大鼠脑缺血再灌注1h后进行。0分:无神经损伤症状;1分:不能完全伸展对侧前爪;2分:向对侧转圈;3分:向对侧倾倒;4分:不能自发行走,意识丧失;5分:死亡。其中评分为1~3分且无蛛网膜下腔出血的大鼠进入实验,0分、4分和5分剔除,并随机补充。
1.3.4 脑梗死体积测定 模型制备成功后,假手术组在手术后2h,其余各组在达到各再灌注时间点24h时,每组各随机取8只大鼠,断头取脑,去除嗅球、小脑和低位脑干,其余用排刀冠状切成5片,每片厚度约2mm,置于 2%TTC(2%氯化-2,3,5-三苯基四氮唑)溶液中,37℃避光染色30min,4%多聚甲醛液中固定24h后用数码相机照相,正常组织为红色,梗死灶为白色,利用图像分析法计算各个脑片梗死面积,计算梗死体积。
1.3.5 标本及切片的制备 模型制备成功后,假手术组在手术后2h,其余各组在达到各再灌注时间点24h时,每组各随机取8只大鼠,经10%水合氯醛(0.35ml/100g)腹腔麻醉,打开胸腔,依次用生理盐水、4%多聚甲醛各200ml进行心脏(左心室)灌流固定,至流液透明,断头取脑。在右侧大脑半球距离嗅球尖端7~11mm之间冠状切取约2mm厚脑组织块,置入4%多聚甲醛液中固定24h,进行脱水、透明、包埋成蜡块,连续切片5张,每张厚约5μm。
1.3.6 免疫组织化学染色(SP法) 脑片经常规二甲苯脱蜡,梯度酒精脱水后-3%过氧化氢37℃20min,0.01mol/L PBS 冲洗3 ×3min-抗原修复-0.01 mol/L PBS冲洗3×3min,10%正常山羊血清37℃封闭15min-分别加入兔抗大鼠 caspase-3和 bcl-2一抗,4℃过夜,次日 0.01mol/L PBS冲洗 3×3min-滴加生物素标记的羊抗兔二抗,37℃,20min,0.01mol/L PBS冲洗3×3min-滴加辣根过氧化物酶标记链霉卵白素,37℃,20min,0.01mol/L PBS 冲洗 3 ×3min-3,3-二氨基联苯胺(DAB)显色 10 ~20min,流水冲洗,苏木复染,终止反应,脱水后封片剂封片。阴性对照用0.01mol/L PBS和山羊血清代替一抗。在光镜下观察胞浆呈棕黄染色的阳性细胞,于阳性细胞分布区随机选择5个不重复的视野,计算caspase-3、bcl-2阳性细胞的百分率。
1.4 统计学处理 采用SPSS13.0系统进行数据分析处理,所有结果用均数±标准差(±s)表示,神经功能缺损评分用Wilcoxon法秩和检验,组间比较用成组设计的t检验,检测指标在组间表达的变化用单因素方差分析。P保留小数点后3位,P<0.05表示差异有显著的统计学意义,P<0.01表示差异有非常显著的统计学意义。
2 结果
2.1 神经功能缺损评分 脑缺血2h再灌注24h后大鼠神经功能缺损主要表现为左前肢屈曲,肌张力降低,侧推阻力降低,活动减少,向左侧追尾转圈,伴或不伴有右侧Horner征。假手术组无神经缺损,评分为0;丁苯酞预处理后缺血再灌注组神经缺损程度明显改善,低于缺血再灌注组,差异有统计学意义(P<0.05)(见表1)。
2.2 脑梗死体积测定(TTC染色) 假手术组脑组织呈均匀红色无梗死灶;与缺血再灌注组相比,丁苯酞预处理后缺血再灌注组梗死灶体积减少(见图1~3),差异有统计学意义(P<0.05)(见表2)。
2.3 免疫组化检测
2.3.1 caspase-3表达 假手术组 caspase-3阳性细胞仅少量表达,缺血再灌注组caspase-3阳性细胞数量较多,与缺血再灌注组相比,丁苯酞预处理后缺血再灌注组caspase-3阳性细胞数量减少(见图4~6),差异均有统计学意义(P<0.05)(见表3)。
2.3.2 bcl-2表达 假手术组 bcl-2仅少量表达,缺血再灌注组bcl-2表达较假手术组增加,与缺血再灌注组相比,丁苯酞预处理后缺血再灌注组bcl-2表达上调(见图7~9),差异均有统计学意义(P<0.05)(见表4)。组别 例数 神经功能缺失评分(分)
表1 脑缺血再灌注后神经功能缺损评分(±s)
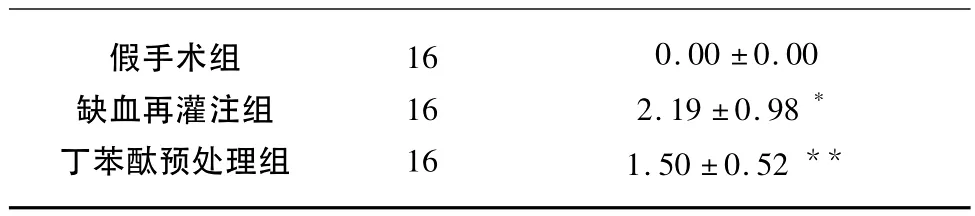
表1 脑缺血再灌注后神经功能缺损评分(±s)
与假手术组相比*P<0.01;与缺血再灌注组相比**P<0.05
假手术组缺血再灌注组丁苯酞预处理组16 16 16 0.00 ±0.00 2.19 ±0.98*1.50 ±0.52**
表2 脑缺血再灌注后脑梗死体积的比较(±s)

表2 脑缺血再灌注后脑梗死体积的比较(±s)
与假手术组相比*P<0.01;与缺血再灌注组相比**P<0.05
组别 例数 脑梗死体积(mm3)假手术组缺血再灌注组丁苯酞预处理组16 16 16 0.00 ±0.00 97.26 ±2.09*94.64 ±1.75**
表3 各组脑组织内caspase-3表达阳性率的比较(±s)

表3 各组脑组织内caspase-3表达阳性率的比较(±s)
与假手术组相比*P<0.01;与缺血再灌注组相比**P<0.05
组别 例数 caspase-3阳性率(%)假手术组缺血再灌注组丁苯酞预处理组16 16 16 10.81 ±0.60 67.12 ±1.47*66.16 ±0.96**
表4 各组脑组织内bcl-2表达阳性率的比较(±s)

表4 各组脑组织内bcl-2表达阳性率的比较(±s)
与假手术组相比*P<0.01;与缺血再灌注组相比**P<0.05
假手术组缺血再灌注组bcl-2阳性率(%)16 16 16 5.62 ±0.34 60.25 ±0.87*60.74 ±0.58**

图1 假手术组

图2 缺血再灌注组

图3 丁苯酞预处理组

图4 假手术组

图5 缺血再灌注组

图6 丁苯酞预处理组

图7 假手术组

图8 缺血再灌注组
3 讨论
缺血性卒中对脑有破坏性作用,事实上,每分钟脑缺血可以损害大约190万个神经元和140亿个突触[6]。目前研究认为,缺血性神经元的坏死与凋亡,共同参与缺血性脑损伤的形成[7]。局灶性脑缺血形成后,病灶分为两个区域,中心区主要以细胞死亡为主,中心区周围为缺血半暗带区,主要以细胞凋亡为主。脑缺血后神经损伤的形成过程主要有细胞凋亡参与,如能有效阻止细胞凋亡,即可减轻脑组织的损伤程度。在神经系统,现已知与凋亡相关的基因可分为两大类[8]:一类起促进细胞凋亡的作用,如caspase-3等;另一类起抑制细胞凋亡的作用,如bcl-2等。
caspase-3是caspase级联瀑布下游最关键的凋亡执行蛋白酶[9,10],不仅是细胞凋亡蛋白酶级联反应的必经之路,也是凋亡的关键酶和执行者[11,12],在各种因素启动的凋亡程序中起最后枢纽作用。caspase-3除了在凋亡中的关键作用以外,其在各种生物进程如细胞分化、粘附、神经发育和神经信号等方面起到至关重要的调节作用[13~15]。研究表明[16],caspase-3能够在动物缺血性发作模型中激活。在凋亡神经细胞中,caspase-3是重要的执行者,能够通过内外两条信号通道激活[17]。Schmidt-Kastner R等[18]在大鼠短暂局部缺血脑组织中检测到 caspase-3 mRNA。Fink K 等研究发现[19],caspase激活发生在MCAO后9h,且caspase抑制剂能减弱缺血再灌注损伤。重要的是,Rami A等[20]也发现,人脑缺血后caspase-3在脑组织中上调。这些研究提示,caspase-3可能是缺血发作中凋亡的重要媒介物[21]。本实验结果显示:丁苯酞预处理组的神经功能缺损程度较缺血再灌注组明显改善,脑梗死体积较之缺血再灌注组明显减小,可见丁苯酞的应用明显改善了脑缺血的神经损伤程度。缺血再灌注组、丁苯酞预处理组caspase-3阳性细胞数量均有增加,其表达主要位于病灶侧的缺血区域内,印证了caspase-3的激活在缺血缺氧诱导的细胞凋亡过程中的作用;丁苯酞预处理组caspase-3表达阳性率较之缺血再灌注组明显减少,可见丁苯酞可能是通过抑制细胞凋亡这一途径发挥神经保护作用。
bcl-2是bcl-2家族中的一员,是最早发现的功能最为明确的抗细胞凋亡基因之一,其编码的bcl-2蛋白是一种重要的内源性抗凋亡因子[22]。bcl-2的抗凋亡作用是通过预防细胞色素C释放入细胞质中来实现的[23]。许多研究表明,过度表达bcl-2能够减少卒中动物模型中缺血性脑损伤[24,25]。其主要作用是抑制细胞凋亡,是神经系统的主要神经保护性蛋白,其表达越多,脑保护作用越强[26]。本实验中bcl-2的表达在丁苯酞预处理组较缺血再灌注组明显上调,印证了bcl-2在细胞凋亡途径的关键环节上起到抑制凋亡的作用,减轻了缺血再灌注损伤;也说明了丁苯酞能够通过增加抗凋亡蛋白的表达发挥抑制细胞凋亡的作用,从而减轻缺血再灌注后的神经系统损伤。
本实验得出丁苯酞预处理对脑缺血再灌注损伤的保护机制可能是:(1)抑制促凋亡因子的产生,同时促进抗凋亡因子的产生,那么在发生脑缺血时,能够促进细胞凋亡的因子数量则比正常组织少,而保护细胞防止其凋亡的因子数量比正常组织多,从而达到减少细胞凋亡、增强保护作用的目的,起到神经保护作用;(2)在发生脑缺血时,使原有的再灌注能力增强,从而更好地修复受损的神经功能,达到神经保护的作用。
丁苯酞预处理可明显改善大鼠局灶性脑缺血再灌注损伤所致的神经功能缺损情况,并减少脑组织的梗死体积,具有一定的神经保护作用;其神经保护作用可能与上调bcl-2的表达、抑制caspase-3的表达有关,可见脑缺血药物预处理可以通过抑制细胞凋亡而起神经保护作用。这就为临床上缺血性脑血管疾病的预防治疗提供了新思路,可能给广大脑缺血疾病患者提供更多的用药选择,可能为我国自主研发的新药提供更为广阔的应用平台。
[1]Abas F,Alkan T,Goren B,et al.Neuroprotective effects of postconditioning on lipid peroxidation and apoptosis after focal cerebral ischemia/reperfusion injury in rats[J].Turk Neurosrg,2010,20(1):1 -8.
[2]Hauck L,Hansmann G,Dietz R,et al.Inhibition of hypoxia-induced apoptosis by modulation of retinoblastoma protein-dependent signaling in cardiomyocytes[J].Circ Res,2002,91:782 -789.
[3]Ayyash M,Tamimi H,Ashhab Y.Developing a powerful in silico tool for the discovery of novel caspase-3 substrates:a preliminary screening of the human proteome[J].BMC Bioinformatics,2012,13:14.
[4]Zhang R,Xue YY,Lu SD,et al.Bcl-2 enhances neurogenesis and inhibits apoptosis of newborn neurons in adult rat brain following a transient middle cerebral artery occlusion[J].Neurobiol Dis,2006,24(2):345-356.
[5]Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebralartery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[6]Saver JL.Time is brain-quantified[J].Stroke,2006,37:263 -266.
[7]Smith WS.Pathophysiology of focal cerebral ischemia:a therapeutic perspective[J].J Vasc Interv Radiol,2004,15(1 Pt 2):S3 -12.
[8]Dragumow M,Preston K.The role of inducible transcription factors in apoptotic nerve cell death[J].Brain Res,1995,21:21 -28.
[9]Prabhakar G,Vona-Davis L,Murray D,et al.Phosphocreatine restores high-energy phosphates in ischemic myocardium:Implication for offpump cardiac revascularization[J].J Am Coll Surg,2003,197(5):786-791.
[10]Meloni BP,Meade AJ,Kitikomolsuk D,et al.Characterisation of neuronal cell death in acute and delayed in vitro ischemia(oxygen-glucose deprivation)models[J].Neurosci Methods,2011,195:67 -74.
[11]Shi Y.Caspase activation,inhibition,and reactivation:a mechanistic view[J].Protein Sci,2004,13:1979-1987.
[12]Salvesen GS.Caspase and apoptosis[J].Essays Biochem,2002,38:9-19.
[13]Nakamoto K,Kuratsu J,Ozawa M.Beta-catenin cleavage in non-apoptotic cells with reduced cell adhesion activity[J].Int J Mol Med,2005,15(6):973 -979.
[14]D'Amelio M,Cavallucci V,Cecconi F.Neuronal caspase-3 signaling:not only cell death[J].Cell Death Differ,2010,17(7):1104 -1114.
[15]Puga I,Rao A,Macian F.Targeted cleavage of signaling proteins by caspase 3 inhibits T cell receptor signaling in anergic T cells[J].Immunity,2008,29(2):193 -204.
[16]Asahi M,Hoshimaru M,Uemura Y,et al.Expression of interleukin-1 beta converting enzyme gene family and bcl-2 gene family in the rat brain following permanent occlusion of the middle cerebral artery[J].J Cereb Blood Flow Metab,1997,17(1):11 -18.
[17]Porter AG,Janicke RU.Emerging roles of caspase-3 in apoptosis[J].Cell Death Differ,1999,6(2):99 -104.
[18]Schmidt-Kastner R,Truettner J,Zhao W,et al.Differential changes of bax,caspase-3 and p21 mRNA expression after transient focal brain ischemia in the rat[J].Brain Res Mol Brain Res,2000,23,79(1~2):88-101.
[19]Fink K,Zhu J,Namura S,et al.Prolonged therapeutic window for ischemic brain damage caused by delayed caspase activation[J].Cereb Blood Flow Metab,1998,18(10):1071 -1076.
[20]Rami A,Sims J,Botez G,et al.Spatial resolution of phospholipid scramblase 1(PLSCR1),caspase-3 activation and DNA-fragmentation in the human hippocampus after cerebral ischemia[J].Neurochem Int,2003,43(1):79 -87.
[21]Jie L,Yuqin C,Yao D,et al.Occlusion of middle cerebral artery induces apoptosis of cerebellar cortex neural cells via caspase-3 in rats[J].Turk Neurosurg,2011,21(4):567 - 574.
[22]陆晓红,张亚娟,王丽华,等.pHGF对脑缺血再灌注大鼠bcl-2、p53表达的影响[J].中风与神经疾病杂志,2009,26(1):11-13.
[23]Nakka VP,Gusain A,Mehta SL,et al.Molecular mechanisms of apoptosis in cerebral ischemia:multiple neuroprotective opportunities[J].Mol Neurobiol,2008,37:7 -38.
[24]Okazaki T,Magaki T,Takeda M,et al.Intravenous administration of bone marrow stromal cells increases survivin and Bcl-2 protein expression and improves sensorimotor function following ischemia in rats[J].Neurosci Lett,2008,430:109 -114.
[25]Xing B,Chen H,Zhang M,et al.Ischemic postconditioning inhibits apoptosis after focal cerebral ischemia/reperfusion injury in the rat[J].Stroke,2008,39:2362 -2369.
[26]杨 杰,周芝文,郑丽君,等.TrkA和Bcl-2在局灶性脑缺血再灌注大鼠大脑皮质中的表达[J].中风与神经疾病杂志,2010,27(7):584-588.
