绞股蓝属三种植物的POD、EST和SOD同工酶研究
2012-01-24袁带秀袁志忠刘世彪
袁带秀,袁志忠,刘世彪*
(1.吉首大学医学院,湖南吉首416000;2.吉首大学 植物资源保护与利用湖南省高校重点实验室,湖南吉首416000)
绞股蓝[Gynostemma pentaphyllum(Thunb.)Makion]为葫芦科(Cucurbitaceae)多年生草质藤本植物,有“南方人参”和“第二人参”的美誉,别名小苦药、公罗锅底、五叶藤、遍地生根、甘茶蔓。多分布于亚热带地区,我国主要分布于陕西南部及长江以南各省区。现代药理学证明,绞股蓝具有抗疲劳、降血脂、降血压、促进细胞新陈代谢、增强免疫、抑制肿瘤、防衰老、祛痰利尿等作用,临床上用以治疗气管炎和传染性肝炎等[1]。
同工酶是研究植物多样性的有力工具,通过分析各种酶的同工酶电泳谱带,可以识别出控制这些酶的基因位点和这些位点的多态性,并把遗传变异数量化,可以较客观地反映整个基因组的变异。由于酶谱带的变化能直接反映出物种DNA分子水平上的变化,近20年来酶分析方法已广泛应用于植物种群的遗传多样性、遗传分化及遗传结构等研究中[2-6]。目前人们对绞股蓝同工酶谱的研究还较少[7-9],尤其对不同物种绞股蓝的同工酶的比较研究尚未见报道。本文以绞股蓝、广西绞股蓝和五柱绞股蓝为材料,对其过氧化物酶同工酶(POD)、酯酶同工酶(EST)和超氧物歧化酶同工酶(SOD)进行比较研究,试图通过同工酶分析来探讨不同物种和同一物种不同器官中的同工酶酶谱特征及各种源之间的亲缘关系,进而为绞股蓝的生理生化研究和绞股蓝的综合应用提供理论依据。
1 材料与方法
1.1 材料
材料:五柱绞股蓝 G.pentagynum(编号为1号)、广西绞股蓝G.guangxiense(编号为2号)和绞股蓝 G.pentaphyllum(编号为3号)于2010年9月下旬,从吉首大学后山试验园地分别随机采集若干株,用蒸馏水洗净,吸水纸吸干水分后,分别按其根、茎、叶不同器官依次取样。
仪器:DYY-II-2C稳压稳流电泳仪、DYY-II-28A型垂直电泳槽、TGL-16G高速冷冻离心机、BINTA2020D凝胶成像分析系统。
1.2 方法
1.2.1 样品制备 分别称取五柱绞股蓝(1号)、广西绞股蓝(2号)和绞股蓝(3号)样品(鲜品冷冻)1.0 g,加1 mol·L-1Tris-HCl(pH8.0)样品提取液1 mL于冰浴研成匀浆,然后以1 mL提取液分几次洗入离心管,在高速冷冻离心机上以8 000 r/min离心10 min,上清液加等体积40%的蔗糖溶液混匀,置冰箱内冷藏,供点样用。
1.2.2 试剂配制及凝胶制备 采用不连续聚丙烯酰胺凝胶电泳。分离胶:浓度为7.5%;浓缩胶:浓度为4%;电极缓冲溶液:pH 8.3的Tris-Gly系统;分离胶灌制完成后置4℃冰箱中过夜。浓缩胶在电泳前灌制。
1.2.3 电泳 用微量进样器分别吸取20 μL样品液缓缓注入样品槽底部,在负极槽电极缓冲液中加入1滴溴酚蓝指示剂示踪,将电泳槽正负极与电泳仪正负极相连,电泳开始时控制电流为15 mA,待示踪指示剂行至距琼脂层约1 cm时关闭电源,停止电泳。整个过程约需2 h,为防止温度过高,电泳过程在冰箱内进行。
1.2.4 染色 POD同工酶采用醋酸-联苯胺染色法染色;EST同工酶采用乙酸-α-萘脂、乙酸-β-萘脂和固兰RR盐染色;SOD同工酶采用SOD活性法[2]。电泳结束后,染色、脱色、固定、拍照、作图。
1.2.5 谱带的相对迁移率和相似系数的计算 计算谱带的相对迁移率(Rf)=酶带迁移距离/指示剂迁移距离。相似系数(C)=2n/(n1+n2)×100%,式中n1为A酶谱的酶带数;n2为B酶谱的酶带数;n为A与B品种相同的酶带数[3]。
2 结果与分析
2.1 POD 同工酶
从表1及图1中可以看出,3个不同物种绞股蓝根、茎、叶POD同工酶可分为三大酶区:第Ⅰ酶区的相对迁移率为0.07~0.21;第Ⅱ酶区的相对迁移率为0.28~0.48;第Ⅲ酶区的相对迁移率为0.55~0.94。三大酶区中,根共有12条酶带,茎共有12条酶带,叶共有11条酶带。3个物种的绞股蓝根均含有酶带②,茎均含有酶带②、③,叶均含有酶带①、⑧、⑩,且颜色最深,这可能是不同物种绞股蓝的根、茎、叶在POD同工酶上的反应,即酶带②,酶带②、③,酶带①、⑧、⑩分别为不同物种绞股蓝根、茎、叶在POD同工酶上的特征酶带。
同一物种的绞股蓝根、茎、叶组织中POD的表达具有一定的差异。五柱绞股蓝(1号)的根有5条酶带,茎有6条酶带,叶有6条酶带,其中根有2条强带,茎有4条强带,叶有5条强带。广西绞股蓝(2号)的根有11条酶带,茎有8条酶带,叶有9条酶带,其中根有4条强带,茎有5条强带,叶有7条强带。绞股蓝(3号)的根有8条酶带,茎有6条酶带,叶有9条酶带,其中根有2条强带,茎有3条强带,叶有7条强带。由此可见,POD同工酶活性在不同物种绞股蓝的叶上表现最强,其次是茎,最后是根。

表1 绞股蓝属3种植物根、茎、叶POD同工酶谱带的相对迁移率
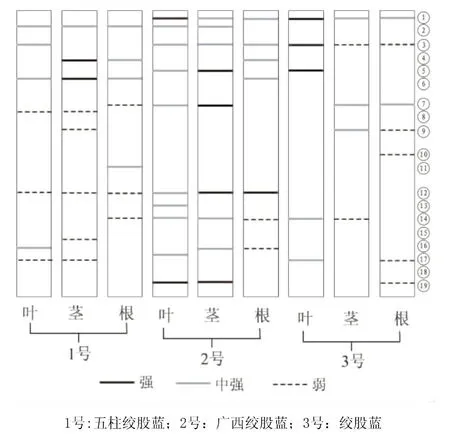
图1 绞股蓝属3种植物的根、茎、叶POD同工酶酶谱
2.2 EST 同工酶
从表2及图2中可以看出,3个不同物种绞股蓝的根、茎、叶EST同工酶表达位点较丰富,其酶区可分为三区:第Ⅰ酶区的相对迁移率为0.03~0.12;第Ⅱ酶区的相对迁移率为0.17~0.4;第Ⅲ酶区的相对迁移率为0.5~0.94。三大酶区中,广西绞股蓝(2号)含有7条强带,17条中强带;绞股蓝(3号)含有3条强带,7条中强带;五柱绞股蓝(1号)含有2条强带,9条中强带。从酶带强弱看,EST同工酶在广西绞股蓝(2号)的表达要强于其他两个物种。
同一物种绞股蓝的根、茎、叶EST表达也有一定的差异。从图2中看出,五柱绞股蓝(1号)的根有7条带,其中中强带4条,弱带3条;茎有8条带,其中强带2条,中强带1条,弱带5条;叶有7条带,其中中强带4条,弱带3条。广西绞股蓝(2号)的根有7条带,其中强带1条,中强带4条,弱带2条;茎有9条带,其中强带4条,中强带5条;叶有10条带,其中强带2条,中强带8条。绞股蓝(3号)的根有7条带,其中中强带2条,弱带5条;茎有5条带,其中中强带3条,弱带2条;叶有5条带,其中强带3条,中强带2条。综合来看,不同物种绞股蓝EST同工酶在茎、叶上的表达高于根。
2.3 SOD 同工酶
从表3和图3中看出,3个物种的绞股蓝及同一种绞股蓝的不同器官的SOD表达都有一定差异。在SOD同工酶Rf为0.13位置上,五柱绞股蓝(1号)的根、叶均表现为强带,茎表现为中强带;广西绞股蓝(2号)的根、茎、叶都表现为强带;绞股蓝(3号)的叶表现为强带,茎表现为中强带,根仅表现为弱带。在Rf为0.23位置上,五柱绞股蓝(1号)的叶表现为中强带,根表现为弱带,而茎没有表现出酶带;广西绞股蓝(2号)的根表现为中强带,茎、叶表现为弱带;绞股蓝(3号)的根、茎、叶均表现为弱带。在Rf为0.55位置上,五柱绞股蓝(1号)的叶表现为强带,而根、茎表现为弱带;广西绞股蓝(2号)的根、茎、叶均表现为强带;绞股蓝(3号)的根、茎、叶均表现为中强带。在Rf为0.83位置上,五柱绞股蓝(1号)的茎、叶均表现为中强带,而根表现为弱带;广西绞股蓝(2号)的叶表现为强带,茎表现为中强带,而根表现为弱带;绞股蓝(3号)的茎、叶表现为强带,根却没表现出酶带。由上所述,可知酶带①为3种绞股蓝SOD同工酶在叶上的特征谱带。从酶活性看,SOD同工酶在叶上表现最强,其次是茎,最后是根。3个物种绞股蓝中,SOD同工酶在广西绞股蓝上表现最强。
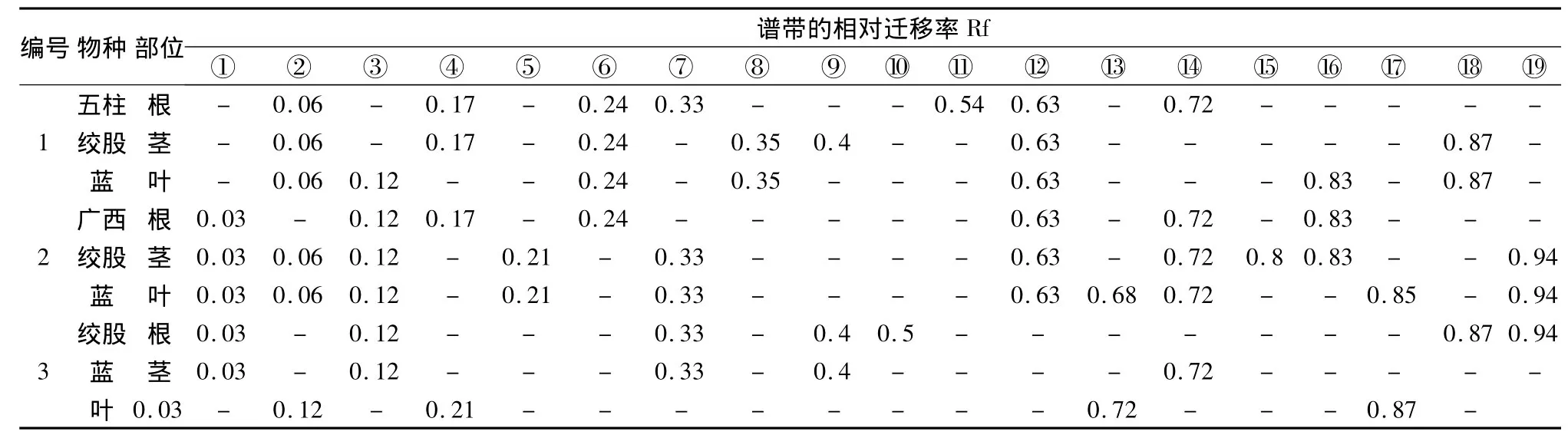
表2 绞股蓝属3种植物根、茎、叶EST同工酶谱带的相对迁移率

图2 绞股蓝属3种植物的根、茎、叶EST同工酶酶谱

表3 绞股蓝属3种植物根、茎、叶SOD同工酶谱带的相对迁移率
2.4 相似系数与亲缘关系
同工酶的相似系数可以用于判定物种的亲缘关系。本实验以叶为例,从表4中看出,绞股蓝不同物种间同工酶谱的相似系数为0.31~0.58,有较近的亲缘关系;其中广西绞股蓝(2号)与绞股蓝(3号)的相似系数最高,五柱绞股蓝(1号)与绞股蓝(3号)的相似系数最低,说明广西绞股蓝(2号)与绞股蓝(3号)的亲缘关系最近,五柱绞股蓝(1号)与绞股蓝(3号)的亲缘关系最远。
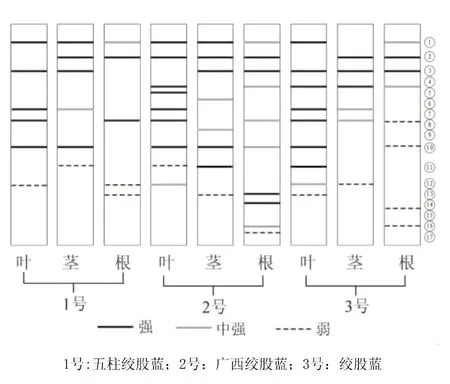
图3 绞股蓝属3种植物的根、茎、叶SOD同工酶酶谱

表4 绞股蓝属3种植物叶的同工酶相似系数
3 讨论
植物的同工酶分析可以很好地了解植物的生理活动状态。POD广泛存在于高等植物的组织中,参与各种生理活动,具有多种分子形式的组织特异性,在植物不同生长发育时期其同工酶酶谱构成及酶活性均存在差异,表现为多型现象。其变化与植物组织器官的分化、形成和生理状态等密切相关,且酶谱变化先于形态分化[10-11]。EST是催化酯类化合物水解的酶系,它催化羧酸酯类的酯键的水解或合成,在植物不同的生长发育时期表现出器官特异性[12]。SOD广泛存在于生物体内的含金属酶之一,是一种重要的氧自由基清除剂,它能催化超氧化物阴离子自由基发生歧化反应,产生分子氧和过氧化氢,具有多种生物学作用。
绞股蓝属植物具有17个种及变种[13],前人仅对绞股蓝的几种同工酶进行了初步研究,绞股蓝幼苗的POD同工酶具有3条带[7],而绞股蓝愈伤组织中的POD同工酶则有7~9条带[8],SOD同工酶谱有12条带,分为3个酶区[9]。本实验对绞股蓝同工酶电泳数据的分析表明,绞股蓝的POD同工酶具有12条带,具有3个酶区;SOD同工酶具有4条带,也具有3个酶区。造成这种差异的原因是在生长发育过程中,植物器官或组织的生理特性和代谢过程会发生变化,同工酶的类型也会随之变化。绞股蓝不同器官的酶带数和强弱差异的变化是较大的,其POD、EST、SOD同工酶酶带在叶上表现最强,茎其次,根最弱。如EST同工酶带数在五柱绞股蓝的根、茎、叶上分别为7、8、7条,在广西绞股蓝的根、茎、叶上分别为7、9、10条,在绞股蓝的根、茎、叶上分别为7、5、5条,这反映了不同种类植物不同器官的同工酶特异性表现是存在差异的。
酶谱可以反映不同植物物种间的相互联系与区别,有助于判别物种间的亲缘关系。酶谱的差异表现在酶带颜色深浅不同和迁移率不同。本实验证明了绞股蓝不同物种之间既有共同酶带,又有各自的特征酶带,以广西绞股蓝酶带总条数最多,五柱绞股蓝酶带总条数最少。根据 Garva和 Tsunewaki(1977)等提出的“同工酶条带越多的品系越进化”的理论,同工酶谱条带最少的五柱绞股蓝较原始,条带最多的广西绞股蓝分化程度较大,是3个物种中最为进化的种质。这种同工酶指标在绞股蓝不同物种之间的特异性,是与绞股蓝属不同物种形态学上的差异性一致的,因为绞股蓝和广西绞股蓝属于绞股蓝亚属,而五柱绞股蓝属于喙果藤亚属[13]。因此,同工酶的酶谱分析完全可以作为绞股蓝属植物分类鉴定的重要依据。
[1]周建华,张兴亚.绞股蓝开发研究新进展及应用[J].食品科技,2010,35(2):74-76.
[2]罗广华,王爱国.植物SOD的凝胶电泳及活性的显示[J].植物生理学通讯,1983,19(6):44-45.
[3]邱胜军,彭 宇,解 江.三种蜘蛛酯酶同工酶的比较研究[J].蛛形学报,2006,15(1):19-22.
[4]陈启林,巩振辉,陈 静.番茄POD与EST同工酶PAGE方法研究[J].西北农业学报,1999,8(1):87-90.
[5]祝红艺,张显西.非洲菊过氧化物酶同工酶酶谱分析[J].西北农业学报,2005,14(1):76-78.
[6]丁 玲,陈发棣,滕年军,等.菊花品种间过氧化物酶、酯酶同工酶的遗传多样性分析[J].中国农业科学,2008,41(4):1142-1150.
[7]邹芳平,肖娅萍,张传军,等.超声波刺激对绞股蓝幼苗的POD同工酶影响[J].陕西师范大学学报:自然科学版,2007,35(1):96-98.
[8]李 纯,周立人.激素对绞股蓝愈伤组织过氧化物酶及皂甙含量的影响[J].安徽农业大学学报,1998,25(4):448-451.
[9]黄 琴,何和明.绞股蓝超氧物歧化酶及某些理化特性的研究[J]中国野生植物资源,2000,19(3):17-19.
[10]梁艳荣,胡晓红,张颍力.植物过氧化物酶生理功能研究进展[J].内蒙古农业大学学报:自然科学版,2003,24(2):110-113.
[11]林亨芳,王金英,江川.水稻不同部位酯酶同工酶酶带和酶谱分析[J].福建农业大学学报:自然科学版,1994,23(3):262-265.
[12]马建萍,古世禄,独俊娥,等.谷子(粟)生育过程中POX同工酶的分析[J].作物学报,2002,28(3):406-416.
[13]陈书坤.绞股蓝属植物的分类系统和分布[J].植物分类学报,1995,33(4):403-410.
