家蝇Cecropin A分子体外表达及抗菌活性鉴定*
2012-01-24郑学礼
王 炜,郑学礼
抗菌肽广泛分布于自然界中,存在于许多昆虫体内[1-2]。在生物体对抗微生物中扮演着重要角色[3]。到目前为止,未发现耐抗菌肽的细菌出现。抗菌肽作为一种潜在的抗菌药物倍受关注。天蚕素最早是从家蚕体内发现的一种具有抗菌活性的多肽,已证明具有广谱、高效的抑菌效能[4]。分子结构简单,抗菌机制明确[5],对动物免疫原性低、无毒性[4],是很好的潜在抗菌药物[6]。但是从生物体中分离纯化天蚕素费时、效率低;而人工合成天蚕素成本高,均无应用价值。大肠杆菌蛋白质表达系统是一种技术成熟、低成本的重组蛋白质表达系统。由于抗菌肽对宿主细胞的毒性作用和细胞内蛋白酶的敏感性[7],不能直接在细菌表达体系中表达。我们通过生物信息学方法分析MC的天然结构,采用伴侣分子融合改变结构的策略[8-12],在大肠杆菌中表达MC分子。为能够在融合蛋白质表达后,获得家蝇天蚕素成熟肽(M.domestica mature cecropin,MC),我们在分子伴侣Trx分子和天蚕素分子之间加入色氨酸残基,设计构建胃蛋白酶水解位点,便于MC从融合蛋白质中释放。
本研究构建Thioredoxin&MC融合蛋白质表达载体,在大肠埃希氏菌中成功表达了具有生物活性的抗菌肽分子,并证明其生物活性。
1 材料与方法
1.1 试剂 T4DNA连接酶,XhoI、HindⅢ限制性内切酶,RT-PCR试剂盒,Taq酶购自TaKaRa公司,TRIzol试剂购自Invitrogen公司,PCR产物回收试剂盒和质粒抽提试剂盒购自上海申能博彩生物科技有限公司,DEPC、IPTG、DNA Marker、氨苄青霉素均购自北京鼎国,其余试剂均为分析纯。pET32a表达质粒由本室保存。家蝇成虫,由广东省疾病控制中心提供,本室饲养。
1.2 家蝇天蚕素基因的克隆及重组质粒构建 取10条家蝇3龄幼虫,细针蘸E.coli针刺其体壁,每虫1针,诱导Cecropin A基因表达。处理后置于烧杯内,室内饲养24h。根据GenBank登录的天蚕素基因(登录号为AF416602)设计 MC(114bp)基因序列引物,并在5′端、3′端按分别加入HindⅢ与XhoI限制性酶切位点。在HindⅢ限制性酶切位点后加入色氨酸密码子(TGG)。按照TRIzol试剂说明书抽提总mRNA。按照TaKaRa RT-PCR试剂盒说明书,逆转录扩增MC基因。PCR产物经1.2%琼脂糖凝胶电泳分离后,用PCR凝胶回收试剂盒回收纯化PCR扩增片段。使用HindⅢ与XhoI限制性酶同时酶切纯化的PCR产物及pET32a质粒。酶切产物经离心沉淀重悬后混合,混合物中加入T4DNA连接酶过夜连接构建pET32a-MC重组质粒。连接产物转化大肠埃希菌DH5(中。菌落PCR筛选阳性克隆。
1.3 pET32a-MC重组质粒的诱导表达 从大肠埃希菌DH5(中提取重组质粒pET32a-MC转化入表达细菌大肠埃希菌BL21中。挑取pET32a-mc/BL21单菌落,35℃过夜培养,次日离心过夜培养的菌液,用新鲜培养液将菌液的OD600值调整到0.8。加入终浓度为1mmol/L IPTG诱导表达4h。取1.5mL菌液,用十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分析pET32a-MC重组质粒的蛋白质表达。
1.4 Trx&MC融合蛋白质的纯化及水解 取1 mmol/L IPTG诱导表达后的菌液500ml离心沉淀。沉淀菌按照QIAGEN公司Ni-NTA Agarose操作说明书纯化重组蛋白质。重组蛋白质加入透析袋中透析除去咪唑。将透析袋包埋在蔗糖中,4℃进行浓缩。蛋白质浓缩液加入pH 1.3的磷酸:磷酸一氢钠缓冲液及胃蛋白酶。蛋白质溶液放入37℃恒温摇床过夜水解。过夜消化的蛋白液用0.5 mmol/L碳酸氢钠调整溶液pH值为7.0。蛋白水解液加入透析袋中,放入PBS缓冲液4℃过夜透析复性。过夜复性的透析袋放入蔗糖中,于4℃下浓缩蛋白质。
1.5 Trx&MC融合蛋白质水解产物的分析 取50μL融合蛋白质的水解产物,加入2×SDS样品缓冲液,沸水中加热30s,使用4%层积胶和16%分离胶的Tricine-SDS-PAGE分析结果。30V跑完层积胶,100V跑完分离胶。电泳完成后立即将胶放入含甲醛的固定液中30min,取出后放入ddH2O中10min,后用考马斯亮兰染色。
1.6 MC体外活性实验结果 采用细菌生长抑制实验鉴定MC在体外的生物活性。将胃蛋白酶溶液、纯化的融合蛋白质溶液和MC浓缩液浓度调整0.035mg/mL(下同)。从过夜培养的大肠埃希菌DH5(菌液中分别吸取15mL菌液移入不同的5个新锥形瓶中,分别加入5mL MC液、胃蛋白酶液、融合蛋白质液和5mL LB培养液、终浓度为50μg/mL的氨苄青霉素。37℃,250r/min振荡器中培养,每h取样测量菌液OD600值。
2 结 果
2.1 家蝇天蚕素基因的克隆 RT-PCR扩增的产物经1.2%琼脂糖凝胶电泳分析。结果如图1所示,在100bp~200bp DNA Marker处有一特异扩增条带,大小与理论值相符。
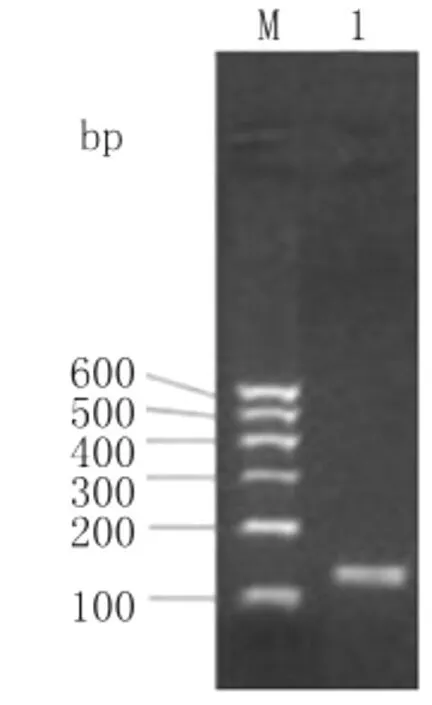
图1 家蝇MC基因扩增结果M:100bp DNA分子质量标准;1:PCR扩增产物Fig.1 Results of amplification on MC gene1:The PCR products of MC;M:DNA Marker 100
2.2 重组蛋白质的诱导表达及重组蛋白质的纯化重组菌pET32a-mc/BL21经IPTG诱导后产物及纯化重组蛋白质Trx&MC,用十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分析结果见图2。
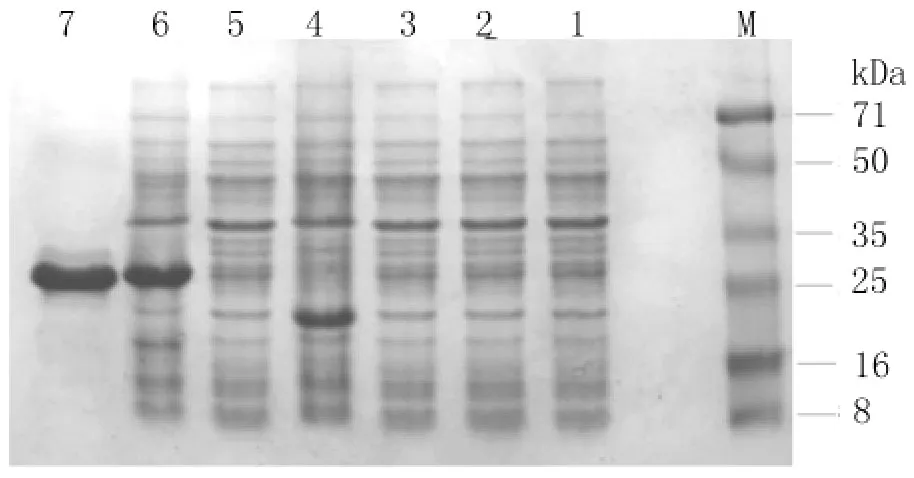
图2 SDS-PAGE分析结果M:标准蛋白质分子量;1:诱导前的BL21空菌;2:诱导后的BL21空菌;3:诱导前的pET32a/BL21;4:诱导后的 pET32a/BL21 ;5:诱导前的 pET32a-mc/BL21;6:诱导后的pET32a-mc/BL21;7:纯化后的重组蛋白Fig.2 The SDS-PAGE analysis of the recombinant proteinM:Protein marker;1:The protein expression of BL21without induction by IPTG;2:The protein expression of BL21with induction by IPTG;3:The protein expression of pET32a/BL21without induction by IPTG;4:The protein expression of pET32a/BL21with induction by IPTG;5:The protein expression of pET32a-mc/BL21without induction by IPTG;6:The protein expression of pET32a-mc/BL21with induction by IPTG;7:The purified recombinant protein.
2.3 重组蛋白质的水解产物分析 Trx&MC融合蛋白质经胃蛋白酶在pH 1.3、37℃条件下水解。水解产物用Tricine-SDS-PAGE分析,结果如图3所示,可见两条蛋白质带,一条蛋白质带处于35kDa蛋白质Marker旁,其大小与胃蛋白酶分子质量35 kDa相符。另一条蛋白质带小于8kDa蛋白质Marker,与MC理论值4kDa相符,见图3。
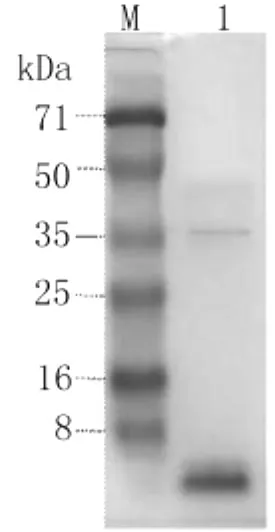
图3 Tricine-SDS-PAGE结果M:标准蛋白质分子量;1:融合蛋白质水解液;Fig.3 Tricine-SDS-PAG analysis of hydrolyzateM:Marker;1:Hydrolyzate
2.4 天蚕素体外活性实验结果 在相同OD600值的BL21(DE3)大肠杆菌中,加入终浓度为0.035 mg/ml的MC、Trx&MC、胃蛋白酶和LB液体培养基及氨苄青霉素溶液,每隔1h取样一次测量各样品中菌液的OD600值,并绘制细菌的生长曲线,见图4。
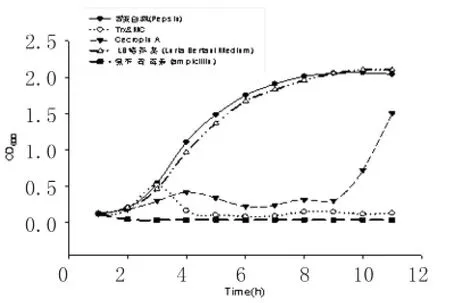
图4 液态生长抑制实验Fig.4 The inhibition growth experiment in liquid
3 讨 论
天蚕素已经从很多昆虫体内分离出来[13],他们结构简单、分子质量小,具有广谱的抗革兰氏阴性菌和某些真菌的活性[14],具有很好的药物开发潜能。在我们的研究中,从家蝇体内克隆出天蚕素基因序列,并重组入大肠埃希菌表达系统中,以融合蛋白质的形式表达出了天蚕素成熟多肽分子。Trx作为伴侣分子将MC分子包裹到其分子内部,消除了MC对原核宿主的杀伤作用。重组蛋白质胃蛋白酶水解产物Tricine-SDS-PAGE分析显示天蚕素分子成功从融合蛋白质内分离出来。
从抑菌试验的结果中可以看出Trx&MC融合蛋白质在最初的几小时内可以抑制细菌的生长,但在后期会失去作用。而MC可以很好的抑制细菌的生长,且抑菌时间较长。比较融合蛋白质水解前后的生物活性变化可以看出,分子伴侣Trx不能完全抑制MC分子的生物活性,但可以大大减轻MC分子对大肠埃希菌的抑制活性。细菌对融合蛋白质的抑制作用会产生耐受。
为了排除死亡细菌对OD值的影响,最后用接种环蘸取加有MC和氨苄青霉素的菌液划板,次日观察到氨苄青霉素处理的菌液没有菌落长出,而MC处理的菌液有菌落长出。因此可以得出MC只能抑制细菌的生长,不像氨苄青霉素能将其完全杀死。
[1]Gabay JE.Ubiquitous natural antibiotics[J].Science,1994,264(5157):373-374.DOI:10.1126/science.8153623
[2]Steiner H,Hultmark D,Engström A,et al.Sequence and speci-ficity of two antibacterial proteins involved in insect immunity[J].Nature,1981,292(5820):246-248.
[3]Boman HG.Peptide antibiotics and their role in innate immunity[J].Annu Rev Immunol,1995,13:61-92.DOI:10.1146/annurev.iy.13.040195.000425
[4]Shin SY,Kang JH,Jang SY,et al.Effects of the hinge region of cecropin A(1-8)magainin 2(1-12),a synthetic antimicrobial peptide,on liposomes,bacterial and tumor cells[J].Biochim Biophys Acta,2000,1463(2):209-218.DOI:10.1016/S0005-2736(99)00210-2
[5]Dathe M,Wieprecht T.Structural features of helical antimicrobial peptides:their potential to modulate activity on model membranes and biological cells[J].Biochim Biophys Acta,1999,1462(1-2):71-87.DOI:10.1016/S0005-2736(99)00201-1
[6]Hancock RE,Lehrer R.Cationic peptides:a new source of antibiotics[J].Trends Biotechnol,1998,16(2):82-88.DOI:10.1016/S0167-7799(97)01156-6
[7]Skosyrev VS,Kulesskiy EA,Yakhnin AV,et al.Expression of the recombinant antibacterial peptide sarcotoxin IA inEscherichiacolicells[J].Protein Expr Purif,2003,28(2):350-356.DOI:10.1016/S1046-5928(02)00697-6
[8]Smith DB,Johnson KS.Single-step purification of polypeptides expressed inEscherichiacolias fusions with glutathione S-transferase[J].Gene,1988,67(1):31-40.DOI:10.1016/0378-1119(88)90005-4
[9]Pryor KD,Leiting B.High-level expression of soluble protein inEscherichiacoliusing His6-tag and maltose binding-protein double affinity fusion system[J].Protein Expr Purif,1997,10(3):309-319.DOI:10.1006/prep.1997.0759
[10]di Guan C,Li P,Riggs PD,et al.Vectors that facilitate the expression and purification of foreign peptides inEscherichiacoliby fusion to maltose-binding protein[J].Gene,1988,67(1):21-30.
[11]LaVallie ER,DiBlasio EA,Kovacic S,et al.A thioredoxin gene fusion expression system that circumvents inclusion body formation inE.colicytoplasm[J].Biotechnology(NY),1993,11(2):187-193.
[12]Tenno T,Goda N,Tateishi Y,et al.High-throughput construction method for expression vector of peptides for NMR study suited for isotopic labeling[J].Protein Eng Des Sel,2004,17(4):305-314.DOI:10.1093/protein/gzh044
[13]Boman HG.Cecropins:antibacterial peptides from insects and pigs[M].In:Hoffmann JA,Janeway CAJ,Natori S,editors.Phylogenetic perspectives in immunity:the insect host defense.Austin:R.G.Landes Company.1994:3-17.
[14]DeLucca AJ,Bland JM,Jacks TJ,et al.Fungicidal activity of cecropin A[J].Antimicrob Agents Chemother,1997,41(2):481-483.
