淡色库蚊kdr等位基因突变及抗药性检测方法的研究*
2012-01-24刘宏美代玉华王海防黄晓丹刘丽娟赵玉强王怀位公茂庆
刘宏美,代玉华,王海防,程 鹏,黄晓丹,刘丽娟,赵玉强,王怀位,公茂庆
淡色库蚊(Culexpipienspallens)是北方地区班氏丝虫和乙型脑炎的主要传播媒介,影响着人们的身体健康[1]。化学防治是杀灭蚊虫最重要的方法,尤以高效的拟除虫菊酯类杀虫剂为主。然而,该类杀虫剂连续过度的使用引起了蚊虫抗药性的迅猛发展,药效急剧下降。研究表明拟除虫菊酯类杀虫剂抗性产生与蚊虫的神经轴突钠离子通道(sodiumchannel,SC)第Ⅱ结构域S6节段1014位点的点突变密切相关,其引起的抗性表型称之为靶标抗性(targetsiteresistance)又称击倒抗性(knockdown resistance,kdr)[2]。学者们首先在冈比亚按蚊(A-nophelesgambiae)和 致 倦 库 蚊,(Culexpipiens quinquefasciatus)发现了 L1014F型突变[3],后在阿拉伯按蚊(Anophelesarabiensis)幼虫中发现L1014S型突变[4],该位点上的碱基“T”突变为“C”,相应的亮氨酸被丝氨酸取代。
1 材料与方法
1.1 材料
1.1.1 样本 淡色库蚊自然种群试验蚊虫采自山东省济南、济宁和青岛的监测点。敏感种群来在山东省疾病预防控制中心。采用羽化后1~3d的雌蚊做WHO成蚊接触筒法生物活性测定。
1.2 试剂 溴氰菊酯(99.0%),购自德国 Dr.Ehrenstorfer公司,总DNA提取试剂盒、凝胶回收试剂盒,购自QIAGEN公司,蛋白酶抑制剂、Pyrobest DNA Polymerase、dNTP、RNA 酶、DNA 分子量标准2000均购自Takara公司,引物由AUGCT公司合成,白油,购自美国Sigma公司。
1.2 方 法
1.2.1 WHO成蚊接触筒法 采用 WHO标准药膜(将白油和乙醚按1∶2的体积配比的混合物与溴氰菊酯混合,吸取3mL滴于16×12.5cm的新华Ⅰ号滤纸上,其溴氰菊酯浓度为0.05%)。以WHO区分剂量标准进行测定,同时设空白对照,记录接触10、15、20、30、40、50、60min时蚊虫的击倒数量。将接触药膜60min后的受试蚊吹入恢复筒,以10%的葡萄糖水饲养24h,记录成蚊的死亡数和存活数,收集-70℃保存,用于提取DNA。
1.2.2 成蚊基因组DNA提取 选取济南、青岛、济宁及敏感种群的受试纹,分为敏感组(死亡)和抗性组(存活)淡色库蚊,共418只。用QIAGEN公司的DNeasy Blood﹠Tissue Kit试剂盒按其步骤提取单蚊基因组DNA。
1.2.3kdr基因扩增 以淡色库蚊钠离子通道cDNA为模板,应用Primer primier 5.0软件,设计特异性引物为 C1 5′-CCTGCCACGGTGGAACTTC-3′,C2 5′-GGACAAAAGCAAGGCTAAGAA-3′。反应体系为50μL,含有10×Pyrobest Buffer,5 μL;Pyrobest DNA Polymerase,0.25μL;dNTP,4 μL;基因组 DNA、C1、C2各1μL;ddH2O,37.75 μL。94℃,5min;94℃,40s,55℃,50s,72℃,
1min,32个循环;72℃,8min;4℃保存。将PCR产物进行1%的琼脂糖凝胶电泳。
1.2.4 DNA片段纯化 按照试剂盒说明进行纯化。将DNA回收溶液送北京诺赛公司测序。
1.2.5kdr基因AS-PCR扩增 以淡色库蚊基因组DNA为模板,设计5种引物(C1,C2,C3,C4,C5)对此进行扩增。引物序列为C1、C2,C3 5′CCACCGTAGTGATAGGAAATTTA 3′,C45′ACGCTGG AATACTCACG ACTG 3′,C5 5′ACGCTGGAA TACTCACGACA 3′。反应体系含有10×Pyrobest Buffer,5μL;dNTP,4μL;基因组DNA,2 μL;C1,0.5μL;C2,0.5μL;C3,1μL;Pyrobest DNA Polymerase,0.25μL;ddH2O,35.75μL;a管中加入C4,1μL;b管中加入C4,1μL,共50μL。94℃,5min;94℃,1min,55℃,2min,72℃,2 min,40个循环;72℃,10min;4℃保存。将PCR产物进行1%的琼脂糖凝胶电泳。
2 结 果
2.1 WHO成蚊接触筒法 WHO抗药性评价指标死亡率98%~100%为敏感群体(S)死亡率80%~97%为初步抗性群体(M)死亡率80%~以下为抗性群体(R)。
2.2 单蚊基因组DNA提取 将济南、济宁、青岛的野生及敏感种群的受试淡色库蚊分为敏感组(死亡)和抗性组(存活),共418只,提取单蚊基因组DNA,1%的琼脂糖凝胶电泳中在相应的位置跑出条带,见图1。
2.3kdr基因扩增、测序 以上述济南、济宁、青岛的野生及敏感种群的受试淡色库蚊单蚊基因组DNA为模板,以C1、C2为引物进行PCR,扩增kdr基因片段,得到与预期大小(521bp)一致的基因片段,见图2。
测序结果见图3,不同地区淡色库蚊成虫6种kdr基因型、等位基因频率与抗药性表型的关系如下表2。
2.4kdr基因AS-PCR扩增 见图3。
济南、济宁、青岛和敏感的4个种群Kdr基因L1014F等位基因频率分别为42.92%、61.27%、29.52%、18.09%,济南、济宁、青岛和敏感的4个种群成蚊接触筒的存活率分别为60.38%、62.75%、16.19%、1.90%,以Kdr基因L1014F等位基因频率为x,以成蚊接触筒的存活率为y,建立回归方程为y=1.536935x-23.0217,R2=0.853049,P<0.05。



济南,济宁,青岛和敏感的4个种群Kdr基因L1014S因频率分别为19.81%、21.57%、5.24%、0%,济南、济宁、青岛和敏感的4个群成蚊接触筒的存活率分别为60.38%、62.75%、16.19%、1.90%,以Kdr基因L1014S等部位频率为x,以成蚊接触筒的存活率为y,建立回归方程为y=2.892202x+1.596388,R2=0.998554,P<0.05。


表1 不同地区淡色库蚊成虫对溴氰菊酯的抗药性Tab.1 The bioassay result of deltamethrin resistance in Culex pipiens pallens
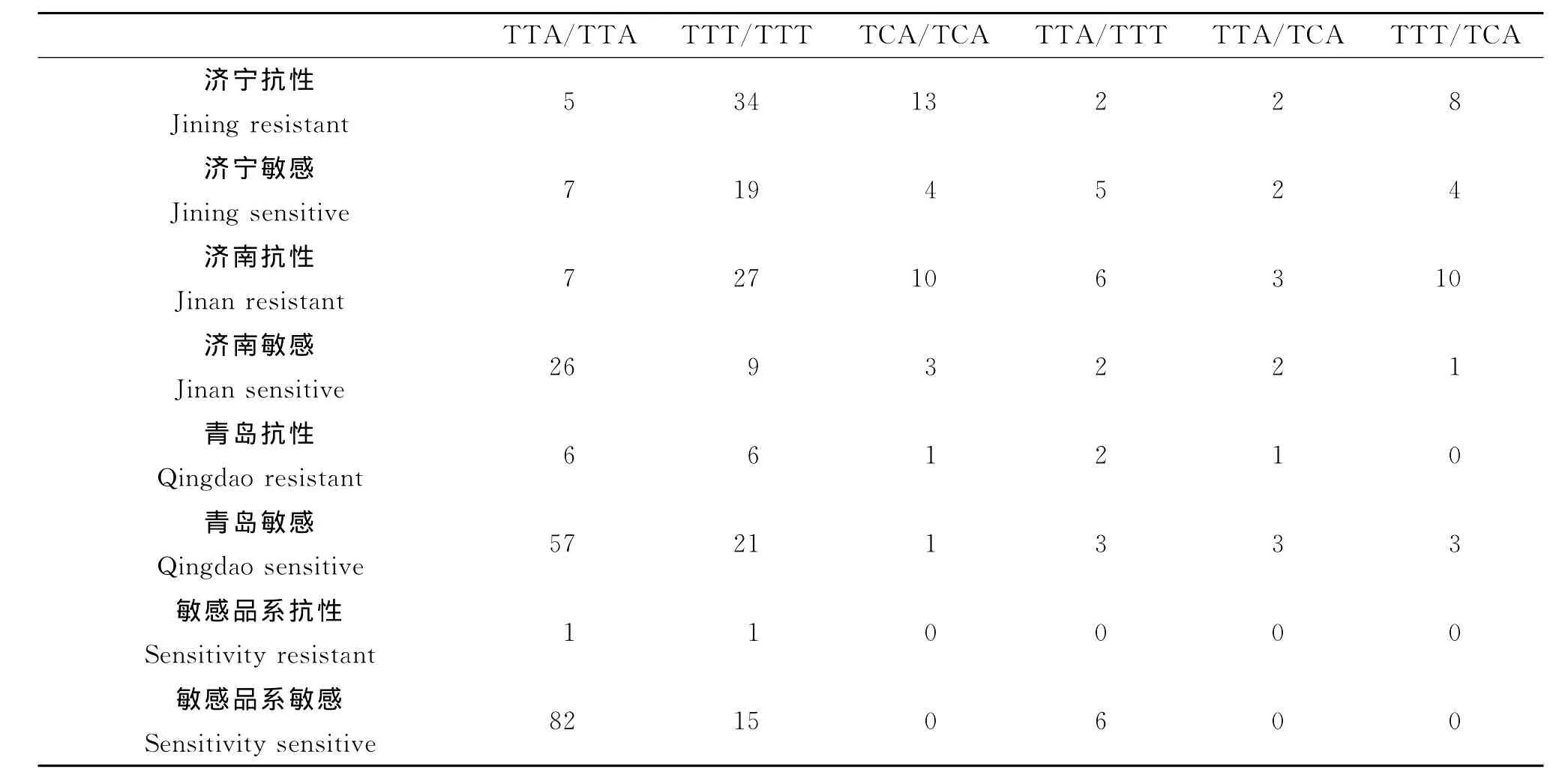
表2 不同地区淡色库蚊成虫6种kdr基因型、等位基因频率与抗药性表型的关系表(基因测序)Tab.2 kdr genotype and allele frequency in relationship to phenotypes determined by the deltamethrin resistance bioassay in Culex pipiens pallens populations in different regions
用基因测序的方法检测淡色库蚊Kdr基因发现,L1014F等位基因频率和L1014S等位基因频率与抗性水平呈正相关
2.5 2种检测方法分析 我们选择从济宁采集的淡色库蚊进行AS-PCR的检验。其中C1、C2是外引物,扩增521bp的等位基因片段,C3和C4、C5是特异性内引物,用以扩增389bp(等位基因TTA)的等位基因和176bp(等位基因TTT和TCA)的等位基因。经过3次重复实验,在102份样品中,我们获得了64(62.75%)份样品的结果。将 RT-PCR和AS-PCR 的 结 果 进 行 卡 方 检 验,结 果:χ2=11.830850,P=0.000583,P<0.05,RT-PCR的阳性检出率高于AS-PCR,因此RT-PCR这种检测方法更有效。
3 讨 论
蚊虫的对拟除虫菊酯类杀虫剂的击倒抗性(knockdownresistance,kdr)又称为靶标抗性(targetsiteresistance),是由于神经细胞膜para型钠离子通道靶标位点的点突变造成的[5]。在科特迪瓦地区6个冈比亚按蚊自然种群中发现了钠通道ⅡS6节段1014位点的L1014F型突变,即碱基“A”突变为“T”;在喀麦隆地区的冈比亚按蚊的研究中也证实kdr基因L1014F突变与抗溴氰菊酯表型呈正相关[2]。chen等[6]对南京等地的淡色库蚊的para型钠离子通道进行测序,也发现了L1014F型突变,并与拟除虫菊酯抗药性表型密切相关,与本文得出的结论一致。但在Abdalla等[7]对苏丹地区的14只自然种群的阿拉伯按蚊的研究中未发现kdr基因L1014F突变与拟除虫菊酯类杀虫剂抗药性表型有相关性。然而研究人员认为[8],该研究的样本量不足50只,所以样本量过少,不足以体现基因突变与抗药性表型间的关系。本实验所研究的济南、济宁、青岛的野生及敏感种群的受试淡色库蚊样本量分别为64、51、74、105只,保证了实验的准确性。
Kawada等[4]在冈比亚按蚊幼虫和阿拉伯按蚊幼虫发现了L1014S型突变,Om P Singh等[9]对阿尔瓦地区的斯式按蚊进行研究,首次在斯式按蚊中验证了该型突变。在对RSP-ST抗性品系的冈比亚按蚊研究中发现kdr基因突变型L1014S/L1014S(RR)纯合子在氯氰菊酯抗药性组群中的比例明显增高,被认为与氯氰菊酯抗性表型正相关[10]。很多报道证实了L1014S的突变的发生于其抗药性相关。这与本实验结果即kdr基因L1014S突变与溴氰菊酯抗药性表型呈高相关性(R2=0.998554)一致。然而在Chen等[6]的研究中认为淡色库蚊L1014S突变与拟除虫菊酯类杀虫剂抗药性无明显相关性,可能与她的研究中L1014S/L1014S(RR)纯合子总个数为1,使L1014S突变所引起的抗药性被忽略有关。本实验检测出的L1014S/L1014S(RR)纯合子总个数为8,含有L1014S等位基因的蚊虫个数为14,确保了实验有更高的可信性。
在AS-PCR检测方法使用2个平行的PCR反应体系鉴定同某1个体基因型,只在389bp处出现条带,则该样本为野生纯合基因型TTA/TTA(SS);如是突变纯合子(RR)则只在176bp处只出现一条带,若出现两条带为杂合子(RS),可直观的看出每个样品的基因型。这种技术简单,经济,省去了纯化、测序、序列对比等步骤,广泛应用于各种蚊虫的抗药性研究的大规模现场检测中,比如中华按蚊、冈比亚按蚊等。但是AS-PCR方法常发生非特异性延伸或者引物二聚体条带,影响了研究的阳性检测率和准确性,因此,在进行kdr等位基因频率与不同自然种群抗药性水平的研究中,RT-PCR优于AS-PCR。
[1]Gemperli A,Sogoba N,Fondjo E,et al.Mapping malaria transmission in West and Central Africa[J].Trop Med Int Health,2006,11(7):1032-1146.DOI:10.1111/j.1365-3156.2006.01640.x
[2]Philippe N,Josiane E,Mouhamadou C,et al.Kdr-based insecticide resistance inAnophelesgambiaes.s populations in[J].BMC Res Notes,2011,4(1):463.DOI:10.1186/1756-0500-4-463
[3]Martinez-Torres D,Foster SP,Field LM,et al.A sodium channel point mutation is associated with resistance to DDT and pyrethroid insecticides in the peach-potato aphid,Myzus persicae(Sulzer)(Hemiptera:Aphididae)[J].Insect Mol Biol,1999,8(3):339-346.DOI:10.1046/j.1365-2583.1999.83121.x
[4]Kawada H,Futami K,Komagata O,et al.Distribution of a knockdown resistance mutation(L1014S)inAnophelesgambiaes.s.andAnophelesarabiensisin Western and Southern Kenya[J].PLoS One,2011,6(9):e24323.DOI:10.1371/journal.pone.0024323
[5]Bass C,Schroeder I,Turberg A,et al.Identification of mutations associated with pyrethroid resistance in the para-type sodium channel of the cat flea,Ctenocephalidesfelis[J].Insect Biochem Mol Biol,2004,34(12):1305-1313.DOI:10.1016/j.ibmb.2004.09.002
[6]Chen L,Zhong D,Zhang D,et al.Molecular ecology of pyrethroid knockdown resistance inCulexpipienspallensmosquitoes[J].PLoS One,2010,21(7):e11681.DOI:10.1371/journal.pone.0011681
[7]Abdalla H,Matambo TS,Koekemoer LL,et al.Insecticide susceptibility and vector status of natural populations ofAnopheles arabiensisfrom Sudan[J].Trans R Soc Trop Med Hyg,2008,102(3):263-271.DOI:10.1016/j.trstmh.2007.10.008
[8]Gordon D,Levenstien MA,Finch SJ,et al.Errors and linkage disequilibrium interact multiplicatively when computing sample sizes for genetic case-control association studies[J].Pac Symp Biocomput,2003:490-501.
[9]Singh OP,Dykes CL,Lather M,et al.Knockdown resistance(kdr)-like mutations in the voltage-gated sodium channel of a malaria vectoAnophelesstephensiand PCR assays for their detection[J].Malar J,2011,10:59.DOI:10.1186/1475-2875-10-59
[10]Ranson H,Jensen B,Vulule JM,et al.Identification of a point mutation in the voltage-gated sodium channel gene of KenyanAnophelesgambiaeassociated with resistance to DDT and pyrethroids[J].Insect Mol Biol,2000,9(5):491-497.DOI:10.1046/j.1365-2583.2000.00209.x
