人sapovirus研究进展
2012-01-24刘淑华杨宗照
刘淑华,杨宗照,谢 正
Sapovirus(SaV)即札幌病毒,又名札如病毒、沙波病毒,属于杯状病毒科(Caliciviridae),为单股正链RNA病毒,基因组全长7-8kb,带有多聚A尾,没有囊膜,病毒直径27-35nm。SaV与人和动物的胃肠炎有关,不同年龄人群都可感染,以婴幼儿最易感,能够引起人(尤其是儿童和老人)的腹泻,主要经粪—口传播。SaV原型毒株于1977年发现于日本Sapporo(札幌)的一个孤儿院。近年来,在一些地方SaV逐渐成为仅次于诺如病毒(NoV),排列第二的腹泻病主要病因[1]。
1 基 因
测出的第一个SaV基因组是 Hu/Manchester/93/UK,它属于GII型。SaV包含有2个主要的开放阅读框(ORF)。ORF1编码一个多聚蛋白,经过蛋白酶处理后分解为几个非结构蛋白和一个衣壳蛋白 (capsid,VP1)。ORF2 编 码 一 个 碱 性 蛋 白(VP2),它是非结构蛋白。GI、GIV、GV型SaV还含有一个较小的ORF3,编码一个碱性蛋白。
由于人的SaV不能进行细胞培养,因此不能使用中和试验对SaV进行分型,比较普遍接受的分型方法是对衣壳蛋白全基因的序列分析。SaV被分为 GI.1-5,GII.1-6,GIV.1和 GV.1,即4个主型,13个亚型[2-3]。
2 SaV的流行病学
SaV可以感染人、猪、貂、蛤、牡蛎等,感染人的主要为GI、GII、GIV和GV型,感染猪的主要为GⅢ型以及少量其它类型,如GVI、VII型。
已经有报道发生SaV的国家有匈牙利、意大利、美国、日本、韩国、中国、丹麦、芬兰、匈牙利、意大利、斯洛文尼亚、西班牙、爱尔兰、巴西等。SaV在我国安徽、广州、南京、南宁等地腹泻病例中均存在该病毒,检出的基因型有GI、II型,尚未有GIV、V型的报道。同一地区不同年份可能以不同的基因型为主[4]。日本6年的检测结果显示2003-2004年GI.1为主,此后2004-2005年 GI.6为主,2005-2007又以GI.1为主,2007-2008以 GIV为主,2008-2009以GI为主。有时也会检测到多种的基因型,如Pang[5]对2004-2007年加拿大Alberta地区爆发的胃肠炎病例检测,GI、GII、GIV、GV均有发生。
SaV可以从病人粪便、环境样本(如废水)、水产(蛤)、食品等中检出[6]。如 Hansman年从河水中检出GI、GV型SaV。蛤、废水中检测出的SaV与儿童腹泻病例的SaV基因序列同源性非常高,提示可能存在食源性传播。
发病季节方面,资料还比较少,以寒冷季节相对较多。日本流行季节为4-6月或10-12月[7]。Christina对丹麦的检测没发现有明显的季节性。Dey[8]对孟加拉国2004-2005年的婴幼儿急性胃肠炎病例监测发现发病以秋、冬季居多。
SaV常感染儿童,但也会导致成人发病。Wu[9]报道台湾北部大学生发生SaV感染的报道。Mikula也报道了成人发病的例子。Pang[5]报道病例中发病年龄以老人(>65岁)和儿童(<6岁)为主。SaV在病人体内的排毒期通常为2w,但少数在发病后2~4w仍然排毒[10]。
不同的人群中该病的检出率,除去SaV引起的爆发病例外,一般情况下少的只有0.5%,多的为10%~20%。Liu[11]对北京2007年7月至2008年6月腹泻样本557份的检测,检出率仅占0.5%。Chang[12]对2006-2007年福建、安徽等9省1 110份样本检测,10份(0.9%)为SaV 阳性,G I.1,G I.3,G II.3型均有。Nakanishi对腹泻病例的检测以轮状病毒为主,其次是NoV、腺病毒,SaV只占了1.7%[13],Chan-it[14]对 662 份 胃 肠 炎 儿 童 检 测SaV阳性20例(3%),其中15例为G为GI.1,其次为GII.1、GI.3。Svraka[15]对芬兰2007-2009年的检测表明478次急性胃肠炎检测,SaV引起的有19次(4%),主要为GI.2,发病年龄多为60岁以上的老人。
对于儿童的检测结果中,轮状病毒NoV、sapo-virus、腺病毒、星状病毒是常见的几种病毒性腹泻的病原,如Lyman[16]对29次幼儿园急性腹泻的检测,其中13次(45%)为病毒性腹泻,其中轮状病毒、NoV、星状病毒、SaV 分别为17%、10%、10%、7%的阳性率。Christina对丹麦0-3岁腹泻儿童检测SaV,97例(9%)为阳性,7-18个月龄相对高发,G1.1占阳性病例的一半。Rachakonda[17]对儿童肠胃炎病例226份的检测结果表明23份(10.2%)为SaV阳性,22份为 GI,1份为 GII。Phan[7]检测日本1154份2003-2005年腹泻婴儿和儿童,469份为腹泻病毒阳性,其中SaV阳性49份(10.44%)。测序表明GI(GI.1、GI.4、GI.6和GI.8)型为主,GI.6是2004-2005年的主型。
在某些地区SaV是病毒性腹泻的主要病因。Pang[5]对2004-2007年加拿大 Alberta地区爆发的胃肠炎病例检测,SaV占17.6%(43/244)。
3 症状与致病性
一般而言婴儿、儿童、成人感染后主要引起腹泻,症状比NoV轻一点。但是也有引起严重病例的报道。在日本Sapporo孤儿院,暴发的36例传染性胃肠炎病例,单独由SaV、NoV、轮状病毒引起的各有6、8、10例,由NoV和SaV混合引起的1例,腺病毒和星状病毒各占3例和2例,Sav成为引起腹泻的主要病原之一[18]。
Johansson[19]报道23名成年人感染SaV的症状情形。平均年龄52岁,恶心腹泻、呕吐、腹部痉挛、头痛、肌肉痛、发烧等症状。发生腹泻占72%,呕吐占56%,症状持续时间为6d。
Usuku[20]对日本初中生一次学习旅行后发生胃肠炎病例检查43份样本,未检出NoV和常见的食源性细菌(沙门氏菌、志贺氏菌、弯曲杆菌),而检出了33份SaV(GIV)型,说明SaV可以引起胃肠炎疾病暴发。该文对症状统计数据见表1。
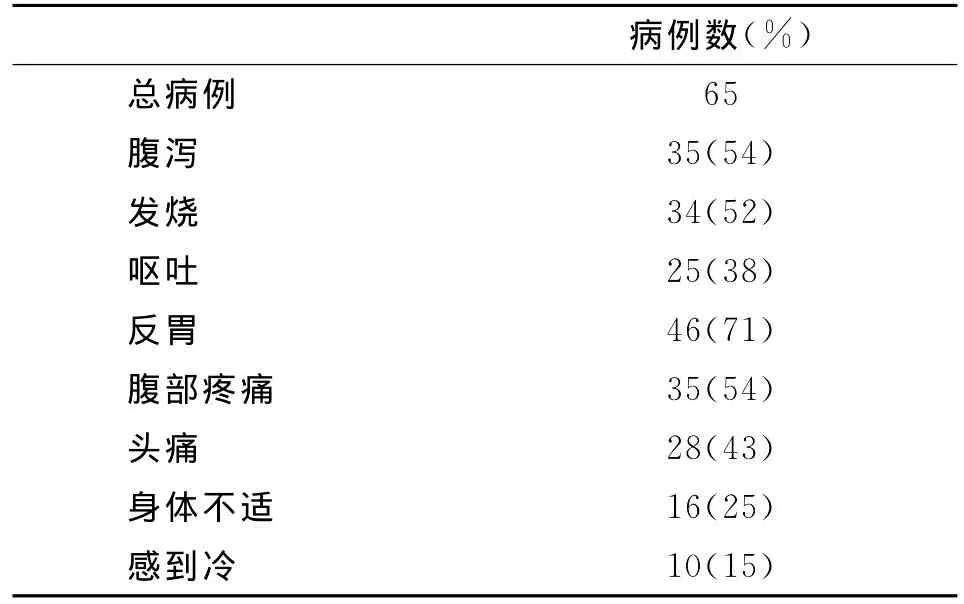
表1 SaV感染引起的疾病症状
Hansman[21]检测了日本2006年2-3月幼儿园发生1名成年人和66名儿童(61.7%)和呕吐、腹泻,经检查为SaV GI感染,此次没有检出轮状病毒和NoV,说明SaV能够引起较为严重的疾病流行。
2007年5月台湾北部55名大学生有胃肠炎症状:腹泻、呕吐、肚子绞痛、发烧。症状持续10d(平均4.7d),抽检8份样本,未检出细菌、轮状病毒、NoV,电镜观察到杯状病毒样粒子。使用针对SaV衣壳蛋白的引物SV-F11、SV-R1检测到7个样本为阳性,荧光定量显示每克粪便中的病毒cDNA拷贝数为0.286-172×108[22]。
据Wu报道SaV也引起呕吐、腹泻、肚子疼、发烧、脱水,持续12~60h[23]。
4 诊 断
实验室主要的诊断方法有针对病毒病原、病毒RNA和抗体等检测方法。电镜和抗原ELISA可以检测完整的病毒粒子和病毒抗原。RT-PCR检测病毒RNA,检测人SaV的荧光定量RT-PCR方法已经建立。重组的VLP被用来建立检测抗体的ELISA方法。
4.1 电镜(EM) 人的原型毒株Sapporo病毒首次发现是用电镜。不过EM不很敏感,只能检测到106/mL以上的病毒粒子。免疫电镜可以增加敏感度(10倍以上),它的特异性取决于抗血清的质量。EM的缺点是需要熟练的操作人员、仪器昂贵、比较费时间,因此不适合大样本的检测。
4.2 RT-PCR 该方法最常用,不过 RT-PCR的影响因素较多,包括样品的质量、RNA提取的方法、引物特异性、RT-PCR参数、检测扩增产物的方法。巢式RT-PCR能提高敏感度10~1 000倍,但是也增加了交叉污染的风险。荧光定量RT-PCR增加了检测的敏感度,而且检测速度更快。
4.2.1 RNA的提取 提取时要考虑RNA的回收能力和去除RNA抑制剂的能力。常用的有酚-氯仿、Trizol、磁珠等方法提取。
4.2.2 引物的设计 一般有两种策略:(1)使用针对检测人的SaV的引物,不扩增其它动物的SaV,目前以这种方法的应用逐渐增多,大多数引物设计在相对保守的RdRp与衣壳蛋白连接区。但是即使是该区域的基因序列也有很大差异,因此常常需要设计较多的引物或设计兼并引物。(2)检测杯状病毒的通用引物是p290、p289,它们针对的保守区是RdRp区域的DYSKWDST、YGDD,这对引物通用性高但敏感度低,它能够扩增人的SaV、NoV,甚至轮状病毒。因此,这对引物的扩增结果需要测序以确定其特异性。
Okada[24]设计了针对人SaV GI、GII、GIV、GV型的RT-PCR,通过检测临床样本,发现195份阳性,其中GI、GII、GIV和 GV分别有106、79、3和7份。GI和GII在样本收集的8年内一致存在,另两种出现的较晚。该方法是实验室检测SaV的较好的一种方法,它不但能够检测到各种基因型SaV,还能通过电泳区分,实际应用价值较大。

表2 检测SaV的通用引物
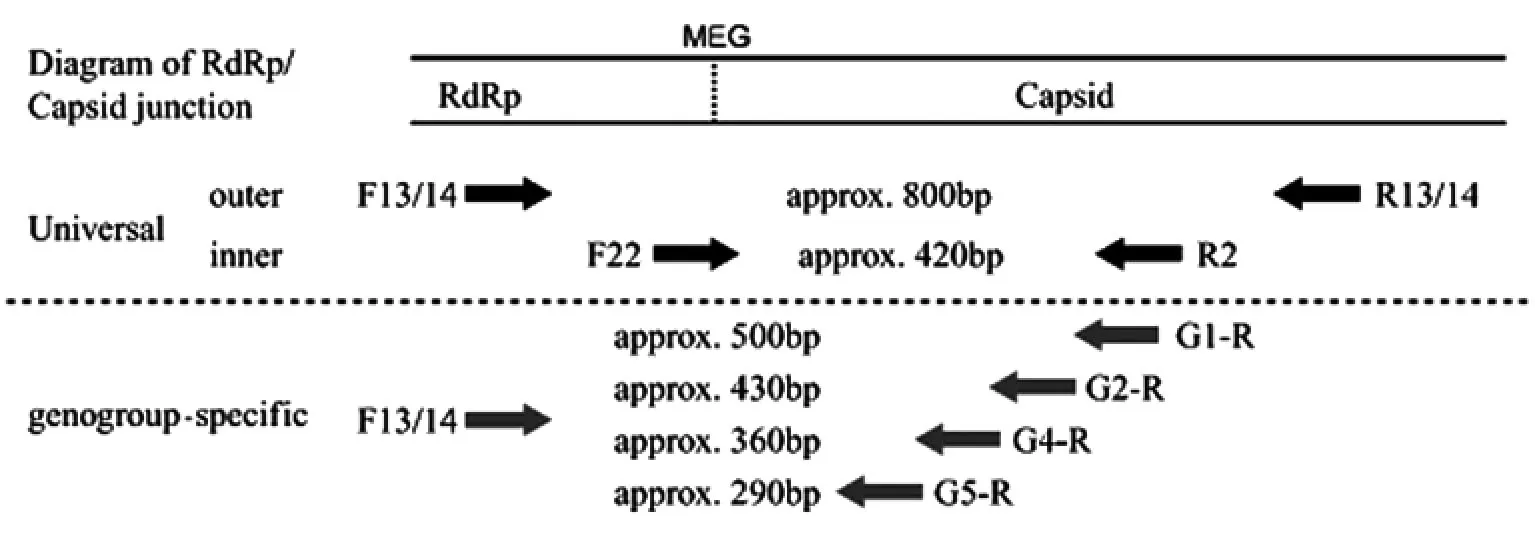
图1 针对SaV型与亚型的RT-PCR引物的位置
Yan[25]针对引起腹泻有多种病毒,设计了同时检测 NoV(GI、GII)、SaV、星状病毒的 RT-PCR方法,其中 SaV 引物 序 列 为 SLV5317 5′-CTCGCCACCTACRAWGCBTGGTT-3′、SLV5749 5′-CGGRCYTCAAAVSTACCBCCCCA-3′。该方法的优点是可以同时检出多种病原,比较节省劳动强度。不足是由于该方法设计的较早,主要是根据GI型SaV(Manchester/93、Sapporo/82、Houston/86)设计的,因此可能不能完全检出所有类型的SaV。4.2.3 荧光定量 RT-PCR 与常规的 RT-PCR相比,荧光定量方法省去了电泳、杂交步骤,要快速、敏感,并且可以定量。
Oka[26]设计了检测SaV的荧光定量方法,包含3条正向引物,2条MGBNFQ探针,1条反向引物,引物位置在多聚酶和衣壳蛋白的结合处,该方法的敏感度为每管25个拷贝。临床试验证实该方法可以检出了SaV GI、II、IV、V型,具有较好的敏感度和特异性,不与星状病毒、腺病毒反应。
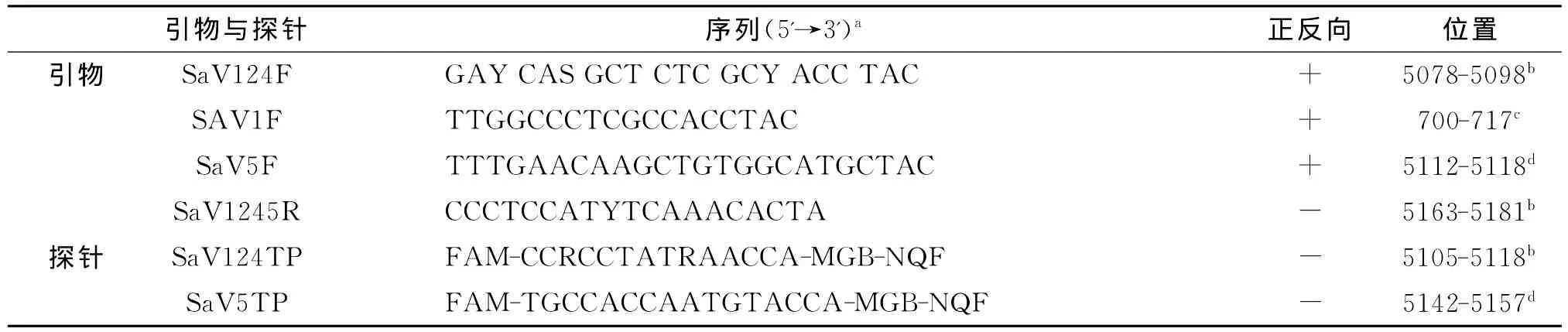
表3 检测SaV荧光定量RT-PCR的引物与探针
Chan[27]设计了的引物探针稍简洁一些,有2条正向引物,1条MGBNFQ探针,1条反向引物来检测所有类型的人SaV,其位置也是在SaV和衣壳蛋白连接处。通过临床应用,证实该方法可以检出了SaV GI、GII、GIV型,最低为10个拷贝/反应,不与轮状病毒和NoV反应。
Logan[28]设计了实时 RT-PCR 方法同时检测NoV、SaV和星状病毒,但不是在同一管检测,而是每种病分开检测,检测SaV的探针针对GI、II、IV型,而且使用使用FAM单一染料标记,因此对于测到的阳性样本不能区分是哪种基因型。
van Maarseveen[29]针对当前导致腹泻的病原较多这一问题,设计了同时检测F群腺病毒、星状病毒、轮状病毒A群、NoV(GI、GII)和SaV的荧光定量方法。该方法敏感,提高了检出率,但同样该法设计的SaV引物是根据GI型序列(Mc114)设计的,可能不能完全检出所有类型的SaV。
采用RT-PCR方法需要注意使用RT-PCR方法或者荧光定量方法检出粪便中的排毒期在发生症状后14d绝大多数都转为阴性,极个别仍可检出。一些样本需要稀释以消除抑制性成分再扩增。在对水中SaV检测时需要先过滤、离心等方法浓缩后再提取 RNA[30]。
4.3 免疫学方法 使用提纯的病毒或杆状病毒表达系统产生的病毒样粒子产生的高免血清建立的抗原ELISA可以检测病毒粒子或抗体,特异性比较高,但是由于SaV的变异度比较高,因此不能检测所有的基因型SaV,限制了其应用。
5 消毒措施
专门针对SaV有效的消毒技术还未见报道,因此只能采用常规卫生和消毒措施。由于它属于杯状病毒,暂时可以参考针对其它杯状病毒(如NoV)的研究报道。杯状病毒抵抗力较强,在环境中可以保持数周,加热和10×10-12的氯化物可以用作水质消毒。紫外线或γ射线可以灭活,乙醇、高温等也有降低病毒滴度的作用。
6 总 结
尽管SaV已经发现30多年了,由于SaV暂时还不能使用合适的细胞培养,对于研究SaV非常不便。在国外一些地方,此病成为腹泻疾病爆发的主要原因,但有时感染也不表现临床症状,尤其对于青年人往往没有症状。目前国内许多医院还没有对此病进行检查,许多地方病人的感染情况、流行情况尚不十分清楚,还没有疫苗可用,还缺乏针对SaV明确有效的消毒技术,这些不利因素给该病的检测、预防与控制带来较大难度。由于一些猪SaV与人的SaV抗原性和基因同源性较高引起了人们的关注。
[1]Harada S,Okada M,Yahiro S,et al.Surveillance of pathogens in outpatients with gastroenteritis and characterization of sapovirus strains between 2002and 2007in Kumamoto Prefecture,Japan[J].J Med Virol,2009,81(6):1117-1127.
[2]Hansman GS,Oka T,Katayama K,et al.Human sapoviruses:genetic diversity,recombination,and classification[J].Rev Med Virol,2007,17(2):133-141.
[3]Iwai M,Hasegawa S,Obara M,et al.Continuous presence of noroviruses and sapoviruses in raw sewage reflects infections among inhabitants of Toyama,Japan(2006to 2008)[J].Appl Environ Microbiol,2009,75(5):1264-1270.
[4]Chanit W,Thongprachum A,Khamrin P,et al.Intergenogroup recombinant sapovirus in Japan,2007-2008[J].Emerg Infect Dis,2009,15(7):1084-1087.
[5]Pang XL,Lee BE,Tyrrell GJ,et al.Epidemiology and genotype analysis of sapovirus associated with gastroenteritis outbreaks in Alberta,Canada:2004-2007[J].J Infect Dis,2009,199(4):547-551.
[6]Kitajima M,Oka T,Haramoto E,et al.Detection and genetic analysis of human sapoviruses in river water in Japan[J].Appl Environ Microbiol,2010,76(8):2461-2467.
[7]Phan TG,Trinh QD,Yagyu F,et al.Emergence of rare sapovirus genotype among infants and children with acute gastroenteritis in Japan[J].Eur J Clin Microbiol Infect Dis,2007,26(1):21-27.
[8]Dey SK,Phan TG,Nguyen TA,et al.Prevalence of sapovirus infection among infants and children with acute gastroenteritis in Dhaka City,Bangladesh during 2004-2005[J].J Med Virol,2007,79(5):633-638.
[9]Wu FT,Oka T,Takeda N,et al.Acute gastroenteritis caused by GI/2sapovirus,Taiwan,2007[J].Emerg Infect Dis,2008,14(7):1169-1171.
[10]Iwakiri A,Ganmyo H,Yamamoto S,et al.Quantitative analysis of fecal sapovirus shedding:identification of nucleotide substitutions in the capsid protein during prolonged excretion[J].Arch Virol,2009,154(4):689-693.
[11]Liu LJ,Liu W,Liu YX,et al.Identification of norovirus as the top enteric viruses detected in adult cases with acute gastroenteritis[J].Am J Trop Med Hyg,2010,82(4):717-722.
[12]Chang ZR,Jin M,Liu N,et al.Analysis of epidemiologic feature and genetic sequence of Sapovirus in China[J].Bing Du Xue Bao,2009,25(2):113-116.
[13]Nakanishi K,Tsugawa T,Honma S,et al.Detection of enteric viruses in rectal swabs from children with acute gastroenteritis attending the pediatric outpatient clinics in Sapporo,Japan[J].J Clin Virol,2009,46(1):94-97.
[14]Chan-it W,Thongprachum A,Okitsu S,et al.Epidemiology and molecular characterization of sapovirus and astrovirus in Japan,2008-2009[J].Jpn J Infect Dis,2010,63(4):302-303.
[15]Svraka S,Vennema H,van der Veer B,et al.Epidemiology and genotype analysis of emerging sapovirus-associated infections across Europe[J].J Clin Microbiol,2010,48(6):2191-2198.
[16]Lyman WH,Walsh JF,Kotch JB,et al.Prospective study of etiologic agents of acute gastroenteritis outbreaks in child care centers[J].J Pediatr,2009,154(2):253-257.
[17]Rachakonda G,Choudekar A,Parveen S,et al.Genetic diversity of noroviruses and sapoviruses in children with acute spo-radic gastroenteritis in New Delhi,India[J].J Clin Virol,2008,43(1):42-48.
[18]Chiba S,Nakata S,Numata-Kinoshita K,et al.Sapporo virus:history and recent findings[J].J Infect Dis,2000,181(S 2):303-308.
[19]Johansson PJ,Bergentoft K,Larsson PA,et al.A nosocomial sapovirus-associated outbreak of gastroenteritis in adults[J].Scand J Infect Dis,2005,37(3):200-204.
[20]Usuku S,Kumazaki M,Kitamura K,et al.An outbreak of food-borne gastroenteritis due to sapovirus among junior high school students[J].Jpn J Infect Dis,2008,61(6):438-441.
[21]Hansman GS,Saito H,Shibata C,et al.Outbreak of gastroenteritis due to sapovirus[J].J Clin Microbiol,2007,45(4):1347-1349.
[22]Wu FT,Oka T,Takeda N,et al.Acute gastroenteritis caused by GI/2sapovirus,Taiwan,2007[J].Emerg Infect Dis,2008,14(7):1169-1171.
[23]Xavier MP,Oliveira SA,Ferreira MS,et al.Detection of caliciviruses associated with acute infantile gastroenteritis in Salvador,an urban center in Northeast Brazil[J].Braz J Med Biol Res,2009,42(5):438-444.
[24]Okada M,Yamashita Y,Oseto M,et al.The detection of human sapoviruses with universal and genogroup-specific primers[J].Arch Virol,2006,151(12):2503-2509.
[25]Yan H,Yagyu F,Okitsu S,et al.Detection of norovirus(GI,GII),Sapovirus and astrovirus in fecal samples using reverse transcription single-round multiplex PCR[J].J Virol Methods,2003,114(1):37-44.
[26]Oka T,Katayama K,Hansman GS,et al.Detection of human sapovirus by real-time reverse transcription-polymerase chain reaction[J].J Med Virol,2006,78(10):1347-1353.
[27]Chan MC,Sung JJ,Lam RK,et al.Sapovirus detection by quantitative real-time RT-PCR in clinical stool specimens[J].J Virol Methods,2006,134(1-2):146-153.
[28]Logan C,O’Leary JJ,O’Sullivan N.Real-time reverse transcription PCR detection of norovirus,sapovirus and astrovirus as causative agents of acute viral gastroenteritis[J].J Virol Methods,2007,146(1-2):36-44.
[29]van Maarseveen NM,Wessels E,de Brouwer CS,et al.Diagnosis of viral gastroenteritis by simultaneous detection of Adenovirus group F,Astrovirus,Rotavirus group A,Norovirus genogroups I and II,and Sapovirus in two internally controlled multiplex real-time PCR assays[J].J Clin Virol,2010,49(3):205-210.
[30]Iwakiri A,Ganmyo H,Yamamoto S,et al.Quantitative analysis of fecal sapovirus shedding:identification of nucleotide substitutions in the capsid protein during prolonged excretion[J].Arch Virol,2009,54(4):689-693.
