2株乙型脑炎病毒的E基因的克隆与序列分析*
2012-01-24黄小波王伟杰文心田曹三杰
黄小波,袁 磊,王伟杰,贾 静,文心田,3,曹三杰
流行性乙型脑炎是由黄病毒科乙型脑炎病毒(Japanese encephalitis viruses.JEV)引起的蚊媒性人兽共患病,能够引起人类严重的中枢神经系统病变[1]。乙型脑炎主要流行于亚洲及太平洋地区,有明显季节性,一般蚊虫孳生的7-9月是其发病高峰期。目前已有24个国家和地区有乙脑流行的报道,我国除新疆和青海省外,其他各省均有局部暴发或流行的报道[2]。四川省为全国乙脑高发地区,近年来发病率在2/10万-10/10万之间,疫情在全国排名靠前。四川省乙脑高发区主要分布在成都平原及川东地区,如巴中、达州、广安、南充、遂宁以及内江等地[3]。1957年四川首次分离出基因Ⅲ型乙脑病毒(CH-13株),2002年汤德元等在四川内江地区分离得到1株基因Ⅲ型乙脑病毒[4],随后在2004年,王环宇等从四川巴中地区采集的蚊虫标本中首次分离得到6株基因Ⅰ型乙脑病毒[5]。
“5.12”地震后,降雨量的增多,导使蚊虫的大量滋生,增加了乙脑传染的几率,再加上环境的剧烈变化可能会导致病毒的变异,因此做好乙脑的防控工作显得尤为重要。本次研究对2009年分离自四川地区的2株JEV的E基因核酸序列、E基因推导氨基酸序列、E蛋白结构域突变情况与基因型进行分析研究,了解分离株的部分分子生物学特征,为四川地区流行性乙型脑炎病毒的分子生物学研究与DNA疫苗的研制提供重要依据。
1 材料与方法
1.1 病毒株 JEV-CZ1株与JEV-NJ1株分别为本实验室从采集自四川崇州地区猪场库蚊样品与四川内江地区猪流产死胎脑组织中分离获得,由本实验室鉴定并保存。
1.2 菌种及主要试剂 大肠杆菌DH5α由本实验室保存;PrimeScript RT reagent Kit反转录试剂盒、pMD19-T Simple Vector载体购自大连宝生物工程有限公司;TRNzol总RNA提取试剂盒、质粒小提试剂盒;Taq DNA聚合酶;DNA MarkerⅢ购自北京天根生化科技有限公司;琼脂糖凝胶DNA回收试剂盒购自Bio Basic公司。
1.3 标本来源与病毒分离 2009年7月28日在四川省崇州市的3个猪场采集的蚊虫标本,按体态特征分类为库蚊、按蚊和伊蚊,每类蚊虫按100只/管分装于冻存管,浸入液氮中保存。同年8月5日在四川内江市的1个猪场采集的流产死胎脑脊液与脑组织,装袋后用锡箔纸包裹,浸入液氮中保存。将采集的样品研磨稀释过滤后接种于金黄色地鼠肾细胞(BHK-21细胞)进行传代培养,获得2株乙型脑炎病毒,分别命名为JEV-CZ1株与JEV-NJ1株。
1.4 病毒E基因的RT-PCR扩增
1.4.1 引物的设计与合成 参考GenBank收录的SA14-14-2、SA14、SC04-12等10株乙型脑炎病毒的E基因序列,利用DNAMAN软件对这10株毒株的E基因进行相似性分析,以SA14-14-2为参照确定其基因组252-2509区段为扩增靶序列。利用Primer 5软件合成了一对引物,下划线为酶切位点:上 游:5’-CCGCTCGAGTTCTTCAAGTTTACAGCATTAGC-3’; 下 游: 5’-CCGGAATTCTTTCTTGTGATGTCAATGGCA-3’。引物由上海英骏生物技术有限公司合成,预计扩增片段为2258bp。
1.4.2 病毒RNA的提取 采用TRNzol总RNA提取试剂盒,按照试剂盒说明书操作提取分离株病毒液的总RNA,于-70℃保存。
1.4.3 病毒cDNA的合成 用PrimeScript RT reagent Kit反转录试剂盒,按照试剂盒说明书操作,采用10μL体系,将病毒液总RNA反转录成cDNA。
1.4.4 E基因的扩增 以上述cDNA为模板,采用25μL PCR反应体系:ddH2O 13μL,10×PCR Buffer 2.5μL,MgCl2(25mmol/L)2μL,dNTPs(2.5mmol/L)3μL,上游与下游引物(10pmol/L)各1μL,cDNA 模板2μL,Taq DNA 聚合酶(2.5 U/μL)0.5μL。反应条件:94 ℃预变性5min;94℃30s,55℃30s,72℃2min(30个循环);72℃补充延伸10min。取5μL PCR产物进行1%琼脂糖凝胶电泳检测,电泳条件:80V,20min。
1.5 病毒E基因的克隆及测序 电泳检测出现预计条带后,用琼脂糖凝胶DNA回收试剂盒回收E基因,将回收产物与pMD19-T Simple Vector载体连接,再将连接产物传化入感受态大肠杆菌细胞DH5α。利用PMD19-T载体的氨苄青霉素抗性筛选出阳性菌落,扩大培养后作菌液PCR鉴定,小提质粒,用XhoⅠ与EcoRⅠ进行双酶切鉴定后送上海英骏生物技术有限公司测序。
1.6 病毒E基因的序列分析
1.6.1 E基因核苷酸序列同源性分析 运用DNAMAN软件将JEV-CZ1株与JEV-NJ1株的E基因核酸序列与GenBank收录的JEV参考毒株的相应序列进行同源性比对。
1.6.2 E基因推导氨基酸序列分析 运用DNAMAN软件推导出分离株E基因编码的氨基酸序列并与GenBank收录的JEV参考毒株的相应序列进行同源性分析。并对分离株E蛋白活性区(E1-E411位)3个结构域的氨基酸差异情况进行了统计分析。
1.6.3 系统发育进化树的构建 采用乙脑病毒E基因分型方法,选择乙脑病毒E基因(基因组977-2476区段),从GenBank中选取各个国家和地区包括各个基因型的34株参考毒株,另选1株墨累谷脑炎病毒(MVE)作为外群,用ClustalX软件进行碱基配对,种系分析运用MEGA4.1软件的Neighbor(邻系接合法)构建系统发育进化树,以确定分离株的基因型别。
2 结 果
2.1 RT-PCR扩增结果 利用RT-PCR方法扩增出病毒E基因,经琼脂糖凝胶电泳后,与DNA MarkerⅢ比较,大小在2 000bp和3 000bp之间,与预期片段大小相符。
2.2 E基因的克隆与鉴定结果 将分离株E基因重组质粒用XhoⅠ和EcoRⅠ进行双酶切,分别得到大小约为2 200bp与2 700bp 2条片段,与目的基因和载体片段大小相符,证明对分离株E基因的克隆成功。
2.3 E基因的同源性分析结果 将JEV-CZ1株与JEV-NJ1株的E基因核酸序列同GenBank上发表的JEV参考毒株的相应序列进行同源性比对,结果表明:JEV-CZ1株核酸序列与SA14-14-2(减毒活疫苗株)、SA-14(中国山西)、SC04-12(中国四川)、SC04-16(中国四川)、HN04-11(中国河南)、HN04-40(中国河南)、VN22(越南)株相应序列的同源性分别为87.6%,87.7%,98.5%,98.9%,98.4%,97.9%,98.9%,JEV-NJ1株核酸序列与上述7株病毒相应序列的同源性分别为99.6%,99.7%,91.1%,91.2%,91.0%,90.8%,91.1%(表1)。
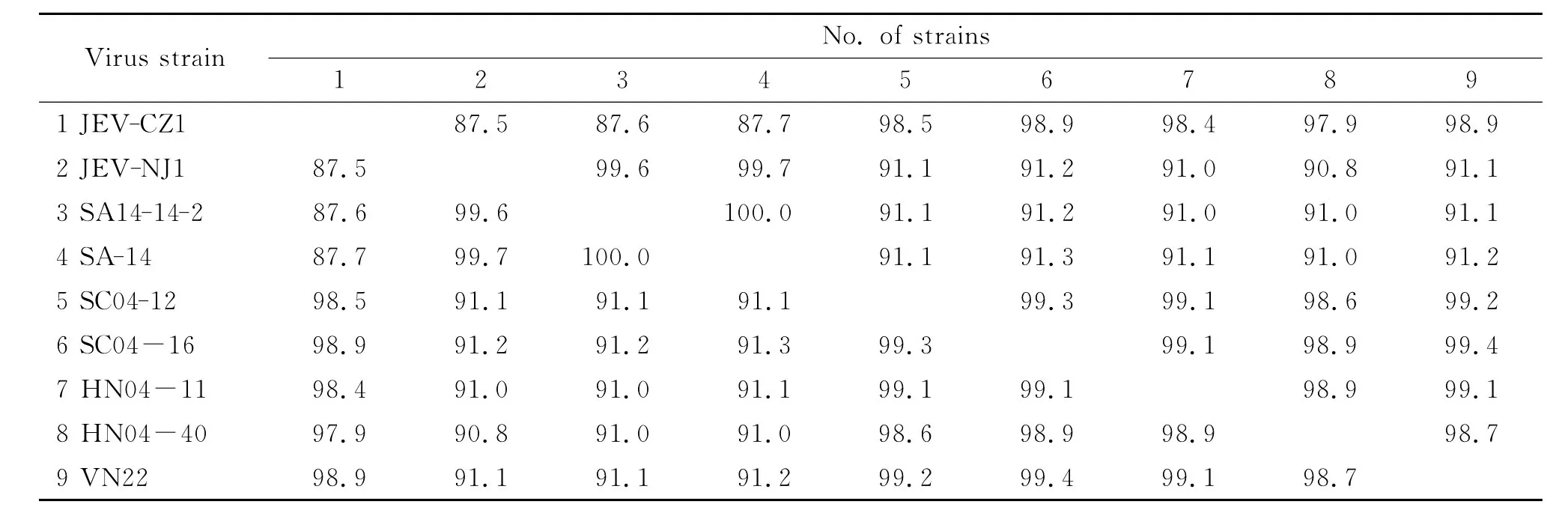
表1 不同毒株E基因核酸同源性比对结果Tab.1 Homology comparison of E gene nucleotide sequences among different strains
2.4 E基因推导氨基酸序列分析结果
2.4.1 氨基酸序列同源性分析结果 JEV-CZ1株E基 因 推 导 的 氨 基 酸 序 列 与 SA14-14-2、SA-14、SC04-12、SC04-16、HN04-11、HN04-40、VN22株相应序列的同源性分别为97.2%,97.3%,99.2%,99.2%,99.1%,98.1%,99.2%。JEV-NJ1株 E基因推导的氨基酸序列与上述7株病毒相应序列的同源 性 分 别 为 99.2%,99.4%,97.5%,97.5%,97.3%,96.4%,97.5%(表2)。
2.4.2 E蛋白活性区氨基酸差异分析 JEV-CZ1株与疫苗株SA14-14-2株在E蛋白3个结构域中(DomainⅠ、Ⅱ、Ⅲ)有15个氨基酸的差异;JEVNJ1株有3处差异(表3)。
2.5 系统发育进化树构建结果 乙型脑炎病毒E基因分型结果显示,所有乙脑病毒分布于5个拓扑结构群,本次研究的JEV-CZ1株属于基因Ⅰ型,并与2004年分离自四川的毒株与越南分离的毒株遗传关系较近,JEV-NJ1属于基因Ⅲ型,与疫苗株SA14-14-2株以及以往四川与上海分离的毒株遗传关系较近(图1)。
3 讨 论
E蛋白是病毒的包膜蛋白,为主要蛋白,有病毒的抗原决定簇。其分子量为53kD,由500个氨基酸残基组成。由E蛋白形成的表面抗原决定簇具有血凝活性和中和活性,能和血凝抑制抗体结合,刺激机体产生中和抗体,保护机体免受病毒攻击,与诱导宿主机体的免疫应答密切相关[6]。JEV-CZ1株与疫苗株SA14-14-2的E基因核酸序列同源性为87.6%,氨基酸序列同源性为97.2%,核酸同源性较低,但该区段的核酸差异一般发生于氨基酸密码子的第3位,即突变的位点多以沉默突变的形式存在;而JEV-NJ1株与疫苗株核酸与氨基酸同源性为均在99%以上。SA14-14-2株与JEV-CZ1株属于不同基因型,因此关于SA14-14-2株减毒疫苗对Ⅰ型乙脑病毒的保护力如何应进一步研究。
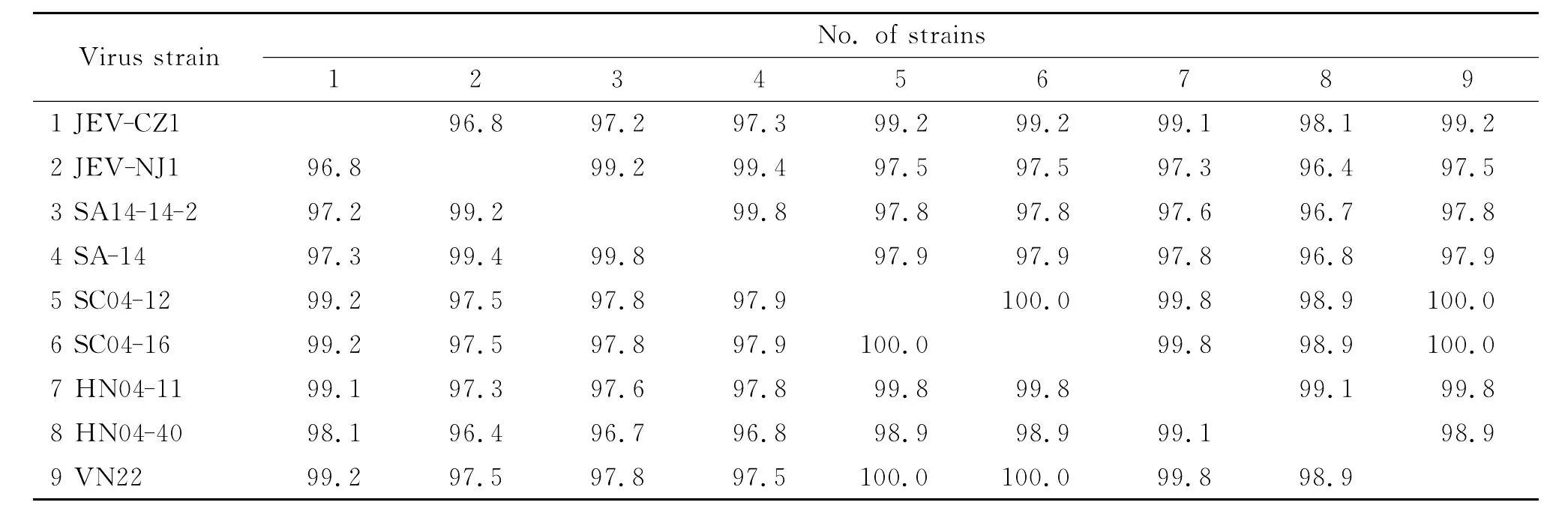
表2 不同毒株E基因推导氨基酸序列同源性比对结果Tab.2 Homology comparison of E protein amino acid sequences among different strains
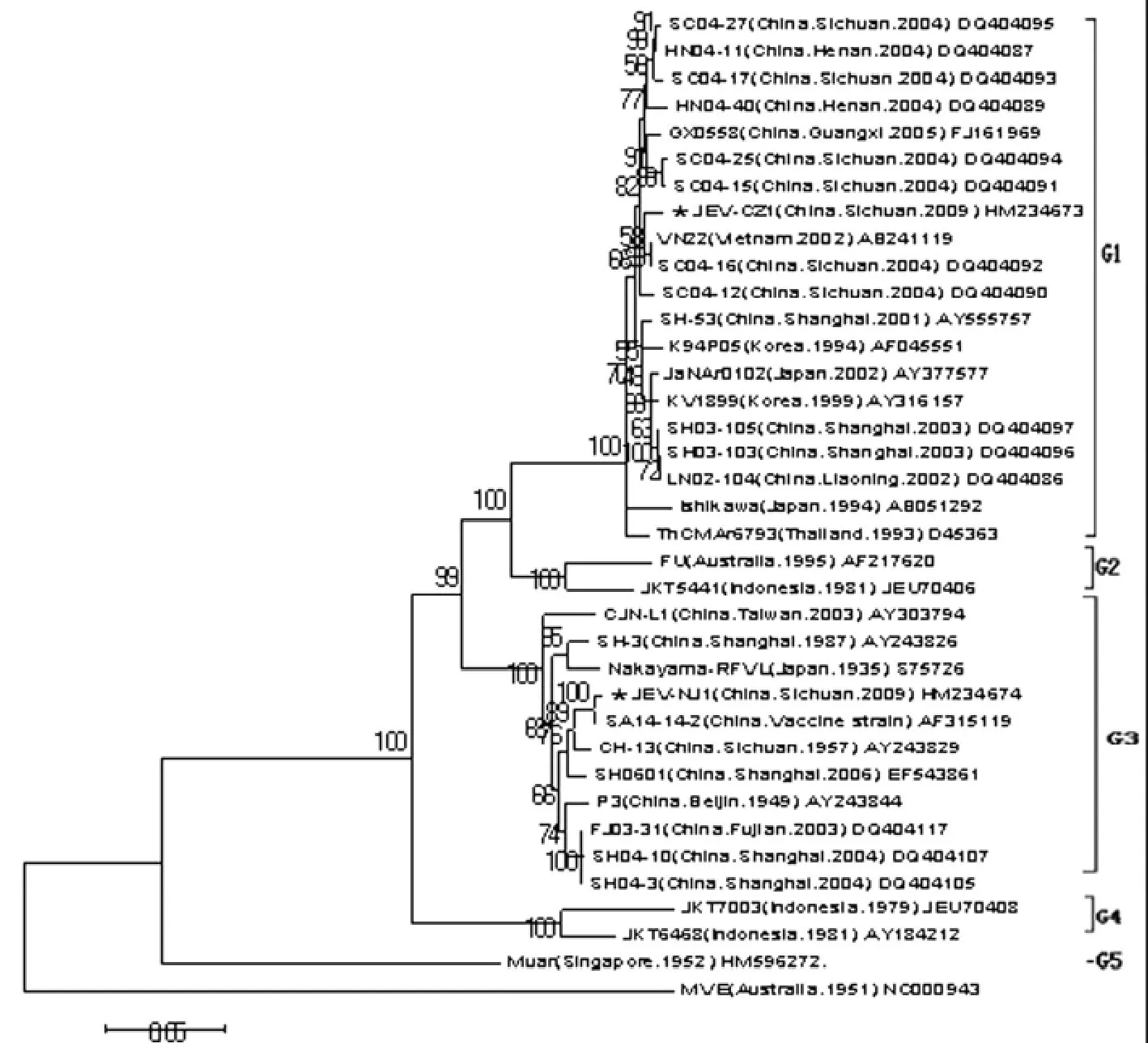
图1 E基因序列系统发育进化树Fig.1 Phylogenetic tree analysis on E gene nucleotide sequence
通过对E蛋白结构域的分析,发现JEV-CZ1株与疫苗株SA14-14-2在3个结构域中有15个氨基酸差异;而JEV-NJ1株只有3处差异;有学者的研究表明E304和E335两个Cys所形成的二硫键是抗原抗体结合的必要结构[7],该两分离株在这两个位点的Cys都没有发生变异。研究表明E60~E68的氨基酸序列 Cys-Tyr-His-Ala-Ser-Val-Thr-Asp-Thr对病毒引起细胞免疫至关重要[8],JEV-CZ1株在E67位的Asp被替换成Glu,而JEV-NJ1株在这一区段非常保守。有学者在对乙脑减毒机理进行研究时认为E138位的Glu替换为Lys后毒力会有较明显降低[9]。本次研究发现JEV-NJ1株与疫苗株SA14-14-2的E138位氨基酸均为Lys,而JEV-CZ1株则为Glu。有学者研究证明针对结构域Ⅲ的抗体在对JEV中和反应中起着重要作用,尤其是在E337-345、E377-382、E397-403 3个区域内发生变异会导致抗原性的改变,甚至影响抗原与中和抗体的结合反应[10],本次研究通过序列分析,发现新分离的两株JEV与疫苗株在这3个区域上完全一致。

表3 E蛋白活性区不同结构域的氨基酸差异Tab.3 Amino acid substitutions in different domains of E protein
1992年 WR Chen等[11]首先依据乙脑病毒PrM/C基因区段(456~695)的核酸序列将乙脑病毒划分为4个基因型。英国Solomon等研究认为乙脑病毒可能起源于印尼-马来群岛,该地区包括乙脑病毒所有基因型[12],乙脑病毒在向其他地区传播过程中受多因素协同作用,有较强的地域性。我国自1949年在北京首次分离到乙脑病毒,此后在其它中国地区也相继分离到毒株,累计已有60余年历史,Wang[13]等对中国自1949-2005年以来分离的乙脑毒株的研究显示中国分离的乙脑病毒以基因Ⅲ型为主,偶有基因Ⅰ型。2001年在上海我国首次分离得到基因Ⅰ型乙脑病毒,随后在辽宁、广西、甘肃、河南和四川等省份也分离得到了基因Ⅰ型乙脑病毒[14-15]。本次研究为了避免用较短的核苷酸序列进行分析可能导致的结果不准确,而采用E基因(1 500bp)进行分型,结果显示2009年从四川崇州市与内江市的猪场蚊子与流产死胎脑组织中分离到的JEV-CZ1株和JEV-NJ1株分别属于基因Ⅰ型和基因Ⅲ型。研究还发现JEV-CZ1株与2004年分离自 四 川 的 毒 株 SC04-16、SC04-12 和 越 南 分 离 株VN22遗传关系较近,JEV-NJ1株与疫苗株SA14-14-2以及以往四川与上海分离的毒株遗传关系较近,基本符合乙脑病毒具有较强地域性的特征。本次研究结果对深入研究四川乙脑病毒的分子生物学特征、DNA疫苗的研制以及建立乙型脑炎基因数据库具有重要意义。
[1]殷震,刘景华.动物病毒学[M].北京:科学出版社,1997:1226.
[2]Solomon T.Recent advances in Japanese encephalitis[J].Journal of Neurovirology,2003,9(2):274-283.
[3]张佳珂,林世华,陈丹林,等.2006-2007年四川省流行性乙型脑炎临床病例血清学分析[J].预防医学情报杂志,2008,24(12):978-980.
[4]汤德元,郭万柱,徐志文,等.乙型脑炎病毒的分离与鉴定[J].四川农业大学学报.2004,22(1):70-74.
[5]王环宇,张佳珂,付士红,等.四川省分离的基因1型乙型脑炎病毒分子特征分析[J].中华微生物学和免疫学杂志,2009,29(9):816-821.
[6]王祥,陈焕春.JEV分子生物学与新型疫苗研究进展[J].动物医学进展杂志,2008,22(3):5-9.
[7]Mason PW,Dalrymple JM,Gentry MK,et al.Molecular characterization of a neutralizing domain of the Japanese encephalitis virus structural glycoprotein[J].J Gen Virol,1989,70(8):2037-2049.
[8]Takada K,Masaki H,Konishi E,et al.Definition of an epitope on Japanese encephalitis virus(JEV)envelope protein recognized by JEV-specific murine CD+8cytotoxic T lymphocytes[J].Arch Virol,2000,145(3):523-534.
[9]Ni H,Chang GJ,Xie H,et al.Molecular basis of attenuation of neurovirulence of wild-type Japanese encephalitis virus strain SA14[J].J Gen Virol,1995,76(2):409-413.
[10]Wu SC,Lin CW.Neutralizing peptide ligands selected from phage-displayed libraries mimic the conformational epitope on domain III of the Japanese encephalitis virus envelope protein[J].Virus Res,2001,76(1):59-69.
[11]Chen WR,Rico-Hesse R,Tesh RB.A new genotype of Japanese encephalitis virus from Indonesia[J].Am J Trop Med Hyg,1992,47(1):61-69.
[12]Solomon TH,Beasley DC,Ekkelenkamp M.Origin and evolution of Japanese encephalitis virus in Southeast Asia[J].J Virol,2003,77(5):3091-3098.
[13]Wang HY,Takasaki T,Fu SH,et al.Molecular epidemiological analysis of Japanese encephalitis virus in China[J].J Gen Virol,2007,88(3):885-894.
[14]王环宇,付士红,李晓宇,等.中国首次分离到基因Ⅰ型乙型脑炎病毒[J].中华微生物学和免疫学杂志,2004,24(11):843-849.
[15]王俊文,付士红,王环宇,等.辽宁省乙脑病毒的分离与鉴定[J].中华实验和临床病毒学杂志,2006,20(1):61-65.
