结核分枝杆菌对异烟肼和利福平的耐药水平与其耐药基因突变的相关性研究
2012-01-24李桂莲张敬蕊赵秀芹杨骜连璐璐万康林
李桂莲 张敬蕊 赵秀芹 杨骜 连璐璐 万康林
INH和RFP是两种最主要的一线抗结核药之一,对这两种药物耐药机制的研究日益受到重视。文献报道Mtb对INH耐药性的产生与过氧化氢酶-过氧化物酶编码基因katG的缺失和突变及烯酰基还原酶编码基因inh A 和oxy R-ahpC(oxy R,烷烃降解非必需基因,编码过氧化物反应调节子;ahp C编码烷基过氧化氢还原酶)基因突变有关[1-5]。RFP耐药性的产生与RNA聚合酶β亚基的编码基因rpo B突变有关,文献报道90%以上的RFP耐药株在rpo B基因81个碱基的核心区域(编码507-533位密码子)-RFP耐药决定区(rifampicin resistance-determining region,RRDR)发生突变[1,6-7]。
目前,关于Mtb基因突变的报道较多,而最低抑菌浓度(MIC)与突变位点之间的关系虽然早有研究,但由于检测抗Mtb药物的MIC对生物安全要求较高,国内关于菌株对抗Mtb药物的MIC与基因突变关系的研究报道较少,现将关于Mtb对INH的MIC与katG、inh A和oxy R-ahpC 突变及RFP的MIC与rpo B基因突变关系的研究报道如下。
材料和方法
一、菌株
Mtb标准株(H37Rv,ATCC27294)和75株经菌种鉴定为Mtb的临床分离株,包括13株同时耐INH和RFP(耐多药菌株,指菌株至少同时对INH和RFP耐药),1株同时耐INH、RFP、S和左氧氟沙星(耐多药菌株),16株单耐 RFP,40株单耐INH,3株同时耐INH和S,1株同时耐INH和EMB,1株同时耐INH和左氧氟沙星的菌株,以上菌株均为本室保存。75株菌株中耐INH菌株共59株,耐RFP菌株共30株。对所有耐INH的菌株检测INH MIC并PCR测序检测katG、inh A和oxy R-ahp C基因的突变情况,对所有耐RFP的菌株检测RFP MIC并PCR测序检测rpoB基因的突变情况。
二、试剂和耗材
Middlebrook 7 H9干粉和牛血清蛋白-右旋糖苷-过氧化氢酶(ADC)营养添加剂购自美国BD公司;RFP、INH、S、EMB、左氧氟沙星、卷曲霉素、阿米卡星和Km等药粉购自美国Sigma公司;Alamar blue试剂购自美国AbD Serotec公司;无菌96孔酶标板购自美国Corning公司;PCR检测试剂购自北京康为生物技术有限公司。
三、罗氏培养基比例法药物敏感度实验
按照《结核病诊断实验室检验规程》[8]进行,培养基中药物终浓度如下:RFP 40μg/ml,INH 0.2μg/ml,S 4μg/ml,EMB 2μg/ml,卡那霉素30μg/ml,左氧氟沙星3μg/ml,卷曲霉素40μg/ml,阿米卡星30μg/ml[8-9]。
四、微孔板Alamar blue显色法MIC测定
在磨菌管内加入1~2滴5%吐温-80(Tween-80),取2~3周Mtb新鲜培养物,加入4~5 ml生理盐水并混匀;静置5~10 min;取适量上清到25 ml培养瓶中,用生理盐水调节浓度至1个麦氏浓度;按照10%的比例在7H9溶液中加入ADC;再取1个25 ml培养瓶,按1∶20比例用7 H9培养基稀释4 ml菌液;在96孔板中每孔加入100μl 7 H9培养基,第1列再加入98μl培养基;第1列每孔加入2μl RFP(51.2 mg/ml)或INH(25.6 mg/ml)贮存液;按照2倍稀释原则依次稀释,至第11列,得到从256.0000~0.2500μg/ml或128.0000~0.1250μg/ml的药液梯度,最后一列为空白;每株菌接种一行,每孔加入100μl稀释菌液;另做一块空白板(不含药),每孔加入100μl 7H9培养基和100μl稀释菌液,每株菌加4个孔;酶标板第一行和最后一行加样孔滴加生理盐水以防干燥,用封口膜密封酶标板;在37℃的培养箱中培养5 d;从第6天开始,在空白板中加入70μl显色剂(Alamar blue∶5%Tween-80=2∶5),隔天观察变色情况。如颜色从蓝色变成紫红色或粉色,则在含药培养基中加入显色剂;若没有变色或变色程度较浅,则继续在另一对照孔中加入显色剂,观察至变色为止。在含药培养基中加入显色剂的第2天,观察结果。对RFP MIC等于0.5000μg/ml和INH MIC等于0.2500μg/ml的菌株,进行低浓度的药物浓度梯度稀释,RFP按1.0000~0.0010μg/ml的2倍系列稀释;INH按0.5000~0.0005μg/ml的2倍系列稀释。MIC定义为蓝色完全没有发生改变的最小药物浓度。
五、Mtb基因组提取和PCR测序
Mtb基因组提取采用十六烷基三甲基溴化铵(cetyltrimethylammonium bromide,CTAB)法[10]。利用直接测序法检测RFP耐药相关基因rpoB,INH耐药相关基因katG、inh A和oxy R-ahpC,引物序列参考文献[3,7,11],PCR均采用50μl扩增体系,反应条件均为:94℃变性5 min,然后94℃30 s,60℃30 s,72℃30 s,共35个循环,最后72℃延伸8 min。PCR产物直接送到北京擎科新业生物技术有限公司进行单向测序,测序引物为PCR扩增用上游引物,测序仪器为ABI3730自动测序仪。采用生物信息学软件DNASTAR Lasergene Editseq 7.1.0和GENtle 1.9.1对测序得到的基因序列与H37Rv基因序列进行比对。
六、不同耐药水平菌株基因突变率的比较
不同耐药水平菌株基因突变率的比较采用四格表χ2检验或确切概率法,P<0.05为差异有统计学意义,采用统计学软件包SPSS 17.0进行统计。
结 果
一、耐药 Mtb INH 的 MIC及katG、inh A 和oxy R-ahpC突变结果
59株对INH耐药的Mtb其INH的MIC值及katG、inh A和oxy R-ahp C突变结果见表1。14株耐多药和5株多耐药(指菌株对2种或2种以上抗结核药物耐药但不包括耐多药)菌株INH的MIC值分布在0.2500~2.0000μg/ml及大于128.0000μg/ml。40株单耐INH 菌株中 MIC分布在0.2500~32.0000μg/ml之间,以2.0000μg/ml为主,占全部单耐INH 菌株的67.5%(27/40)。59株INH耐药菌株katG、inh A启动子、oxy R-ahp C突变率分别为69.5%(41/59)、15.3%(9/59)、6.8%(4/59),总突变率为81.4%(48/59)。
INH MIC在0.2500~1.0000μg/ml的13株菌株,inh A 启动子突变率为53.8% (7/13),katG 315突变率为15.4% (2/13);MIC≥2.0000μg/ml的菌株inh A 突变率为4.3% (2/46),而katG 315突变率为76.1% (35/46)。INH 低水平耐药菌株(MIC为0.2500~1.0000μg/ml)inh A 启动子突变率高于高水平耐药株(MIC≥2.0000μg/ml)(χ2=15.57,P=0.000);而katG 315位突变率则相反(χ2=13.48,P=0.000),结果见表2。
二、耐药Mtb菌株RFP MIC及rpo B基因突变结果
30株对RFP耐药的Mtb其RFP MIC值及rpo B基因突变结果见表3。14株耐多药菌株MIC值均在0.5000μg/ml及以上,16株单耐RFP菌株中除1株菌株 MIC为2.0000μg/ml,剩余15株MIC值在16.0000μg/ml及以上。30株菌株rpo B基因总突变率为96.7% (29/30),rpo B 531位突变率为70.0%(21/30),包括2种突变形式 TCG突变为 TTG(20株)、TTC(1株);rpo B 526位突变率为16.7%(5/30),含3种突变形式 CAC突变为 CAG(1株)、TAC(1株)、GAC(3株)。其他rpo B 突变类型如516、522、碱基缺失各1株,1株菌株511和526位点形成联合突变,1株菌株450、559和531位点形成联合突变。

表1 对INH耐药的Mtb菌株的INH MIC值及katG、inh A和oxy R-ahp C突变结果
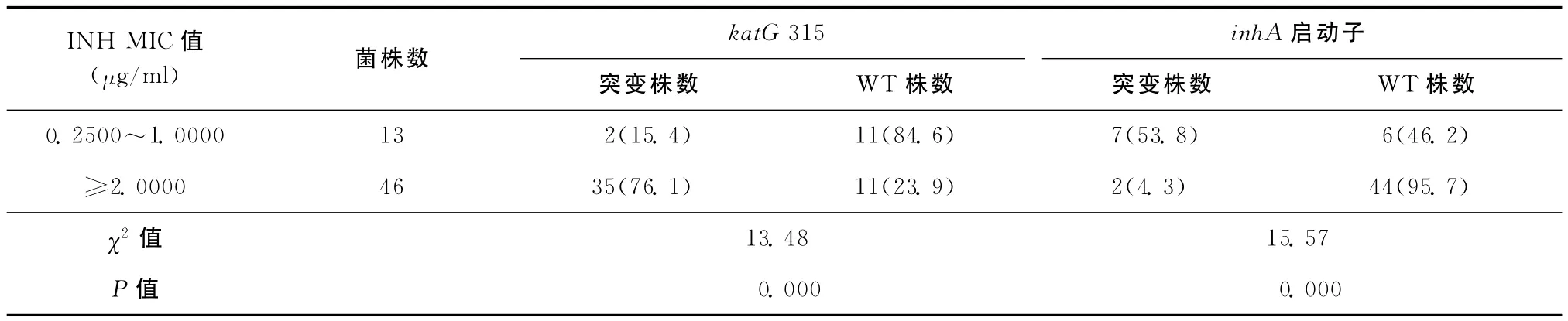
表2 INH耐药水平和katG 315、inh A启动子突变的相关性分析结果
21株rpo B 531突变株 MIC分布在2.0000 μg/ml和>256.0000μg/ml之间。5株rpo B 526突变株除了1株 MIC为0.5000μg/ml,其余4株MIC均在64.0000μg/ml及以上。RFP MIC在0.5000~16.0000μg/ml的菌株rpo B 531和526突变率为62.5%(5/8);MIC≥32.0000μg/ml的菌株rpo B 531和526位点的总突变率为95.5%(21/22),分析发现RFP MIC≥32.0000μg/ml的菌株rpo B 531和526位点的突变率高于 MIC在0.5000~16.0000μg/ml的菌株,P确切概率=0.048(表4)。
讨 论
一、INH 耐药水平与katG、inh A 和oxy R-ahp C突变的相关性
已知和INH耐药有关的基因有katG、inh A、oxy R-ahp C、kas A 及ndh[1-5,12]。其中katG 和inh A是最主要的2个耐药相关基因,报道称katG和inh A突变分别占INH临床耐药株的50%~94%、10%~35%,以katG 315(AGC-ACC)(Ser-Thr)突变 率 最 高[1-2,13]。 而oxy R-ahpC突变率可达到10.0%~39.6%[3-4]。本研究59株INH 耐药 Mtb的总突变率为81.3%(48/59),katG、inh A 启动子、ox y R-ahpC 突变率分别为69.5%(41/59)、15.3%(9/59)、6.8%(4/59),总突变率为81.3%(48/59),这和文献报道基本一致。
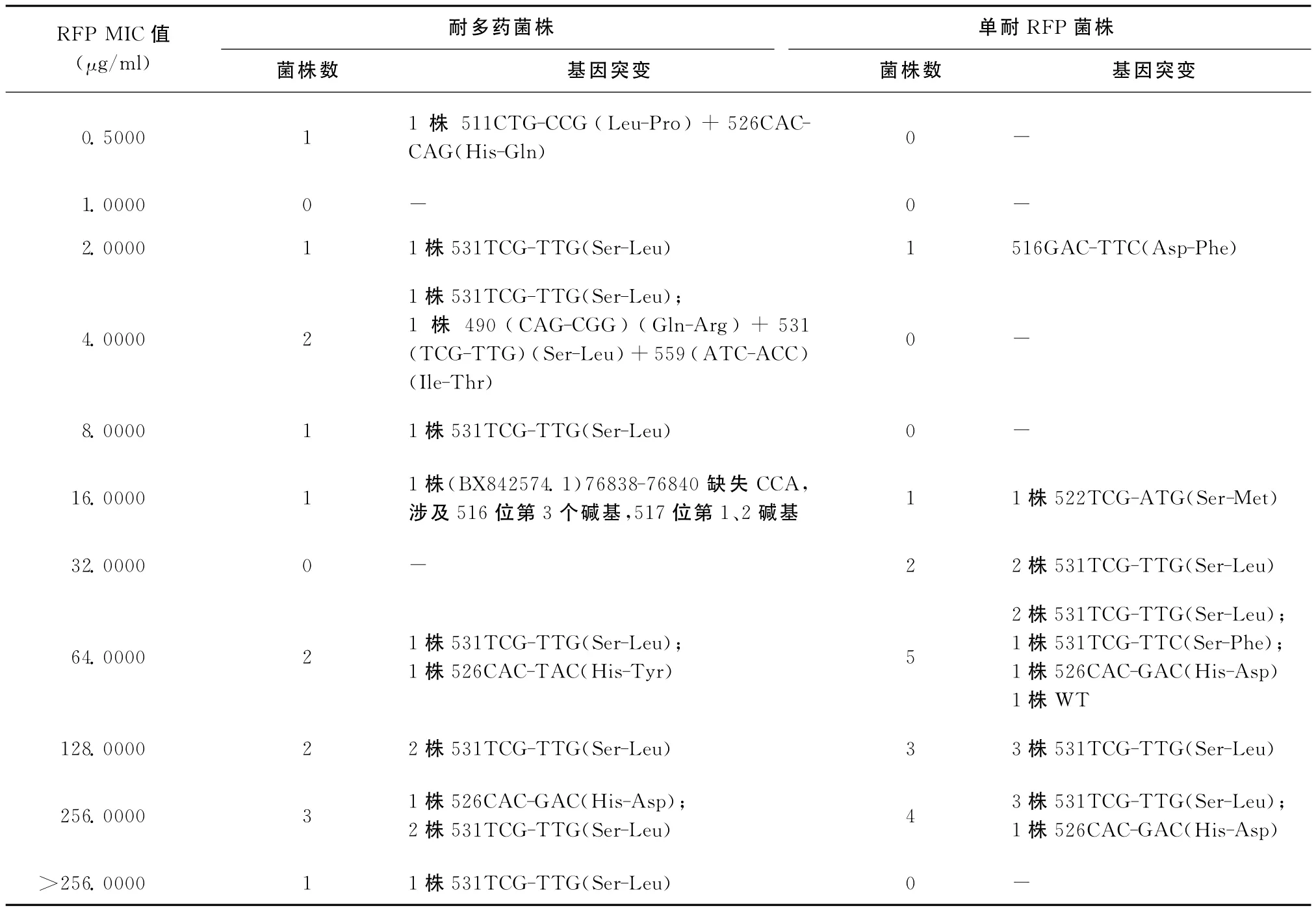
表3 对RFP耐药的Mtb菌株的RFP MIC值及rpoB基因突变结果
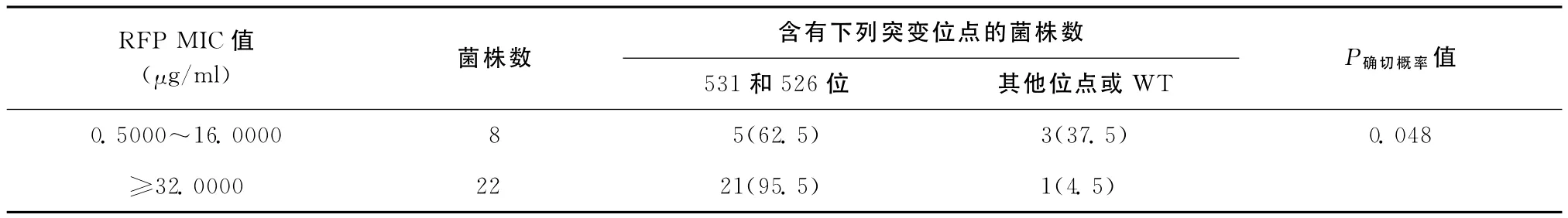
表4 RFP耐药水平和rpoB突变的相关性分析结果
文献报道katG 315位突变与菌株对INH高度耐药有关[2]。本研究发现INH低水平耐药菌株(MIC为0.2500~1.0000μg/ml)以inh A 启动子突变为主,高水平耐药菌株(MIC≥2.0000μg/ml)以katG 315位 突 变 为 主。Abe等[14]将 96 株 经BACTEC MGIT 960诊断为INH耐药的菌株利用小川培养基比例法将这些菌株分为3个等级:低水平敏感(0.2μg/ml敏感),低水平耐药(0.2μg/ml耐药),高水平耐药(1.0μg/ml耐药),结果低水平敏菌株中只有inh A启动子突变而无katG 315突变,低水平耐药菌株inh A启动子突变率(52.6%)高于katG 315突变率(15.8%),而61.7%的高水平耐药菌株携带katG 315或katG缺失突变。Dalla Costa等[15]也发现 MIC≥2μg/ml(刃天青显色法)的菌株katG 315突变率更高。本研究和Abe等[14]及Dalla Costa等[15]的研究均证实了inh A启动子突变与INH低耐药水平有关,而katG 315突变与INH高水平耐药有关。此外,本研究还发现6株MIC>128.0000μg/ml的菌株有3株发生了oxy R-ahp C突变,提示oxy R-ahp C突变可能与INH高水平耐药有关,但应该增加样本含量进一步验证。
本研究共4株 MIC在0.2500~1.0000μg/ml的INH耐药株在katG基因315位点之外的位点发生突变,其中1株为katG 222 GCG-GAG(Ala-Glu)突变,1株katG 261 GAA-GAC(Glu-Asp)和inh A-15C-T联合突变,2株katG 298 TTG-TGG(Leu-Trp)和inh A-15C-T联合突变。由于其中有3株菌株与inh A-15C-T联合突变,因此这4个katG基因突变位点和INH低水平耐药的关系有待进一步研究。此外,1株 MIC为2.0000μg/ml的菌株为katG 315 和inh A-19 G-A 联 合 突 变,inh A-19 和INH耐药的关系有待进一步研究。
二、RFP耐药水平与rpo B突变的相关性
本研究共检测了30株RFP耐药株的rpoB基因突变情况,rpo B总突变率为96.7%,rpo B 531位突变率为 70.0% (21/30),rpoB 526位突变率为16.7%(5/30),和 文 献 报 道 一 致[1,5,7,16]。RFP MIC≥32.0000μg/ml的菌株rpo B 531和526位点的突变率高于 MIC在0.5000~16.0000μg/ml的菌株。由此可见rpoB 531和526位基因突变和RFP高水平耐药有关[17]。30株菌株中只有3株菌株发生rpoB 511和516位突变,文献报道这2个位点和 RFP低水平耐药有关[18]。Huitric等[17]发现rpo B基因RRDR区域除531和526之外还有多个位点与RFP高水平耐药有关,只有522位点与RFP低水平耐药有关(MIC 8~16μg/ml)。Hwang等[19]也发现在rpoB RRDR内突变的菌株其 MIC比在RRDR外发生突变的菌株高。本研究未发现rpoB 533位基因突变的菌株,但有研究表明该位点与RFP低水平耐药有关[18]。
另外,还有16.9%的INH耐药株和3.3%的RFP耐药株没有发现突变,这可能和本研究所测基因测序范围外的其他突变位点或是与其他耐药相关基因突变有关,如RFP耐药相关的rpo B基因的氨基端和羧基端[7,20]、INH 耐药相关的ndh[12]等。此外,最近研究还发现INH和RFP的耐药还与Mtb药物外排泵基因Rv1410c和Rv0783的高表达有关[21]。
由于本研究耐多药菌株只有14株,因此分析基因突变与耐药水平相关性时未将两者结果分开。但发现耐多药或多耐药菌株与单耐INH或单耐RFP菌株相比,基因突变类型较多,如INH耐药株中,前者为8种突变类型而后者仅为4种突变类型;在RFP耐药株中,前者为6种突变类型而后者仅为4种突变类型。
综上所述,本研究发现Mtb katG 315位突变和INH高水平耐药有关,inh A启动子突变与INH低水平耐药有关,oxy R-ahp C间隔区基因突变可能与INH高水平耐药有关,但应增加样本含量进一步验证;rpoB 531和526位点突变与RFP高水平耐药有关。本研究所得数据以及一些新的发现,为进一步研究Mtb对INH和RFP的耐药机制提供了理论依据,对于结核病的治疗和控制将起重要作用。
[1]Sekiguchi J,Miyoshi-Akiyama T,Augustynowicz-Kopec E,et al.Detection of multidrug resistance in Mycobacterium tuberculosis.J Clin Microbiol,2007,45(1):179-192.
[2]Mokrousov I,Narvskaya O,Otten T,et al.High prevalence of Kat G Ser315Thr substitution among isoniazid-resistant Mycobacterium tuberculosis clinical isolates from northwestern Russia,1996 to 2001.Antimicrob Agents Chemother,2002,46(5):1417-1424.
[3]Doustdar F,Khosravi a D,Farnia P,et al.Molecular analysis of isoniazid resistance in different genotypes of Mycobacterium tuberculosis isolates from Iran.Microb Drug Resist,2008,14(4):273-279.
[4]Mukaigawa J,Endoh M,Yanagawa Y,et al.Anti-drug pattern of drug-resistant Mycobacterium tuberculosis and analysis of mutation in drug-target genes.Kansenshogaku Zasshi,2005,79(6):388-396.
[5]崔运勇,王峰,刘小立,等.深圳市耐多药结核分枝杆菌流行株耐药基因序列分析.中国防痨杂志,2011,33(5):257-262.
[6]李桂莲,谢彤,巨韩芳,等.天津市耐异烟肼或利福平的结核分枝杆菌相关基因突变特征.中华结核和呼吸杂志,2010,33(6):460-461.
[7]McCammon MT,Gillette JS,Thomas DP,et al.Detection of rpo B mutations associated with rifampin resistance in Mycobacterium tuberculosis using denaturing gradient gel electrophoresis.Antimicrob Agents Chemother,2005,49(6):2200-2209.
[8]中国防痨协会基础专业委员会.结核病诊断实验室检验规程.北京:中国教育文化出版社,2006:52.
[9]WHO.Policy guidance on drug-susceptibility testing(DST)of second-line antituberculosis drugs.Geneva:World Health Organization,2008.
[10]Van Embden JD,Cave MD,Crawford JT,et al.Strain identification of Mycobacterium tuberculosis by DNA fingerprinting:recommendations for a standardized methodology.J Clin Microbiol,1993,31(2):406-409.
[11]Aslan G,Tezcan S,Serin M S,et al.Genotypic analysis of isoniazid and rifampin resistance in drug-resistant clinical Mycobacterium tuberculosis complex isolates in southern Turkey.Jpn J Infect Dis,2008,61(4):255-260.
[12]Lee AS,Teo AS,Wong SY.Novel mutations in ndh in isoniazid-resistant Mycobacterium tuberculosis isolates.Antimicrob Agents Chemother,2001,45(7):2157-2159.
[13]Kiepiela P,Bishop K S,Smith AN,et al.Genomic mutations in the kat G,inh A and aphC genes are useful for the prediction of isoniazid resistance in Mycobacterium tuberculosis isolates from Kwazulu Natal,South Africa.Tuber Lung Dis,2000,80(1):47-56.
[14]Abe C,Kobayashi I,Mitarai S,et al.Biological and molecular characteristics of Mycobacterium tuberculosis clinical isolates with low-level resistance to isoniazid in Japan.J Clin Microbiol,2008,46(7):2263-2268.
[15]Dalla Costa ER,Ribeiro MO,Silva MS,et al.Correlations of mutations in kat G,oxy R-ahpC and inh A genes and in vitro susceptibility in Mycobacterium tuberculosis clinical strains segregated by spoligotype families from tuberculosis prevalent countries in South America.BMC Microbiol,2009,9(1):39-44.
[16]王海英,徐勇,邓云峰,等.山东省耐利福平结核分枝杆菌rpoB基因突变的研究.中国防痨杂志,2005,27(5):289-292.
[17]Huitric E,Werngren J,Jureen P,et al.Resistance levels and rpo B gene mutations among in vitro-selected rifampin-resistant Mycobacterium tuberculosis mutants.Antimicrob Agents Chemother,2006,50(8):2860-2862.
[18]李国利,张灵霞,王倩,等.结核分枝杆菌临床分离株利福平耐药表型及rpoB基因型分析.临床和实验医学杂志,2011,10(21):1649-1652.
[19]Hwang HY,Chang CY,Chang LL,et al.Characterization of rifampicin-resistant Mycobacterium tuberculosis in Taiwan.J Med Microbiol,2003,52(Pt 3):239-245.
[20]Heep M,Brandstätter B,Rieger U,et al.Frequency of rpoB mutations inside and outside the cluster I region in rifampinresistant clinical Mycobacterium tuberculosis isolates.J Clin Microbiol,2001,39(1):107-110.
[21]李桂莲,王撷秀,谢彤,等.药物外排泵基因表达与结核分枝杆菌耐药关系的探讨.中华检验医学杂志,2011,34(7):605-611.
