强骨康疏胶囊对去卵巢骨质疏松大鼠骨细微结构及骨代谢的影响①
2012-01-23苏林冲湖北民族学院附属民大医院恩施445000
冯 佳 袁 林 苏林冲 向 阳 (湖北民族学院附属民大医院,恩施445000)
绝经后骨质疏松症(Postmenopausal osteoporosis,PMOP)是指绝经后妇女由于卵巢功能衰退,雌激素水平降低,导致骨吸收大于骨形成,出现低骨量和骨组织显微结构退行性改变,以致骨脆性和骨折易感性增加的全身代谢性疾病[1]。在我国随着老龄化社会的到来,骨质疏松症已成为危害公共健康最严重的问题之一。对骨质疏松症的预防性用药是骨质疏松症防治领域研究的热点之一,国外采用激素替代疗法来预防绝经后骨质疏松症,但长期运用的安全性、可耐受性等问题限制其临床应用,另一些药物如降钙素、二磷酸盐等,虽对该症疗效明显且副作用小,但价格昂贵,一般难以长期服用[2]。故研发疗效可靠、作用全面、无明显毒副作用、价格合理的预防药物,是亟待解决的。“强骨康疏胶囊”是恩施州已故民间著名老中医雷永恕治疗骨质疏松症的经验方。本实验通过对去卵巢大鼠早期应用强骨康疏胶囊,探讨该方对去卵巢大鼠骨密度、骨细微结构及骨代谢影响的机制,为其临床应用提供实验依据。
1 材料与方法
1.1实验动物 健康雌性SD 6月龄SPF级大白鼠50只,由武汉大学实验动物中心提供,动物质量合格证号:SCXK(鄂)2008-0004。
1.2实验药物 中药强骨康疏胶囊(内红消、鸡肠风、铁打杆、见血飞、骨碎补、鸡血藤、炒山药、鹿角胶等)由湖北民族学院附属民大医院中药房提供,将药物制成汤剂,给药剂量根据成人与动物体重剂量换算,按成人剂量2.4 g/kg/d,换算成大鼠的剂量为4.32 g/100 g/d,作为中药低剂量,中药高剂量为低剂量的2倍,按8.64 g/100 g体重给药。戊酸雌二醇片,国药准字J20080036,拜耳医药保健有限公司生产,使用时研磨以蒸馏水配成药液,按0.03 mg/100 g体重灌胃。
1.3实验仪器 双能X扫描骨密度仪(Prodigy,美国),自动脱水机(TC-120S),切片机(RM2235,德国),恒温摊片烤片机(TK-218IV),电热恒温干燥箱(GZX-DH-40X45),荧光显微镜(BX50,日本),彩色数码照像系统(DP70,日本)。
1.4主要试剂 大鼠OPG和RANKL免疫组化一抗、兔IgG-SABC免疫组化染色试剂盒、DAB显色试剂盒均购自武汉博士德生物工程有限公司。
1.5实验方法
1.5.1大鼠骨质疏松模型的建立 SD雌性大鼠适应性喂养一周后,随机分出10只作为正常对照组,剩余40只制作骨质疏松模型。以10%水合氯醛,按0.35 ml/100 g体重腹腔麻醉,待麻醉起效后,取俯卧位,于肋弓下脊柱两侧1 cm处,剪毛备皮,充分暴露手术视野,切开皮肤,逐层分离脂肪、肌肉,用眼科镊小心提出腹腔脂肪,轻轻翻查,找到输卵管后,顺着输卵管找到梅花状的卵巢,剪去卵巢,结扎输卵管后,将牵拉出的组织送回腹腔,分层缝合肌肉、皮肤。按同样的方法去除大鼠双侧卵巢。术后,青霉素(80万单位)肌肉注射0.1 ml/只。
1.5.2实验动物分组及给药 将未进行去卵巢手术的大鼠10只做为正常对照组,其余卵巢切除大鼠术后3天,将存活大鼠随机分为4组,除去因灌胃死亡的大鼠数,各组分别为正常对照组9只、模型空白组8只、中药低剂量预防组8只、中药高剂量预防组8只、雌激素预防组8只。给中药低剂量组、中药高剂量组、雌激素组相应药物,正常对照组、模型空白组给予等量生理盐水,连续灌胃给药1个月。
1.5.3取材 处死前禁食12小时,称重后腹腔注射10%水合氯醛麻醉,从髂嵴处取出双侧股骨,仔细剔除肌肉,左侧股骨裹入浸透生理盐水的纱布中编号,待做骨密度检测;右侧股骨放入10%甲醛中固定,编号。
1.5.4实验指标的检测 骨密度测定:取左侧股骨,清除周围软组织,用生理盐水冲洗干净,用双能X线骨密度测量仪测定各组大鼠股骨骨密度。
骨组织形态计量学参数测定:取大鼠右侧股骨,制作脱钙骨切片并染色,将HE染色的股骨组织切片置于显微镜下,彩色数码照像系统进行图像采集。用Image-Pro Plus6.0图像分析系统,对采集的图像进行分析,选择干骺板下5 mm作为测量指标范围,每张切片选取10个视野,测量骨组织形态学参数骨小梁面积、骨小梁厚度及骨小梁间距,并计算骨小梁面积百分数,求各参数平均值。
OPG及RANKL蛋白表达的检测:严格按照试剂盒说明书操作,将脱钙骨石蜡切片放入二甲苯中脱蜡,然后双氧水灭活内源性酶,再进行热修复抗原,滴加5%BSA封闭液封闭细胞,弃血清,分别滴加稀释为1∶100的OPG及RANKL一抗(兔IgG)过夜,滴加生物素化羊抗兔二抗,滴加SABC试剂,DAB显色后,苏木素轻度复染,脱水、透明、封片,显微镜观察。OB及MSC阳性反应细胞胞浆着色呈棕黄色,每个标本随机选取5个视野,用 Image-Pro Plus6.0图像分析系统测定着色部位的平均光密度值,作为OPG及RANKL蛋白的表达强度。
1.6统计学方法 所有数据由SPSS统计软件处理,±s表示,采用单因素方差分析(ANOVA)进行组间两两比较,用LSD检验,P<0.05具有统计学差异。
2 结果
2.1骨密度测量结果 与正常对照组相比,模型空白组大鼠股骨骨密度减少,差异具有统计学意义(P<0.01);与模型空白组相比,雌激素预防组、中药低剂量组、中药高剂量组股骨骨密度差异均具有统计学意义(P<0.05);中药低剂量组与雌激素预防组比较,骨密度有所降低,但差异无统计学意义(P>0.05);中药高剂量组与中药低剂量组相比,骨密度有所升高,但差异无统计学意义(P>0.05,见表1。
2.2HE染色观察结果 骨组织HE染色光学显微镜下观察显示:正常对照组骨小梁排列密集,连续性好,成网状连接,宽度均匀,相邻骨小梁间距较小。模型组与正常组相比,骨小梁变细、数量减少,连续性破坏,游离断端增多,骨小梁间距增大。雌激素预防组、中药低剂量组、中药高剂量组与模型空白组相比,骨小梁宽度增加,排列整齐,连续性较好,断端减少,骨小梁间距减小,如图1所示。
2.3骨组织形态计量学参数结果 与正常对照组比较,模型空白组骨小梁厚度、面积、面积百分数均减少,差异具有统计学意义(P<0.01),骨小梁间距增大,差异具有统计学意义(P<0.01)。与模型空白组比较,雌激素预防组、中药低剂量组、中药高剂量组的骨小梁厚度、面积、面积百分数均增大,骨小梁间距减小,差异具有统计学意义(P<0.01)。中药高剂量组与中药低剂量组相比,各参数差异无统计学意义(P>0.05),见表2、3。
表1 各组大鼠股骨双能X线骨密度测定(±s)Tab.1 The measurement with BMD of femoral bone in each groups(±s)
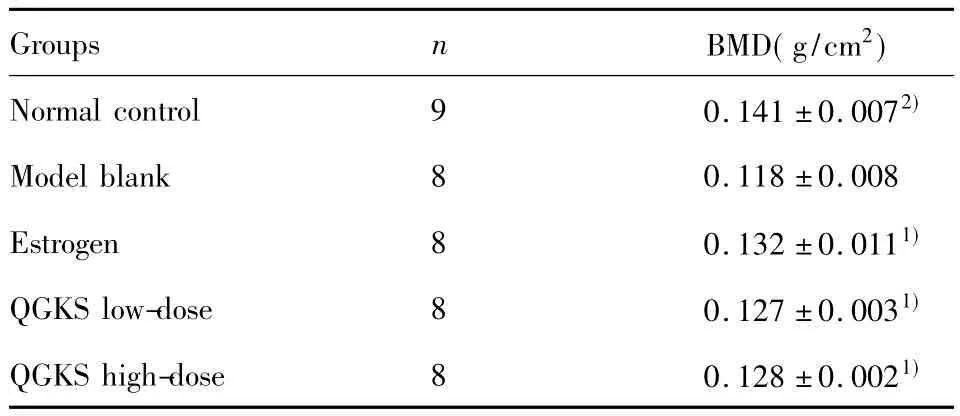
表1 各组大鼠股骨双能X线骨密度测定(±s)Tab.1 The measurement with BMD of femoral bone in each groups(±s)
Note:Compared with model blank group,1)P<0.05,2)P<0.01.
Groups n BMD(g/cm2)Normal control 9 0.141±0.0072)Model blank 8 0.118±0.008 Estrogen 8 0.132±0.0111)QGKS low-dose 8 0.127±0.0031)QGKS high-dose 8 0.128±0.0021)
2.4OPG和RANKL蛋白表达检测结果 模型空白组骨髓内基质细胞OPG表达水平降低,中药低剂量组、中药高剂量组、雌激素预防组较模型空白组明显(见图2)。模型空白组骨髓内基质细胞胞浆RANKL呈高表达,中药低剂量组、中药高剂量组、雌激素预防组表达强度减弱,见图3。模型空白组大鼠股骨的RANKL蛋白平均光密度值较正常对照组、雌激素预防组、中药低剂量组、中药高剂量组皆明显增高,且中药低剂量组与中药高剂量组差异无统计学意义;模型空白组大鼠股骨OPG蛋白平均光密度值较正常对照组、雌激素预防组、中药低剂量组、中药高剂量组皆显著降低,且中药低剂量组与雌激素预防组间差异无统计学意义(P>0.05),中药低剂量组与中药高剂量组间差异无统计学意义(P>0.05),见表4。

图1 各组大鼠股骨骨小梁(HE染色,×4)Fig.1 The femoral bone trabecula of each groups(HE staining,×4)
表2 各组大鼠股骨骨小梁面积及骨小梁面积百分数比较(±s)Tab.2 The comparison between femoral trabecular bonearea and area percentage in each groups(±s)
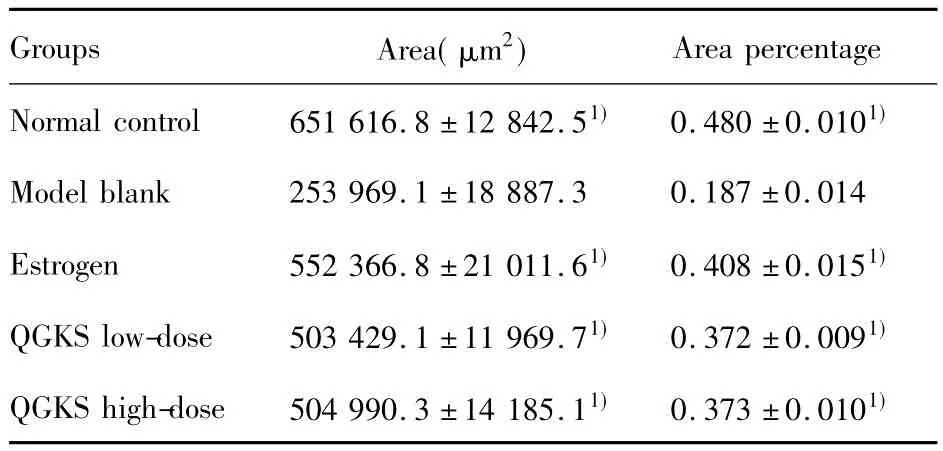
表2 各组大鼠股骨骨小梁面积及骨小梁面积百分数比较(±s)Tab.2 The comparison between femoral trabecular bonearea and area percentage in each groups(±s)
Note:Compared with model blank group,1)P<0.01.
Groups Area(μm2)Area percentage Normal control 651 616.8±12 842.51) 0.480±0.0101)Model blank 253 969.1±18 887.3 0.187±0.014 Estrogen 552 366.8±21 011.61) 0.408±0.0151)QGKS low-dose 503 429.1±11 969.71) 0.372±0.0091)QGKS high-dose 504 990.3±14 185.11) 0.373±0.0101)
表3 各组大鼠股骨骨小梁厚度及骨小梁间距比较(±s)Tab.3 The comparison between femoral trabecular bone thickness and spacing in each groups(±s)
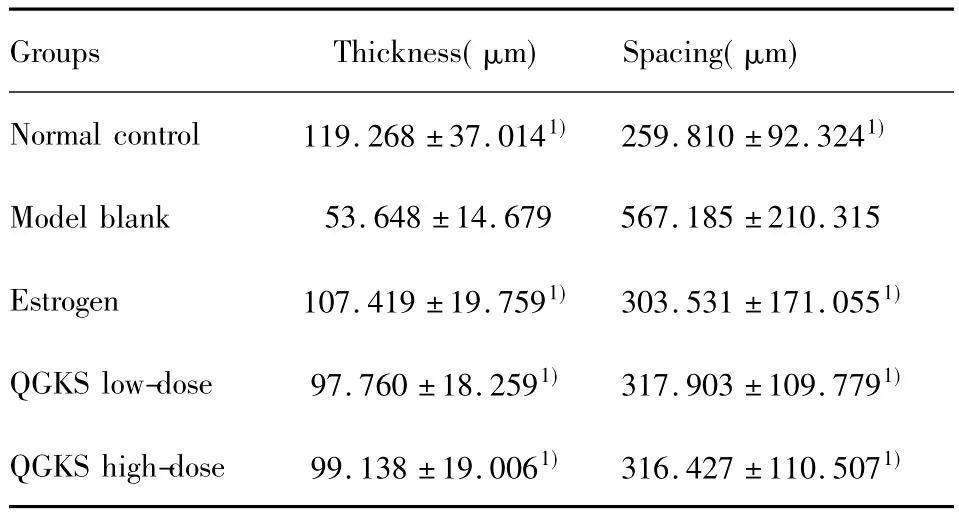
表3 各组大鼠股骨骨小梁厚度及骨小梁间距比较(±s)Tab.3 The comparison between femoral trabecular bone thickness and spacing in each groups(±s)
Note:Compared with model blank group,1)P<0.01.
Groups Thickness(μm) Spacing(μm)Normal control 119.268±37.0141) 259.810±92.3241)Model blank 53.648±14.679 567.185±210.315 Estrogen 107.419±19.7591) 303.531±171.0551)QGKS low-dose 97.760±18.2591) 317.903±109.7791)QGKS high-dose 99.138±19.0061) 316.427±110.5071)

图2 各组大鼠股骨OPG蛋白表达(免疫组化染色,×40)Fig.2 The protein expression of OPG in each group(Immunohistochemistry,×40)
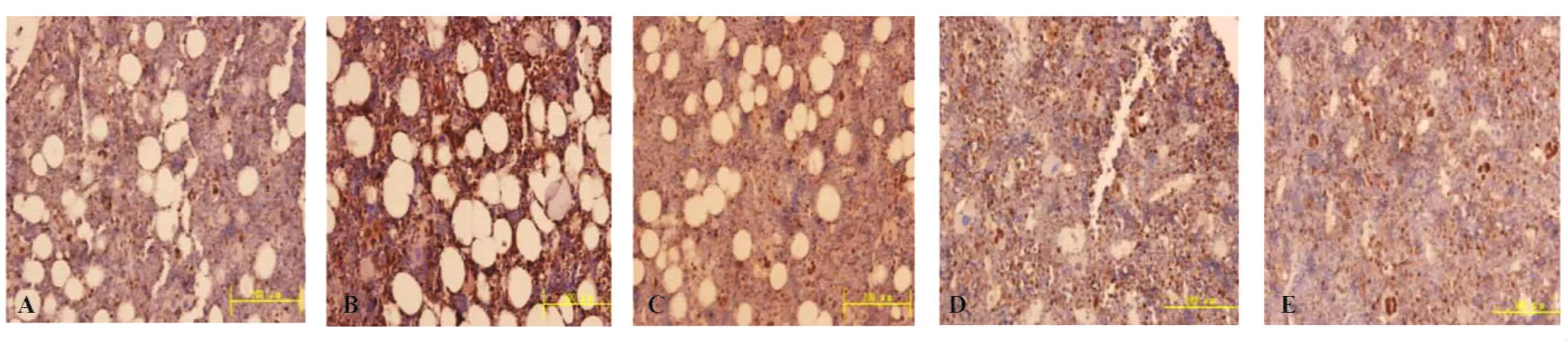
图3 各组大鼠股骨RANKL蛋白表达(免疫组化染色,×40)Fig.3 The protein expression of PANKL in each groups,(Immnuohistochemistry,×40)
表4 各组大鼠股骨OPG及RANKL蛋白表达平均光密度值测定(±s)Tab.4 The measurement of the protein average optical density(AOD)of OPG and RANKL in each groups(±s)

表4 各组大鼠股骨OPG及RANKL蛋白表达平均光密度值测定(±s)Tab.4 The measurement of the protein average optical density(AOD)of OPG and RANKL in each groups(±s)
Note:Compared with model blank group,1)P<0.01.
Groups n AOD of OPG AOD of RANKL Normal control 9 0.459±0.0161) 0.359±0.0371)Model blank 8 0.318±0.039 0.584±0.043 Estrogen 8 0.381±0.0371) 0.447±0.0231)QGKS low-dose 8 0.361±0.0271) 0.499±0.0271)QGKS high-dose 8 0.374±0.0211) 0.472±0.0331)
3 讨论
去卵巢雌性大鼠骨质疏松模型是公认的标准化的绝经后骨质疏松症经典病理模型。该模型是目前世界上通用的骨质疏松动物模型之一,以松质骨丢失为主要特征,较好的模拟成年妇女雌激素缺乏的临床特点和对雌激素替代疗法的反应[3]。去卵巢动物也是中医认可的研究肾主骨良好模型[4]。有研究认为4.5~10月龄大鼠的骨量处于相对稳定期,选择该月龄大鼠做模型,研究药物对骨质疏松症的防治作用是可行的[5]。本实验选用6月龄雌性大鼠,其骨代谢处于相对稳定阶段,对其进行卵巢切除术1月后发现股骨骨密度下降,骨组织形态学遭到破坏,说明造模成功,为观察强骨康疏胶囊早期干预绝经后骨质疏松症的药物功效提供了良好的研究基础。
骨密度是反映骨强度的重要指标之一,也间接评价骨丢失程度。双能X线骨密度仪是骨质疏松症检查诊断的首要方法和金标准[6]。而且骨密度在评价大鼠骨质疏松模型及疗效判定方面也有很好的准确性和精确性[7]。陈东等[8]通过实验认为,去卵巢大鼠全股骨及股骨远端与胫骨相比可检测到明显的骨量丢失,显示测定全股骨及股骨远端骨密度较为敏感,并认为股骨骨组织计量学参数与骨密度之间存在明显正相关性。本实验说明强骨康疏胶囊能有效提高骨量,预防骨质疏松症。
骨组织形态计量学是20世纪70年代发展的一项病理学技术,在二维的骨组织切片图像上,利用体视学方法,推导出反映骨结构、骨重建的三维参数。骨形态计量学是揭示骨的生理病理改变与组织定量研究的方法,它在研究疾病的发生机理、评价药物疗效中具有广泛的应用价值,是评价骨结构与骨转换的有效手段,能直观、形象地对松质骨进行定量分析。将骨矿含量测定与骨组织形态学结合在一起,可全面反映骨生理病理与功能变化,从而对骨质量做出科学的判断,为合理评价骨质疏松或新药的药效提供理论依据[9]。通过松质骨静态参数,可以了解骨质疏松模型建立是否成功,干预因素是否有效。骨小梁厚度、骨小梁间距、骨小梁面积百分数等静力学指标反映单位面积内骨小梁连接状况和骨小梁本身的结构特征,骨结构越优化,骨的抗骨折能力就越强。骨小梁面积百分数是反映骨量的参数;骨小梁厚度、骨小梁间距是反映骨结构的参数[10]。本实验骨组织计量学指标采用国际通用、标准的骨组织形态计量学学术语命名[11]。研究表明,去卵巢大鼠单位面积内骨的静力学参数低于正常对照组,提示骨小梁稀疏、细小和三维结构破坏,这与显微镜下观察到的骨小梁内出现大的空洞,且间距增宽的结果一致。给予补肾壮骨方药后,骨小梁厚度、骨小梁面积、骨小梁面积百分数明显增加,与模型空白组相比有显著差异;骨小梁间距及骨小梁游离末端明显减少。这与显微结构中所见骨小梁密集,三维结构存在相吻合,证明强骨康疏胶囊在维持骨量的同时也延缓了骨结构的破坏。
骨保护蛋白(Osteoprotegerin,OPG)是由Simonet等[12]发现的肿瘤坏死因子受体超家族成员之一。核因子-κβ受体活化因子配体(Receptor-avtivator of nuclear factor kappa beta ligand,RANKL)是肿瘤坏死因子配体超家族成员,成骨细胞通过在细胞表面表达RANKL与破骨细胞前体细胞进行细胞-细胞依赖式接触,促进破骨细胞的生成[13]。核因子-κβ受体活化因子(Receptor-avtivator of nuclear factor kappa beta,RANK)是肿瘤坏死因子受体家族成员,主要功能是与RANKL结合,激活RANK,启动一系列信号转导途径[14]。OPG/RANK/RANKL分子及其信号通路是近年来发现的参与调节骨重建的最重要的分子系统之一,通过其分子生物学方面的研究,对探讨骨重建的机制和骨质疏松症的防治具有重要意义。骨组织中RANKL/OPG的变化规律是指导靶向RANKL/RANK/OPG系统基因治疗绝经后骨质疏松症的重要理论依据,并且靶向该系统信号通路的基因干预治疗对绝经后骨质疏松症的预防应越早越好[15]。本实验通过免疫组化染色法检测去卵巢大鼠股骨OPG及RANKL蛋白的表达,证明强骨康疏胶囊通过提高骨OPG蛋白表达及抑制RANKL蛋白表达,来干预绝经后骨质疏松症的发展。
从实验结果发现,中药低剂量组与中药高剂量组疗效差异无统计学意义,说明在造模初期即绝经后骨质疏松症发病的早期阶段,使用低剂量的强骨康疏胶囊即可以达到早期干预绝经后骨质疏松症的作用。综上,强骨康疏胶囊能够改善去卵巢大鼠的骨量、骨代谢、骨组织形态学及骨显微结构。
1 孟宏霞,刘洁冰,张升红.绝经后骨质疏松症发病相关因素临床分析[J]. 武警医学院学报,2011;20(1):13-16.
2 刘文轩,郭 影.中药治疗绝经后骨质疏松症研究进展[J].临床医学工程,2010;17(9):139-140.
3 许碧连.大鼠去卵巢后对不同部位骨骼得影响[J].中国临床药理学与治疗学,2004;9(10):1175-1178.
4 陈亚琼,杨海燕,黄艳红et al.补肾中药醇提活性部位预防卵巢摘除小鼠的骨丢失[J].中国骨质疏松杂志,2002;8(1):68-72.
5 刘晓青.不同月龄正常大鼠骨形态计量学参数动态变化的研究[J].中国临床药理学与治疗学,2005;10(2):184-186.
6 唐存贵.鼠龄对大鼠去卵巢骨质疏松模型的影响[J].中国骨质疏松杂志,2008;14(4):229-232.
7 陈孟诗,赖胜祥,李 良et al.大鼠的骨生物力学指标选取及测试[J].生物医学工程杂志,2001;18(4):547-551.
8 陈 东,王连唐,陈国栋et al.去卵巢后大鼠不同部位的骨组织计量学与骨密度研究[J].中国骨质疏松杂志,2002;8(3):208-210.
9 刘 康,史晓林.骨形态计量学在骨质疏松研究领域的研究进展[J].中国骨质疏松杂志,2007;13(6):440-450.
10 陈元川,赵咏芳,王 翔et al.中药改善骨质疏松大鼠骨骼强度的作用机制[J].中医正骨,2008;20(11):6-8.
11 Parfitt A M,Drezner M K,Glorieux F H et al.Bone histomorphometry:standardization of nomenclature,symbols,snd units.Report of ASBMR histomorphometry nomenclature committee[J].J Bone Miner Res,1987;2(6):595-610.
12 Simonet W S,Lacey D L,Dunstan C et al.Osteoprotegerin:a novel secreted protein involved in the regulation of bone density[J].Cell,1997;89(2):309-319.
13 Ann E K,Sundeep K,Paul K.RANKL and OPG regulation of bone remodeling in health and disease[J].Endocrine Reviews,2008,29(2):155-192.
14 Wright H L,Mccarthy H S,Middleton J et al.RANK,ANKL and Osteoprotegerin in bone biology dnd disease[J].Curr Rev Musculoskelet Mod,2009;2(1):56-64.
15 高延征.去卵巢后大鼠骨组织核激活因子受体配体、骨保护素蛋白表达及其与骨质疏松的相关性研究[J].中华实用诊断与治疗杂志,2009;23(3):237-239.