中国森林保护亟待解决的若干科学问题
2012-01-22张星耀吕全梁军田呈明赵莉蔺刘振宇
张星耀 ,吕全,梁军,田呈明,赵莉蔺,刘振宇
(1.中国林业科学研究院森林生态环境与保护研究所,北京 100091;2.北京林业大学,北京 100083;3.中国科学院动物研究所,北京 100101;4.山东农业大学植物保护学院,山东泰安 271018)
林业担负着维护国土生态安全,满足木材及林产品供给,促进经济社会发展,推动人类文明进步的重要使命。尤其是在全球气候变化、荒漠化、生物多样性锐减等生态危机以及森林、能源等战略资源日趋枯竭的形势下,林业的可持续发展已成为国家文明、社会进步的重要标志。
2011年9月6日,国家主席胡锦涛在出席首届亚太经合组织(APEC)林业部长级会议中的讲话,把发展林业作为实现科学发展的重大举措、建设生态文明的首要任务、应对气候变化的战略选择。提出“力争到2020年森林面积比2005年增加4 000万hm2,森林蓄积量比2005年增加13亿 m3,为绿色增长和可持续发展做出新的贡献”的宏伟目标。我国是世界上木材消耗大国,木材及林产品需求一直呈刚性增长,缺口越来越大。据统计,2010年我国木材缺口大约有1.6亿m3,而“十二五”期间这一数字将达到3亿 m3。尽管我国森林面积已达19 333万hm2,森林蓄积133.6亿 m3,但森林覆盖率仅为20.36%,只有全球平均水平的2/3,列世界第139位;人均森林面积0.145 hm2,不足世界人均占有量的1/4;人均森林蓄积10.151 m3,仅为世界人均占有量的1/7。同时我国林业也面临着森林资源质量低下、分布不均等问题的挑战。随着国民经济的快速发展,林业的物质、文化和生态产品供给与社会需求之间的矛盾日益突出,森林资源以及林业产品的严重匮缺已成为制约我国国民经济快速健康发展的严重问题。要满足社会经济发展对改善生态环境、维护国土生态安全和日益增长的木材需求,其根本途径是在保护天然林的同时大力发展人工林。为此,中共中央、国务院《关于加快林业发展的决定》指出,确立以生态建设为主的林业可持续发展道路,建立以森林植被为主体、林草结合的国土生态安全体系,建设山川秀美的生态文明社会,成为新时期我国林业工作的重要任务。因此,保障林业建设成果使其健康可持续发展成为我国经济发展、生态环境和新农村建设的重大需求。
1 森林病虫灾害暴发流行严重制约着我国现代林业的可持续发展
林业可持续发展的关键是保护森林资源免受自然灾害的侵袭。如何预防和减轻森林病虫危害所造成的生态、经济和社会损失,成为林业建设成败与否的关键。根据国家林业局的统计和评估,森林病虫害作为“无烟的火灾”给我国林业建设造成了严重的危害,其发生和受灾面积均呈逐年上升趋势。据统计,近年来我国森林病虫害年均发生面积达1 151.8万hm2,直接经济损失和生态服务价值损失总计为1 101.1亿元,其中因病虫害造成的年均直接经济损失达245亿元,生态服务功能损失856.1亿元[1]。
我国天然林(天然次生林为主)面积为1.2亿hm2,占森林总面积的61.54%。但是,由于人为干扰过度,大部分天然林退化,生物多样性水平降低,林分抗逆和抵御病虫灾害的能力下降,造成病虫害的发生甚至流行。其特征主要表现为:第一,全球气候变化导致突发性病虫灾害大面积流行。气候的微小扰动都可能对森林生态系统的结构和演替过程产生巨大影响,病虫害的暴发和流行即是该过程的一个重要标志。例如,西藏林芝地区一些未受人类直接干扰的天然林出现冷杉大面积带状死亡被认为与全球气候变化导致真菌病害流行有关。第二,外来病虫与本土病虫协同作用导致灾害蔓延。例如,松材线虫 Bursaphelenchusxylophilus(Steiner&Burher)Nickle传入我国后在本土害虫松墨天牛Monochamus alternatus Hope的协同下已在全国15个省(区、市)严重发生,年均发生面积超过6.7万hm2,病死树达100万株[2]。松材线虫病蔓延扩散的最主要自然因素在于其媒介昆虫松墨天牛在我国的广泛分布,而每头松墨天牛最高可以携带松材线虫28万条以上。作为美国本土次期性害虫的红脂大小蠹Dendroctonus valens LeConte在我国华北油松Pinus tabulaeformis林内暴发成灾,发生面积最高达52万hm2以上,严重地区油松死亡率达30%,已导致600多万株松树枯死。红脂大小蠹在侵入我国后造成严重危害,与其伴生的本土病原菌协同攻克寄主抗性有直接关系[3]。
我国人工林面积达6 168.84万hm2,居世界第一,其中仅马尾松 Pinus massoniana、杨树 Populus spp.和杉木Cunninghamia lanceolata纯林就占人工林总面积的59.4%,而混交林仅占3%。研究表明,约80%的森林病虫灾害发生在人工林。导致人工林重大病虫害常年暴发成灾的原因在于人工林结构和树龄单一,病原物和害虫群体的广布性及其种群异质性,以及经营水平低下等。人工林病虫害发生的特征主要表现为:第一,广泛分布于南北方不同气候区的重大病虫灾害(广布型)常年暴发流行。例如,松毛虫Dendrolimus spp.在全国范围内周期性大发生,发生面积曾高达300多万hm2,占全国森林病虫害发生面积的50%;20世纪80年代后一些地区因封山育林,松毛虫危害得到了有效控制,但近年来灾情出现反弹,年均发生面积在140万hm2以上。光肩星天牛Anoplophora glabripennis(Motschulsky)等杨树蛀干害虫自上世纪80年代以来在我国西部省区猖獗危害,对三北防护林工程造成巨大破坏。近年来灾情依然严重,年均发生近80万hm2,并开始侵入天然次生林,直接影响我国对外贸易。第二,树木生长势下降诱发的寄主主导性病害普遍发生。一些寄主主导性病害的病原广泛存在于自然界和潜伏侵染于树木体内,气候和土壤逆境导致的树木生长势下降是导致这类病害流行的主要诱因。例如,杨树溃疡病 Botryosphaeria spp.、松枯梢病Sphaeropsis sapinea(Fr.:Fr.)Dyko & Sutton 等病害暴发流行,杨树病害年均发生面积达23万hm2,发病株率在40%以上,病死株率高达20%以上。同时,杨树溃疡病致使造林成活率和保存率下降15%以上,严重影响造林效果。近10 a来,松枯梢病在我国蔓延速度加快,危害不断加重。吉林省受松枯梢病侵袭的林分发病率达60%,湖北省发生面积达2.7万hm2,造成林木大面积死亡,已发展成为我国的重大森林病害。第三,次要性病虫灾害演化为主要威胁。如干旱等极端异常气候引起杨扇舟蛾Clostera anachoreta(Fabricius)、春尺蠖 Apocheima cinerarius Erschoff等食叶害虫连续暴发成灾,平均每年新增2万hm2,全国发生面积已达14.67万hm2,2009年出现多点连片暴发现象,江苏、河北等地多处绿色通道景观被毁,杨树产业损失巨大。以沙棘木蠹蛾 Holcocerus hippophaecolus Hua,Chou,Fanget et Chen.为主的一些次要性害虫暴发成灾,在三北地区造成16万hm2的沙棘Hippohgae rhamnoides林分整片枯死,严重威胁生态脆弱区植被的恢复与重建。
我国森林资源和国土安全常年面临病虫灾害的威胁,严重制约生态建设步伐、社会主义新农村建设和林权制度改革的实施,形势十分严峻。因此,面对国民经济和社会发展对森林资源需求的持续增长,形成可持续控制病虫灾害的理论和技术体系,有效控制病虫灾害,保障林业建设成果迫在眉睫。
2 揭示病虫成灾机理是推动森林病虫害控制科学理论发展的关键
明确病虫灾害的形成过程和原因是有效控制病虫危害的前提。目前对于病虫害发生机理的诠释主要集中在个体、种群、群落、生态系统和景观等各个层次。种群遗传变异、种间互作、生态适应,以及环境胁迫等方面的内容成为关注的焦点。
2.1 病原物和害虫通过遗传变异与适应性进化建立成功定殖的种群 病原物和害虫在寄主选择压力和环境胁迫下,不断产生新的生理小种或生态型乃至种的分化。杨树锈病菌在欧洲存在显著地理分化[4],栗疫病菌 Cryphonectria parasitica(Murr.)Barr.、杨栅锈菌 Melampsoraros trupii Wagn.、蜜环菌 Armillariella mellea(Vahl.ex Fr.)Karst.、舞毒蛾Lymantria dispar Linnaeus、松毛虫等广布型森林病虫的群体遗传分化受气候带、山脉、小气候区域等尺度影响显著,具有明显的区域流行暴发特点,形成了适应不同森林生态系统的地理分布格局[5]。但对这种生态地理分布的遗传和适应性进化机制还缺乏深刻认识。
树木—病原物或害虫协同进化中,在树木抗性选择压力下,病原物和害虫快速进化,产生强毒性的致病基因,克服树木防御系统。病原物和害虫如何识别、克服寄主防御系统,以及与寄主互作中致病基因、信号传导、代谢调控、化学通讯等成为阐明病虫害形成机制的焦点。随着如松材线虫等重大有害生物基因组序列的测定和初步注释完成[6],为从基因水平揭示有害生物与寄主间的互作关系和过程提供了条件。
2.2 病原物和害虫在建群以及进一步扩散的过程中,除了其种群本身的适应性外,还受到与其它物种互作的影响 除了天敌及拮抗微生物之外,森林有害生物之间的互作也会对病虫害的发生起到调控作用。植食性昆虫之间存在广泛交互作用,其中62%为竞争关系,11%为促进关系[7]。昆虫和病原物也可能通过竞争同一植物构成竞争关系。例如“云杉小蠹 Dendroctonus rufipennis—伴生菌 Leptographium abietinum”共生系统中至少有8种螨和6种线虫对其具有调控作用[8],而拮抗菌等通过制约伴生菌来调控小蠹虫种群密度。伴生菌Ophiostoma minus Hedgc.通过抑制南部松小蠹Dendroctonus frontalis Zimmerman的共生菌Entomocorticium sp.来危及小蠹幼虫发育,这种竞争互作体系可能会广泛存在[9]。这种物种间复杂的互作系统,为揭示森林病虫害种群暴发机制研究提供了理想的试验体系[10]。
2.3 许多森林病虫害破坏植被、改变食物网络组成及结构,间接依赖于群落及景观格局受干扰导致的生态系统不稳定性 生境中生物的分布格局、群落结构、森林结构功能演变和生物栖息地异质程度等通过影响生物种群数量、种间关系和动态等促进病虫灾害的暴发,继而使食物网络受到干扰,导致树木死亡。因此,在群落与生态系统水平上,景观片断化和森林斑块地理特征直接影响甚至决定了病虫害发生、扩散,甚至流行的时机和方式[11]。模拟研究表明,地表覆被的改变影响了南部松小蠹的扩散。随着寄主植物斑块的加大,虫害暴发成灾的可能性增加;反过来虫害的长期发生会引起景观破碎化,降低寄主种类的聚集程度,从而倾向降低害虫种群密度[12]。
2.4 气候变化加剧病虫害的发生和危害 全球气候变暖、干旱、环境污染(以酸沉降为主)等环境胁迫对天然林主要病原物和害虫发育的影响引起了广泛关注[13]。年平均温度的持续升高致使云杉八齿小蠹Ips typographus Linnaeus每年发生世代增加,虫口密度增大,适生范围扩大;气温升高2~3℃,当年出现第2代;升高5~6℃,即能使第2代完成生活史。高温伴随的极端干旱诱发烂皮病Valsa sordida Nat.等寄主主导性病害和杨角梢小蠹Trypophloeus populi(Hopkins)等次期性害虫的暴发成灾,从而引起森林的大面积死亡[14]。剧烈的异常气候事件甚至导致了植物猝死病等新型侵染性病害(Emerging Infectious Diseases,EIDs)的出现[15]。预测全球气候变暖下关键种间关系的维持、结构及重组格局,揭示环境变化条件下森林病虫害的变化趋势,成为当前世界研究的热点和趋势,也为森林病虫害的长期可持续防控体系的构建提供依据。
3 揭示森林生态系统调控病虫害的机制是构建控制理论体系的基础
森林生态系统依靠自组织机制控制病虫害的暴发,是生态系统过程的核心之一,也是森林病虫害持续控制的重要基础理论问题[16-17]。天然林生态系统调控病虫灾害的功能及其结构为生态调控提供了模板。目前的研究主要集中在森林生态系统内生物及非生物因素结构对病原物和害虫种群及行为调节的生态过程。
3.1 树种遗传多样性提高生态系统适应力 树木自身的遗传多样性与森林生态系统自我调控功能直接相关。一方面,天然林优势树种存在一些抗性基因型,从而对病虫灾害具有较强的抵抗力,这种机制在许多树种中存在,例如在欧洲栗中存在一些抗锈病的类型[18]。另一方面,也可能由于选择效应或非加性效应,种群内较高的遗传多样性提高优势树种的稳定性和抗性,这一观点最近在草本植物中得到了证实[19-20],然而,这种机制在森林优势树种中是否存在尚不清楚。
3.2 植物群落结构是维持生态系统稳定性的主体
森林生态系统植物群落结构、树种组成特征对病原物和害虫种群数量的影响集中体现在“多样性—稳定性”(diversity-stability hypothesis)[21]和“联合抗性”(associational resistance hypothesis)[22]两个假说的提出和验证,森林生物多样性的增加能有效减少害虫数量[17],或者寄主树木与临近的其它物种整体上会表现出“联合抗性”来降低病虫害的发生[23]。森林病虫害另一个调节机制来自于其食物链和食物网结构,即“Bottom-Up”和“Top-Down”机制,天然林中存在丰富的害虫天敌,能够有效地控制病虫害的发生[24]。这种机制在水生生态系统中有不少证据[25-26],但对于天敌持续控制森林有害生物以及天敌种群的自然维持与动态机制有待系统研究。
3.3 地下生态过程和地上系统结构稳定具有耦合效应 地下生物群落结构特征及其微环境是天然林生态系统长期自然演化发展的优化稳定动态系统[27]。地下—地上生态过程存在耦合效应,是森林生态系统稳定性的基本条件。地下生物群落通过影响地面植物实现各种生物共享物质、能源、信息资源。固氮菌、植物生长调节菌、促生根际细菌(PGPR)等地下微生物能够调节植物根系之间的信号传导,促进植物生理代谢,诱导和提高树木系统抗性,并影响植物群体结构、生产力和营养循环[27]。
4 生态调控是森林病虫灾害综合防治的核心
作为21世纪植物保护的策略,综合防治与林业可持续发展理念相融合,同样是控制森林病虫害的根本途径和方向。然而,与农田等生态系统相比,森林生态系统作为陆地生态系统的主体,其结构最复杂、物种资源最丰富,明显有别于其它陆地生态系统。随着天然林生态系统越来越显示出对病原物和害虫具有自我调控能力的稳定特性和优势,森林病虫害综合治理被赋予了新的内涵。森林病原物与害虫是天然林和人工林生态系统的有机组成部分,而生态系统的结构和功能决定了森林对病原物和害虫具有独特的自我调控和补偿能力,特别是自我恢复能力。因此,设计和调节森林生态系统的结构和功能,通过系统自组织潜能保持系统各组分的平衡,建立控制病虫害的生态调控模式,是天然林保护与恢复、人工林可持续经营的重要基础。
森林病虫灾害的生态调控(Ecological Pest Management,EPM)策略[28],强调以森林生态系统的生物多样性为基础,以系统结构为核心,以系统稳定性为目标,在病虫灾害形成过程中,根据系统性、可持续性和区域性原则,充分利用系统的自组织功能,调节以林木—病原物/害虫—天敌为主链条的食物网及其相关联的信息网关系,使病原物和害虫种群低于生态和经济以及社会的允许水平,以促进森林生态系统健康和林业可持续发展。
天然林生态系统具备调控病虫害能力的根本原因在于以复杂的物种多样性为基础形成的食物网络关系。天然林病原物和害虫不仅与森林优势树种间存在复杂的生态关系,也与天然林生态系统的生物多样性、结构复杂性和生境异质性等相互关联。其中,结构复杂性是天然林生态系统发挥较高耐害御灾能力,实现病虫害生态调控的基础。从结构和功能方面研究天然林生态系统调控病虫害的生物信息网络和食物网络体系结构,揭示森林生态系统的自我维持机制,成为森林保护学科发展与创新的必然方向。
人工林生态系统抵御病虫灾害的能力比天然林生态系统低下,其结构的相对单一和不稳定性是病虫灾害极易暴发的根源。通过借鉴天然林生态系统自我调控病虫害的机制,探索以经营技术为主的调控病虫害的模式,实现人工林生态系统对病虫灾害的生态调控,是我国森林病虫灾害可持续控制的重要发展方向。
5 当前我国森林保护亟待解决的若干科学问题
森林病虫害生态调控强调在生产安全和生态安全的国家目标下,识别病虫灾害分布的格局,揭示灾害形成的遗传机制和生态机制,把握灾害发生的生态过程,揭示和解释森林生态系统调控病虫灾害的结构和功能;在此基础上,通过设计构建森林系统优化结构和输入人为调控措施,恢复和强化人工林生态系统调控病虫灾害的功能,将灾害控制在森林生态系统允许的阈值水平之下。
因此,森林重大病虫灾害生态调控的基础理论,即是针对“森林病虫灾害形成与流行的生态过程与机制”、“森林生态系统调控病虫害的自组织驱动机制”和“人工林经营调控病虫害的生态机理”三大关键科学问题,在个体、种群、群落、生态系统等不同层次开展森林重大病虫灾害的形成机理、天然林系统调控病虫害的优化结构、以及生态调控模式对人工林病虫害持续控制的机理等研究,构建和发展森林病虫灾害生态调控的理论体系。
5.1 森林病虫灾害形成与流行的生态过程与机制
为什么人工林病虫害常常暴发成灾?森林病原物和害虫作为森林生态系统的有机组成部分,在生物及非生物等外界因素干扰下,或者森林生态系统功能退化或紊乱时,病原物及害虫相关控制因子失调,其空间格局、种群密度、结构及遗传性状、生活史发生变化,引起寄主抗性丧失,分布区域扩大,最终导致灾害的暴发和流行。
森林病虫灾害形成与流行的生态过程与机制的内涵是揭示森林生态系统中病原物及害虫种群生物学和遗传学变异规律及适应性、环境—寄主—病原物或害虫系统内种间协同进化特征、环境胁迫诱导的病原物和害虫生物学特性等,进而解析灾害地理分布空间格局的形成及地理扩张的分子生态学基础,为生态调控策略与技术的发展提供理论基础。
5.2 森林生态系统调控病虫害的自组织驱动机制
为什么像天然林那样稳定的森林生态系统一般没有病虫害暴发?在天然林生态系统中,病原物及害虫种群密度一般稳定在森林生态系统允许水平之下,这种动态稳定性源于复杂的生物多样性冗余结构赋予了森林生态系统自我调控病虫害的功能。森林生态系统的组成与结构多样性及其变化涉及从个体、种群、群落、生态系统等不同的时空尺度,交织着复杂的生态学过程。
森林生态系统调控病虫害的自组织驱动机制的内涵是揭示森林生态系统不同尺度下生物多样性、食物网和异质生境等结构及其叠加功能与病虫害发生动态的关系,评价和识别优化结构及其形成的生态过程,解析物理环境资源配置、化学它感抑制作用、营养循环以及系统动力学等生态系统的自组织功能对病虫害的调控机制,进而产生不同层次的生态调控模式,构建森林生态系统自我调控理论体系。
5.3 人工林经营调控病虫害的生态机理 人工林如何模拟天然林实现病虫害的持续控制?在人工林生态系统中,贫乏的生物多样性、单纯的林分结构和龄期结构等特点,使得病原物及害虫群体数量往往在某些环境胁迫条件下出现剧烈波动,灾害形成、暴发并流行,仅靠发挥人工林系统结构自身实现病虫灾害的调控是极其困难的,需要通过经营技术措施来补充和改善人工林系统结构,增强其调控病虫害的功能。
人工林经营调控病虫害的生态机理的内涵是揭示人工林经营技术如树种结构优化、微生态环境调控、抚育管理和封山育林等措施,调节物质循环和能量流动的机理,以及人工释放天敌后持续控制害虫的生物链机制,从而解析不同生态调控模式对人工林病虫灾害可持续调控的内在作用,形成森林生态调控理论与防治基础。
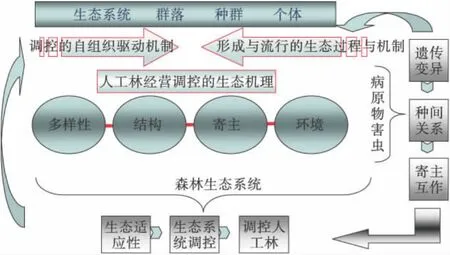
图1 森林重大病虫灾害生态调控理论体系的构建思路
森林病虫害的生态调控强调从个体到生态系统水平解析病虫灾害形成与流行的生态过程与机制,以及从生态系统到个体水平解析森林生态系统调控病虫害的自组织驱动机制,进而汇聚到多样性、结构、寄主和环境等4个调控节点来解析人工林经营调控病虫灾害的生态机理。从相互衔接的6个方面分层次回答每个大科学问题需要解决的若干具体科学问题(图1)。以森林病原物与害虫为核心,着重回答第一大科学问题。从分子、细胞、个体、种群水平研究森林病原物和害虫群体遗传结构及其变异,揭示广布型病虫灾害遗传变异规律和响应环境变化的分子生态机制(方面1—遗传变异);以“寄主—害虫/病原微生物—伴生微生物”等多种生态元构成的网络联系为模式体系,研究种间作用在重要病虫害定殖扩张中的协同效应(方面2—种间互作);以及寄主防御形成的生理生态学及分子机制,从分子、细胞、组织和个体交流等层次解析寄主植物降低病原物危害和抑制害虫种群形成的信息与代谢调控途径,揭示病虫害形成过程中协同进化的生态、生理、化学和分子机理(方面3—与寄主互作)。
相平行地,以发生病虫害和产生调节功能的森林生态系统为核心,回答第二、第三大科学问题。针对病虫害地域性空间分布特点,界定环境胁迫下病虫灾害发生的生态过程及对气候等环境条件变化的响应机制,揭示重大病虫害扩散与流行的生态适应性基础研究(方面4—生态适应性);从树种多样性、群落结构复杂性和生境异质性等方面,围绕稳定的森林生态系统调控病虫灾害的生态过程,揭示森林生态系统自组织对病虫害的多途径协调功能,以及优化结构形成的生态学过程,在明确系统自我调控病虫害模板(方面5—生态系统调控)的基础上,研究培育措施、植物种类合理配置等平面嵌合设计的化感抑制效应;间伐、土壤生态保健等垂直结构设计对寄主抗性的作用;引入天敌、有益微生物等食物网设计对物质循环的平衡效应,及其在林间的宿存能力与持续控灾机制;揭示环境协调性药剂的作用机理;阐明不同经营技术的设计和布局对人工林系统调控病虫灾害的功能(方面6—人工林生态调控模式),提供生态调控技术产出的理论基础。
[1] 宋玉双,苏宏钧,于海英,等.2006-2010年我国林业有害生物灾害损失评估[J].中国森林病虫,2011,30(6):1 -4,24.
[2] 张星耀,吕全,冯益明,等.中国松材线虫病危险性评估及对策[M].北京:科学出版社,2011:1-11.
[3] Lu Q,Decock C,Zhang X Y,et al.Ophiostomatoid fungi(Ascomycota)associated with Pinus tabuliformis and Dendroctonus valens(Coleoptera)in northern China and an assessment of their pathogenicity on mature trees[J].Antonie van Leeuwenhoek,2009,96:275 -293.
[4] Barres B,Halkett F,Dutech C,et al.Genetic structure of the poplar rust fungus Melampsora larici-populina:Evidence for isolation by distance in Europe and recent founder effects overseas[J].Infection,Genetics and Evolution,2008,8:577 -587.
[5] Toju H,Fukatsu T.Diversity and infection prevalence of endosymbionts in natural populations of the chestnut weevil:relevance of local climate and host plants[J].Molecular Ecology,2011,20(4):853 -868.
[6] Kikuchi T,Cotton J A,Dalzell J J,et al.Genomic insights into the origin of parasitism in the emerging plant pathogen Bursaphelenchus xylophilus[J].PLOS Pathogens,2011,7(9):e1002219.
[7] Kaplan I,Denno R F.Interspecific interactions in phytophagous insects revisited:a quantitative assessment of competition theory[J].Ecol,Let,2007,10:977 - 994.
[8] Cardoza Y J,Moser J C,Klepzig K D,et al.Multipartite symbioses among fungi,mites,nematodes,and the spruce beetle,Dendroctonus rufipennis[J].Environmental Entomology,2008,37:956-963.
[9] Scott J J,Oh D C,Yuccer M C,et al.Bacterial protection of beetle-fungus mutualism[J].Science,2008,322:63.
[10] Niu H,Zhao L L,Lu M,et al.The ratio and concentration of two monoterpenes mediate fecundity of the pinewood nematode and growth of its associated fungi[J].PLOS ONE,2012,7(2):e31716.
[11] 孙志强,张星耀,梁军,等.景观病理学:森林保护学领域的新视角[J].林业科学,2010,46(5):151 -160.
[12] Cairns D,Lafon C,Waldron J,et al.Simulating the reciprocal interaction of forest landscape structure and southern pine beetle herbivory using LANDIS[J].Landsc Ecol,2008,23:403 -415.
[13] Jonsson A M,Harding S,Barring L,et al.Impact of climate change on the population dynamics of Ips typographus in southern Sweden[J].Agr Forest Meteorol,2007,146:70 - 81.
[14] Worrall J J,Egeland L,Eager T,et al.Rapid mortality of Populus tremuloides in southwestern Colorado,USA[J].For Eco Manage,2008,255:686 -696.
[15] Anderson P K,Cunningham A A,Patel N G,et al.Emerging infectious diseases of plants:pathogen pollution,climate change and agrotechnology drivers[J].Trends Ecol & Evol,2004,19(10):535-544.
[16] Cardinale B J,Srivastava D S,Duffy J E,et al.Effects of biodiversity on the functioning of trophic groups and ecosystems[J].Nature,2006,443:989 -992.
[17] Jactel H,Brockerhoff E G.Tree diversity reduces herbivory by forest insects[J].Ecol Let,2007,10:835 - 848.
[18] Krstin L,Novak-Agbaba S,Rigling D,et al.Chestnut blight fungus in Croatia:diversity of vegetative compatibility types,mating types and genetic variability of associated Cryphonectria hypovirus[J].Plant Pathol,2008,57:1086 -1096.
[19] Johnson M T,Lajeunesse M J,Agrawal A A.Additive and interactive effects of plant genotypic diversity on arthropod communities and plant fitness[J].Ecol Let,2006,9:24 - 34.
[20] Crutsinger G M,Collins M D,Fordyce J A,et al.Temporal dynamics in non-additive responses of arthropods to host-plant genotypic diversity[J].Oikos,2008,117:255 -264.
[21] McCann K S.The diversity-stability debate[J].Nature,2000,405:228-233.
[22] Barbosa P,Hines J,Kaplan I,et al.Associational resistance and associational susceptibility:having right or wrong neighbors[J].Annu Rev Ecol Evol Syst,2009,40:1 -20.
[23] Kitching R L.Food webs in phytotelmata:“Bottom-Up”and“Top-Down”explanations for community structure[J].Annu Rev Entomol,2001,46:729 -760.
[24] Terborgh J,Lopez L,Nunez P,et al.Ecological meltdown in predator-free forest fragments[J].Science,2001,294:1923 -1926.
[25] Schmitz O J.Effects of predator hunting mode on grassland ecosystem function[J].Science,2008,319:952 -954.
[26] Copley J.Ecology goes underground[J].Nature,2000,406:452-454.
[27] Richardson A,Barea J,McNeill A,et al.Acquisition of phosphorus and nitrogen in the rhizosphere and plant growth promotion by microorganisms[J].Plant and Soil,2009,321:305 -339.
[28] Tshernyshev W B.Ecological pest management(EPM):general approaches[J].Journal of Applied Entomology,1995,119:379 -381.
