食管癌RUNX3蛋白的表达特点及意义
2012-01-17牟妍舒赵晟罡
牟妍舒,赵晟罡,李 岩
(1.鞍山市第四医院 放疗科,辽宁 鞍山 114034;2.大连医科大学 解剖学教研室,辽宁 大连116044)
食管癌癌变过程涉及多种癌基因的激活与抑癌基因的失活,其中RUNX3 即是其中一种新近发现的抑癌基因[1]。RUNX3隶属于runt结构域转录因子家族,与人类胚胎时期神经系统发育、免疫功能发育及肿瘤发生有密切的关系。其作为RUNX家族中长度最小的一个成员,主要参与胚胎发育过程中的细胞基因表达调控。对诸多肿瘤的研究可见,RUNX3表达失调伴随着肿瘤细胞的去分化,极性消失,肿瘤区新血管生成,引起肿瘤浸润能力增强以及淋巴结转移率增高,且预示患者预后不良[2]。这提示,RUNX3表达失调有可能成为肿瘤早期诊断、恶性程度判定及患者预后预测的潜在生物标志物。但RUNX3与食管癌的相关性研究并不多见。本研究以癌旁相对正常食管上皮、癌前病变组织、食管癌标本为研究对象,通过高通量组织微阵列,运用免疫组织化学方法,检测RUNX3在上述组织中的表达情况和分布特点,分析该基因的表达与食管癌各病理特征之间的关系,以探讨RUNX3在食管癌中的病理学意义。
1 材料和方法
1.1 实验材料
诊断明确未经放化疗的术后切除样本癌旁相对正常组织9例、癌前病变38例与食管癌组织83例,均来自1999-2008年鞍山市肿瘤医院。83例食管癌患者,男性70例,女性13例,年龄31~78岁,平均(59.8±10.83)岁。组织病理学,鳞癌68例,腺癌15例;高分化27例,中分化40例,低分化16例。
1.2 实验方法及结果判定
运用石蜡包埋组织芯片技术制成组织微阵列,采用免疫组织化学染色(Immunohistochemical,IHC)法,按照SP试剂盒说明书进行染色,抗体为兔抗人RUNX3多克隆抗体(北京博奥森),DAB显色。染色阳性反应为呈现棕黄色颗粒,定位于细胞浆及细胞核中,判定标准[1]:细胞浆中无着色的为阴性(-);与未加一抗的阴性对照比较,着色略深的为弱阳性(+),较深的为阳性(++),明显加深的则为强阳性(+++)。其中前二者记为低表达,后二者为高表达。本文将高表达记为表达。
1.3 统计学方法
采用SPSS11.0软件进行统计学分析,以Kruskal-Wallis 和Mamm Whitney检验对RUNX3在不同病变组织中的表达进行分析,P<0.05为差异有显著性意义。
2 结 果
2.1 RUNX3在不同病变组织中的表达特点
RUNX3蛋白在不同病变中的表达情况见表1、图1。食管癌组表达率42.2%,明显低于癌旁组(77.8%)和癌前病变组(78.9%),P<0.05。但癌旁组和癌前病变组比较差异无显著性意义(P>0.05)。食管癌组鳞癌(38.2%)和腺癌(60.0%)比较差异也无显著性意义(P>0.05)。
2.2 RUNX3的表达与临床病理参数的关系
RUNX3的表达在性别、年龄、分化程度和病变大小方面差异均无显著性意义(P>0.05)。淋巴结转移组RUNX3表达率(22.7%)显著低于无淋巴结转移组(64.1%),差异有显著性意义(P<0.05);在 T3、4期(31.0%)较T1、2期(68.0%)明显下调,差异有显著性意义(P<0.05);而RUNX3的表达率虽在III-IV期(32.5%)中低于I-II 期(51.2%),但差异无显著性意义(P>0.05)。见表2。
表1不同病变组织中RUNX3的表达
Tab1 Expression in different EC pathological lesionn(%)
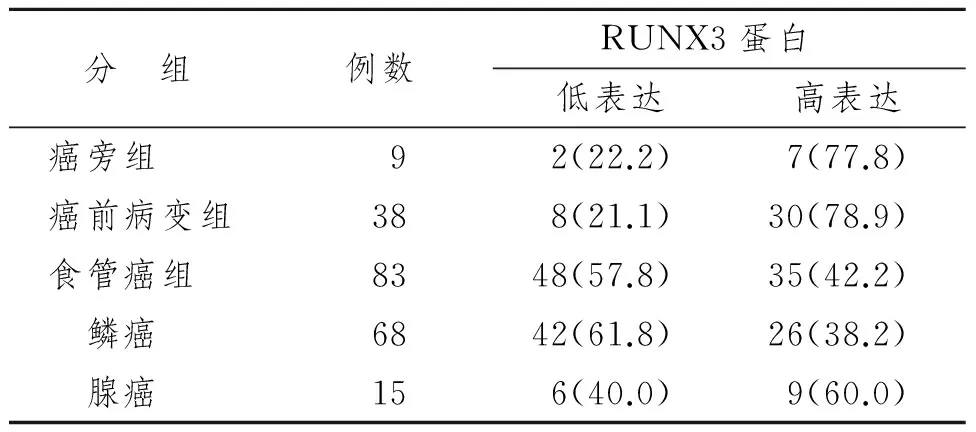
分 组 例数 RUNX3蛋白低表达高表达癌旁组92(22.2)7(77.8)癌前病变组388(21.1)30(78.9)食管癌组8348(57.8)35(42.2) 鳞癌6842(61.8)26(38.2) 腺癌156(40.0)9(60.0)
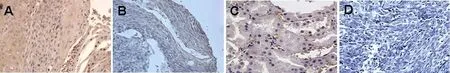
图1 RUNX3在不同病变食管癌组织中免疫组织化学染色 Fig 1 RUNX3 expression in different tissues

例数RUNX3低表达高表达P性别>0.05 男7035(50.0)35(50.0) 女137(53.8)6(46.2)年龄(岁)>0.05 <604020(50.0)20(50.0) ≥604328(65.1)15(34.9)分化程度>0.05 高分化277(25.9)20(74.1) 中分化4029(72.5)11(27.5) 低分化1612(75.0)4(25.0)病变大小(cm)>0.05 <4128(66.7)4(33.3) 4~85728(49.1)29(50.9) ≥81412(85.7)2(14.3)淋巴结转移<0.05 无3914(35.9)25(64.1) 有4434(77.3)10(22.7)浸润深度<0.05 未及浆膜(T1,2)258(32.0)17(68.0) 侵及浆膜(T3,4)5840(69.0)18(31.0)临床分期>0.05 Ⅰ-II4321(48.8)22(51.2) Ⅲ-IV4027(67.5)13(32.5)
3 讨 论
人类runt相关转录因子3(runt-related trans- cription factor 3, RUNX3)基因1994年被首次报道,它是转化生长因子-β(TGF-β)转导通路上的一个重要环节,参与了TGF-β上皮细胞生长的负调节过程[3-4]。现已有诸多相关报道证实,该基因是一种重要的抑癌基因,在多种肿瘤中呈现明显的下调趋势,与肿瘤的发生、发展以及预后等方面关系密切,在肿瘤的恶性转变过程中扮演重要角色[2]。
本研究结果显示,在食管癌癌旁相对正常组织和癌前病变中,RUNX3蛋白的表达为77.8%及78.9%,在食管癌组织中则下调至42.2%,较前两者有显著性差异。该基因表达的下调在病变≥8 cm的食管癌中尤为明显,蛋白表达率仅为14.3%,有淋巴结转移者RUNX3表达(34.1%)显著低于无淋巴结转移者(51.3%),且在肿瘤浸润及浆膜的病例中仅有31.0%表达蛋白,而未及浆膜病例表达率为68.0%,这说明RUNX3蛋白有可能作为食管癌诊断及侵袭转移预测的候选分子指标。大多数学者认为RUNX3表达下调乃至缺失的机制与基因启动子区甲基化关系密切[5]。Yan等[6]研究证实RUNX3基因甲基化状态与膀胱癌的预后及肿瘤进展直接相关,并可作为预测指标辅助肿瘤的分子诊断。Zheng等[7]检测了消化道肿瘤患者血清DNA中RUNX3基因启动子甲基化改变,发现其与肿瘤进展、淋巴结转移关系密切,可作为食管癌、胃癌和肝癌等消化道肿瘤早期诊断的分子靶点。在脑胶质瘤研究中,Mei等[8]证实恢复癌细胞RUNX3表达可强烈抑制细胞的侵袭迁移能力,这也为肿瘤的生物治疗提供了潜在的基因靶点。
目前食管癌的诊断依然是内镜结合黏膜活检的组织病理学检查方法,尚无一种或几种分子指标能够替代传统的诊断方法。临床上早期诊断的食管癌患者5年生存率可由10%提高到80%~90%,故探索食管癌发病早期的分子改变、筛选敏感的分子生物学指标、并尝试进行有效的基因、免疫治疗,对于食管癌高危人群具有重要临床意义。RUNX3作为有价值的潜在分子,其在食管癌抑癌中的确切机制及临床诊断治疗的应用还需进一步深入研究。
[1] Hiramatsu T, Osaki M, Ito Y, et al. Expression of RUNX3 protein in human esophageal mucosa and squamous cell carcinoma[J]. Pathobiology, 2005, 72:316-324.
[2] Bae SC, Choi JK. Tumor suppressor activity of RUNX3[J]. Oncogeng, 2004, 23(4): 4338-4340.
[3] Bangsow C, Rubins N, Glusman G, et al. The RUNX3 gene-sequence,structure and regulated expression[J].Gene, 2001, 279(2): 221-232.
[4] Guo C, Liu QG, Yang W, et al. Relation among p130Cas, RUNX3 and beta-catenin expression, clinicopathologic significance and prognosis in human hepatocellular carcinoma[J]. Hepatobiliary Pancreat Dis Int, 2008, 7(5): 490-496.
[5] Corn PG, Smith BD, Ruckdeschel ES, et al. RUNX3 expression is silenced by 5' CpG island methylation in acute leukemia[J]. Clin Cancer Res, 2000, 6(11): 4243-4248.
[6] Yan C, Kim YW, Ha YS, et al. RUNX3 methylation as a predictor for disease progression in patients with non-muscle-invasive bladder cancer[J]. J Surg Oncol, 2012,15, 105(4):425-430.
[7] Zheng Y, Zhang Y, Huang X, et al. Analysis of the RUNX3 gene methylation in serum DNA from esophagus squamous cell carcinoma, gastric and colorectal adenocarcinoma patients[J]. Hepatogastroenterology, 2011, 58(112): 2007-2011.
[8] Mei PJ, Bai J, Liu H, et al. RUNX3 expression is lost in glioma and its restoration causes drastic suppression of tumor invasion and migration[J]. J Cancer Res Clin Oncol, 2011, 137(12): 1823-1830.
