Wnt2与β-catenin蛋白在食管癌中的表达特点及病理意义
2012-01-17张云庆
李 韶,张云庆,徐 飞
(1.鞍山市第四医院 内科,辽宁 鞍山 114034;2.大连医科大学 解剖学教研室,辽宁 大连116044)
食管癌发生与发展涉及多基因、多途径的改变[1-2]。筛选特异敏感的分子指标用于食管癌的人群筛查,将对早期诊断和治疗食管癌,降低食管癌罹患及减少患者死亡、延长生存时间均有重要的意义。Wnt/β-catenin途径是经典的Wnt信号途径,其关键蛋白分别为Wnt蛋白、β-catenin 蛋白等。近年来诸多研究业已证实,Wnt2及β-catenin 与肿瘤的发生发展、侵袭转移以及患者预后不良关系密切。胃癌、肝癌、结直肠癌、胰腺癌、膀胱癌、前列腺癌和乳腺癌等癌症中均已证实上述结论[3-5],即Wnt与β-catenin正常表达的罹癌患者,其预后要优于那些Wnt与β-catenin表达上调的病人。提示Wnt与β-catenin表达失调可作为肿瘤恶性程度以及患者预后预测的生物标志物和早期诊断的重要候选分子指标。本研究通过组织芯片免疫组织化学技术,以癌旁相对正常食管上皮、癌前病变、食管癌组织为研究对象,检测Wnt2及β-catenin在上述组织中的表达情况和分布特点,分析其表达与食管癌各病理特征之间的关系。
1 材料和方法
1.1 实验材料
9例癌旁相对正常食管组织(癌旁正常组)、38例癌前病变(癌前病变组)及83例食管癌(食管癌组)标本均选自鞍山市肿瘤医院1999-2008年未经放化疗的诊断明确的食管癌手术切除标本。其中83例肿瘤患者中,男性70例,女性13例,年龄31~78岁,平均年龄(59.8±10.83)岁。鳞癌68例,腺癌15例,高分化27例,中分化40例,低分化16例,无淋巴结转移39例,有淋巴结转移44例。
1.2 实验方法
石蜡组织制成微阵列,采用免疫组织化学染色(Immunohistochemical,IHC)法,按照SP试剂盒说明书进行免疫组化染色,抗体为山羊抗人Wnt2与兔抗人β-catenin (Santa Cruz,1:100),DAB显色,苏木精复染,镜下观察。
1.3 结果判定
染色阳性反应为呈现棕黄色颗粒,Wnt定位于细胞浆中,β-catenin在细胞浆及胞核中。判定的标准是:胞浆无着色的为阴性(-);与未加一抗的阴性对照比较,着色略深的为弱阳性(+),较深的为阳性(++),明显加深的则为强阳性(+++)[6]。其中前二者记为低表达,后二者为高表达。本文将高表达记为表达。
1.4 统计学方法
采用SPSS11.0统计软件,应用Kruskal-Wallis、Mamm Whitney及相关性Spearmen的检验方法,对Wnt2与β-catenin在不同病变组织中的表达、分布与相关关系进行统计分析,以P<0.05为差异有显著性意义。
2 结 果
2.1 Wnt2与β-catenin在不同病变组织中的表达特点
免疫组织化学染色结果见表1和图1。从癌旁相对正常组织、癌前病变到食管癌组织,Wnt2表达率分别为22.2%、50.0%和72.3%;β-catenin蛋白的表达率分别为33.3%、47.4%和69.9%,二者均呈现逐渐升高的趋势,差异有显著性意义(P<0.05)。食管癌组同癌旁正常组、癌前病变组比较,差异均有显著性意义(P<0.05),食管癌癌旁正常组和癌前病变组比较,差异无显著性意义(P>0.05)。鳞癌中两种蛋白表达率(77.9%、75.0%)均显著高于腺癌(46.7%、46.7%),P<0.05。
2.2 Wnt2与β-catenin的表达与肿瘤临床病理参数的关系
Wnt2与β-catenin的表达在性别、年龄、分化程度和病变大小的比较中,差异无显著性意义(P>0.05)。但两者在食管癌淋巴结转移组表达率(86.4%、81.8%)显著高于无淋巴结转移组(56.4%、56.4%) (P<0.05);侵润深度 T3、4组表达率(81.0%、82.8%)也明显高于T1、2 组(52.0%、40.0%)(P<0.05);Wnt2蛋白表达在临床I-II期及III-IV期患者标本中分别为62.8%和82.5%,后者显著高于前者(P<0.05),β-catenin表达在临床I-II期(76.7%)高于III-IV期(62.5%),但差异无显著性意义(P>0.05)。见表2。

表1 不同病变食管癌组织中Wnt2与β-catenin的表达Tab 1 Wnt2 and β-catenin expression in different EC pathological lesion n(%)

Wnt2 β-catenin图1 Wnt与β-catenin在不同病变组织中的表达Fig 1 Wnt and β-catenin expression in different tissues
2.3 Wnt2与β-catenin表达的相关性
Wnt2低表达时,β-catenin也低表达的有42例,高表达有7例;Wnt2高表达时,β-catenin也高表达的有72例,低表达有7例。经Spearman相关性分析显示,二者呈正相关关系(P<0.05,r=0.740)。
3 讨 论
癌基因和抑癌基因的发现,细胞信号通路的阐明,极大丰富了人们对细胞癌变机制的认识。目前报道中,Wnt途径异常存在于人类多种肿瘤,如结直肠腺瘤和癌、乳腺癌、子宫内膜癌、胃癌、肝细胞癌、黑色素瘤、甲状腺癌、内皮样卵巢癌、前列腺癌、滑膜肉瘤、髓母细胞瘤等[3-4]。本研究的结果充分支持了Wnt信号途径在食管癌中促癌生长、侵袭的作用。Wnt2、β-catenin蛋白在食管癌癌旁、癌前病变及癌组织中的表达率分别从22.2%、33.3%上调至72.3%、69.9%,差异具有显著性意义,且Wnt2及β-catenin与食道癌侵袭转移密切相关,淋巴结转移组二者表达率分别为79.5%和81.8%,明显高于未见淋巴结转移组(56.6%、56.6%),浸润深度侵及浆膜者两蛋白表达率(81.0%、82.8%)亦显著高于未侵及浆膜层者(52.0%、40.0%),这说明Wnt2、β-catenin蛋白可成为潜在的判断食管癌病变程度以及预测肿瘤浸润趋势的分子指标,具有重要的病理学意义。
Wnt途径是细胞发育和调节生长的一个关键途径,不仅在胚胎发育中,在细胞癌变过程中亦具有重要作用[3,7]。这种变化可由Wnt基因本身或通路中任何成分发生改变而引发。Wnt途径的异常激活大致有以下几种情况:组成Wnt途径的蛋白、转录因子或基因被破坏或变异,导致该途径关闭或局部途径异常活跃;过多Wnt信号使整个途径异常活跃,细胞进行不必要的增殖;细胞内其他因素通过Wnt
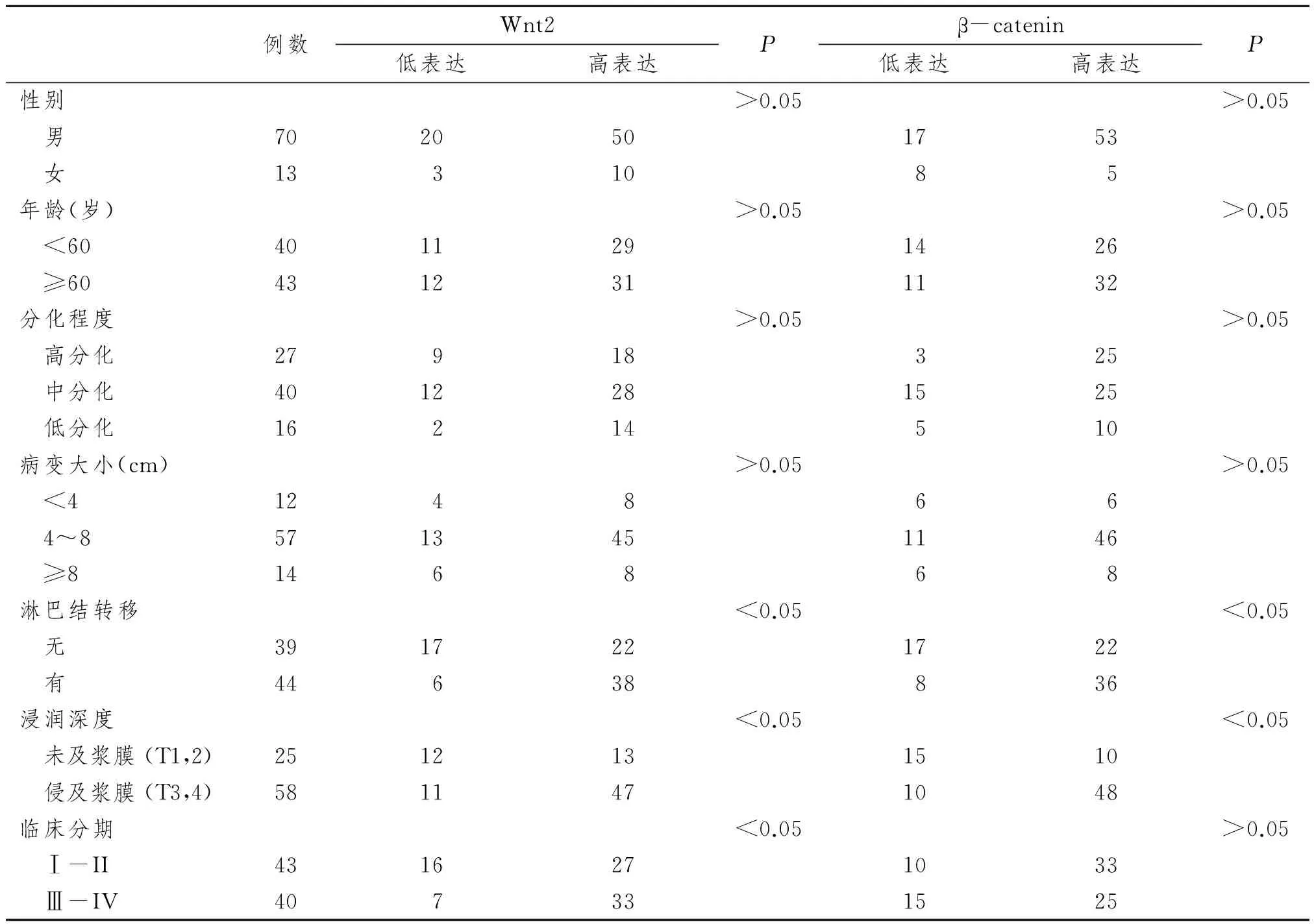
表2 Wnt2与β-catenin的表达与临床病理参数的关系Tab 2 The relationship between Wnt2, β-catenin expression and clinicopathological agents (n)
途径来刺激或诱发细胞乃至机体产生异常反应。最终结果是Wnt 途径的靶基因组成性激活及细胞增生的失控。Fu等[8]认为间质成纤维细胞分泌的Wnt2促进了Wnt途径的激活从而导致了肿瘤的进展,Sato等[9]的研究则显示Wnt抑制剂在肿瘤免疫治疗中作用显著,而体外SiRNA干预Wnt表达的实验显示肿瘤细胞对化疗药物敏感性有所增强,这些都为肿瘤治疗提供了新的方法和思路。
[1] Moyes LH, Going JJ. Still waiting for predictive biomarkers in Barrett's oesophagus[J]. J Clin Pathol, 2011, 64:742-750.
[2] Lordick F. Current standard and trends in oesophageal cancer[J]. Eur J Cancer, 2011, 47: S353-S354.
[3] Buechling T, Boutros M. Wnt signaling signaling at and above the receptor level[J]. Curr Top Dev Biol, 2011, 97:21-53.
[4] Morin PJ, Sparks AB, Korinek V, et al. Activation of β-catenin-Tcf signaling in colon cancer by mutations in b-catenin or APC[J]. Science, 1997, 275:1787-1790.
[5] Li H, Sun Y, Kong QY, et al. Combination of nucleic acid and protein isolation with tissue array construction: using defined histologic regions in single frozen tissue blocks for multiple research purposes[J]. Int J Mol Med, 2003, 12:299-304.
[6] Agerbaek M, Alsner J, Marcussen N, et al. Focal S100A4 protein expression is an independent predictor of development of metastatic disease in cystectomized bladder cancer patients[J]. Eur Urol, 2006, 50:777-785.
[7] Behrens J, Lustig B. The Wnt connection to tumorigenesis[J]. Int J Dev Biol, 2004, 48:477-487.
[8] Fu L, Zhang C, Zhang LY, et al. Wnt2 secreted by tumour fibroblasts promotes tumour progression in oesophageal cancer by activation of the Wnt/β-catenin signalling pathway[J]. Gut, 2011, 60(12):1635-43.
[9] Sato N, Yamabuki T, Takano A, et al. Wnt inhibitor Dickkopf-1 as a target for passive cancer immunotherapy[J]. Cancer Res, 2010, 70:5326-5336.
