中华蜜蜂有王群与无王群工蜂上颚腺10-HDA含量比较
2012-01-17吴丽丽黄少康李三妹蒋星宏
吴丽丽 黄少康 李三妹 蒋星宏
(福建农林大学蜂学学院,福州 350002)
反式-10-羟基-2-癸烯酸(10-HDA)是工蜂上颚腺的主要分泌物,也是王浆中最主要的不饱和脂肪酸之一[1]。它不仅是王浆的天然保鲜剂,而且是雌性蜜蜂幼虫级型发育过程中重要的调控因子[2]。由于上颚腺与级型发育的关系,很早就受到研究者的关注,对不同蜂种的蜂王、工蜂上颚腺中10-HDA的检测已有不少报道。如,Plettner et al.(1993)对西方蜜蜂(Apis mellifera)的无王群采集蜂、有王群工蜂、产卵工蜂等的上颚腺10-HDA进行比较,未发现它们的10-HDA含量上有显著差异[3]。Plettner (1997)对5种蜜蜂的蜂王和工蜂上颚腺中包括10-HDA在内的多种成分进行了检测,检测表明,采自加拿大的西方蜜蜂越冬工蜂10-HDA含量高达95±15µg,采自马来西亚的大蜜蜂(Apis dorsata)采集蜂的含量达56,从斯里兰卡Horana采集的东方蜜蜂(A. cerana)外勤工蜂中仅检测到0.8±0.2µg/bee,黑小蜜蜂(A.andreniformis)工蜂为3.2±0.5µg/bee,小蜜蜂(A.florea)工蜂为11±1µg/bee。说明不同蜂种间工蜂,蜂王及工蜂间上颚腺10-HDA[4]等内容物含量存在显著差异。
蜂王的存在是蜂群完整性与稳定性的标志,蜂王上颚腺分泌物具抑制工蜂体内咽侧体活性,进而延迟工蜂的出巢日龄的作用[5]。有王蜂中,工蜂各项活动秩序井然;一旦失王,蜂群生物学特性以及工蜂腺体分泌物会发生显著性变化,这在海角蜜蜂中表现得尤其明显,室内无王笼养的海角蜜蜂工蜂上颚腺分泌物会逐渐向蜂王方向转化,逐渐以9-ODA为主[6]。对无王和有王状态下小蜜蜂(A.florea)工蜂上颚腺10-HDA的检测显示,无王群工蜂平均含7.4µg/bee,有王群工蜂平均含10.1µg/bee,两者之间有显著差异[7],说明蜂王的有无对工蜂上颚腺10-HDA有影响。与西方蜜蜂相比,中蜂(A.cerana cerana)是一种对失王状态更为敏感的蜂种,中蜂群失王后,群内出现产卵工蜂的时间常常比西方蜜蜂短,那么,无王后,中蜂工蜂上颚腺的分泌物是否也会有所变化?在此,在有无和无王状态下我们对中蜂工蜂上颚腺主要的分泌物10-HDA含量进行了测定和比较,结果发现无王群工蜂10-HDA的含量极显著高于有王群工蜂,现具体报道如下。
1 材料与方法
1.1 材料
1.1.1 中蜂群
中蜂由福建农林大学蜂学学院提供,每群群势为3~4足框。有王群9群,无王群7群。无王群失王1~2周,群内无子、无工蜂产卵现象。
1.1.2 主要仪器与试剂
LC-20A高效液相色谱仪(日本岛津)(色谱柱:4.6mm×250mm不锈钢柱,填充物不定形硅胶C18键合相,10μm);SPD-M20A二极管阵列检测器(日本株式会社岛津制作所);KQ-300VDE型双频数控超声波清洗器(昆山市超声仪器有限公司);SHB-III循环水式多用真空泵(北京博医康实验系统有限公司);流动相过滤装置(津腾)。有机滤膜(0.45μm),一次性5ml针筒,10ml容量瓶,玻璃研磨器等。
甲醇(色谱纯,德国MECK集团有限公司);无水乙醇,磷酸(优级纯GR),对羟基苯甲酸甲酯(分析纯,含量99.0%),由国药集团化学试剂有限公司生产;10-HDA标准品(纯度99.6%,湖北扬子江蜂业公司)。
1.2 方法
1.2.1 取样
2010年6月10日,分别在10群中蜂有王群的巢门口抓取回巢的外勤蜂,每箱抓取工蜂约100只。从失王1~2周的7群无子、无王群中,提脾,每群取工蜂约100只以上,于-80℃冷冻保存。
1.2.2 试液的配置
(1)10-HDA标准品储备液配制
称取干燥后的10-HDA标准品0.0305g,用无水乙醇溶解并移入50ml容量瓶中定容。此溶液每毫升含10-HDA 0.61mg。
(2)内标溶液配制
称取干燥过的对羟基苯甲酸甲酯0.1671g,加无水乙醇溶解并移入250ml容量瓶中,用无水乙醇稀释至刻度,摇匀。此溶液每毫升含对羟基苯甲酸甲酯0.6684 mg。
(3)样品溶液制备
剪取同群10只工蜂头部,放入一研磨器中,加入少量甲醇研磨,用超声波清洗器超声5min促使其溶解。把研磨液移入已经加入1ml内标溶液的10毫升容量瓶中。研磨器润洗2~3遍,润洗后的液体也移入容量瓶内,最后加甲醇定容,超声40min后静置过夜。用0.45μm滤膜过滤,滤液即为一待测样本。每群制备5个样本,无王群与有王群待测样本均同法制备。
1.2.3 色谱方法学检测
(1)线性关系考察
精密量取10-HDA标准品储备液0.2、0.5、1.0、2.0、4.0至10.0ml容量瓶中。精密加入内标溶液1ml,用无水乙醇稀释至刻度,摇匀。分别吸取10μl注入液相色谱仪,210nm测定。结果表明,10-HDA进样量(X)在0.122~2.44μg范围内与峰面积(Y)呈现良好的线性关系。回归方程Y=2×10-5X+1.0167,R2=0.9999。
(2)精密度试验
自动进样10-HDA标准品10μl,重复进样5次,测得10-HDA峰面积相对标准偏差(RSD)为0.6%(n=5),进样方法和仪器精密度良好。
(3)稳定性试验
精密吸取中蜂工蜂头部样品10μl进样分析,分别于1h、4h、8h、12h、24h时重复一次,测得10-HDA峰面积的RSD为1.2%,表明样品溶液在24h内稳定。
(4)加样回收率试验
准确称取已知10-HDA含量的样本,分别加入适量的10-HDA标准品,制备样品溶液,进样10μl,测得10-HDA的回收率均在95%以上。
1.2.4 样品10-HDA含量测定
取待测样品,按以下色谱条件进样测定。色谱柱:20RBAX Eclipse XDB-C18,(250mm×4.6mm,5μm);流动相:甲醇-0.2%磷酸溶液(55:45);流速:1.0mL/min;检测波长:210nm;进样量:10μl。
1.2.5 数据分析
根据标准曲线法对HPLC检测所得10-HDA的峰面积换算得到工蜂10-HDA的含量。用SPSS软件中Levene test进行方差齐性检验,对方差齐性数据用one-way ANOVA中的LSD法对进行多重显著性分析,对方差不齐的数据组用one-way ANOVA中Dunett T3法进行多重显著性分析。用t-test对无王群和有王群工蜂10-HDA的含量进行差异比较。
2 结果与分析
对中蜂有王群10群及无王群7群工蜂上颚腺10-HDA含量的检测结果见表1。有王群中,每只工蜂头部10-HDA的平均含量为2.75±1.05µg(N=50)。不同蜂群间工蜂上颚腺10-HDA含量方差不齐,存在显著差异(Levene test,P=0.02<0.05),故采用SPSS中unequal variance ANOVA的Dunett T3进行多重显著性检验,检验结果表明,1号群的10-HDA含量显著低于4、6、7号群(p=0.014,0.006,0.02<0.05)。7号群外勤蜂10-HDA含量。
平均含量高达4.76±0.41µg,显著高于1,2,3群(P=0.02,0.05,0.032≤0.05)。2,3,4,5,8,9,10号群间无显著差异(P>0.05),说明多数有王群间采集蜂的10-HDA含量无显著差异,仅个别蜂群(1和7号群)含量存在差异。由于我们的样本未明确日龄,还不能完全排除这种差异由日龄差异引起的可能性。
无王群工蜂10-HDA的平均含量为5.47µg(N=35),为有王群工蜂含量的2倍,极显著高于有王群工蜂(t-test,P=0.000<0.01)。因为无王群各群间数据方差齐性(Levene test,P=0.58>0.05),故采用LSD法进行多重显著性差异比较,结果显示,无王群中1号群工蜂10HDA平均含量均极显著高于2至7群(P=0.004,0.000,0.001,0.000,0.000,0.000<0.01),10-HDA平均含量达8.32µg,其余各群之间均无显著差异(P>0.05)。
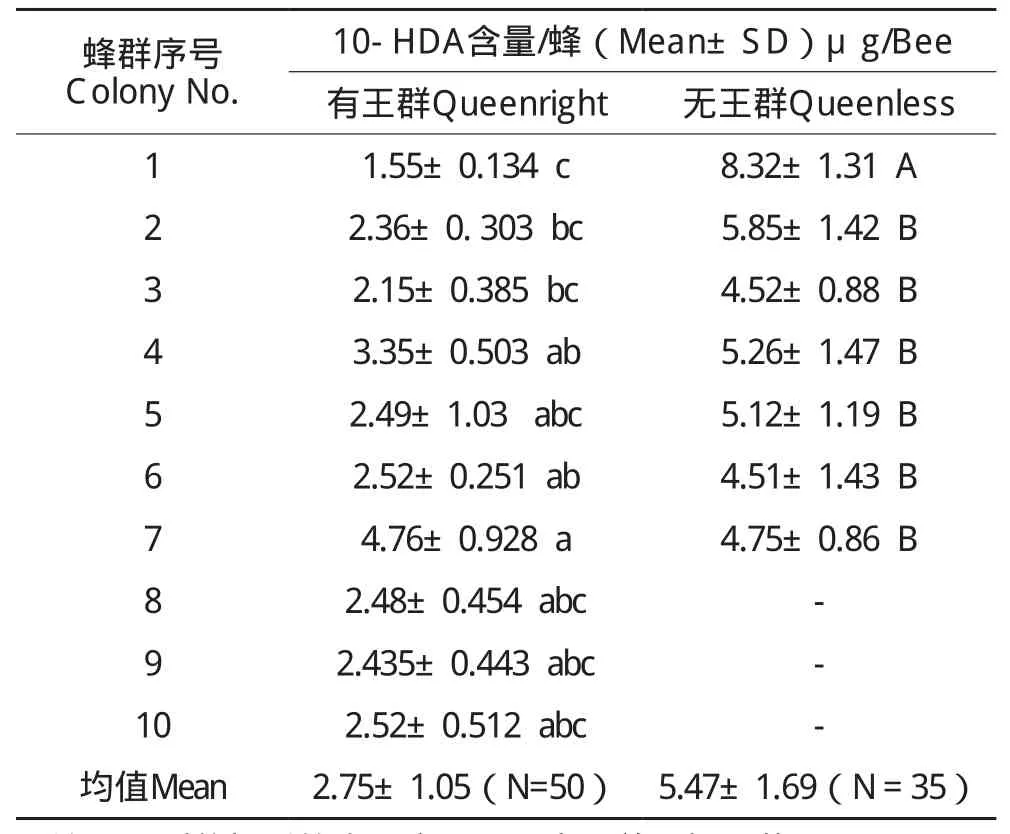
表1 中蜂有王群和无王群工蜂10-HDA含量比较
3 讨论
本试验中所选用的无王群均为群内无子(卵、幼虫、蛹),且无工蜂产卵现象,工蜂主要从事花蜜采集;有王群工蜂均为回巢的工蜂,主要从事的也是采集活动,它们都不需要承担育子的工作,上颚腺不需要为承担哺育幼虫而提供10-HDA,因此,蜂群对这些工蜂的功能需求可以认为是相近的,即两种样本之间的主要差异是有王与无王的差异。在有王状态下,蜂王上颚腺信息素对工蜂的生理和行为都具有显著的控制作用,能抑制工蜂上颚腺向蜂王方向转变,因此,我们认为,中蜂无王群工蜂10-HDA平均含量显著高于有王群工蜂的现象主要与蜂群的无王状态有关,即失无王状态导致中蜂群内工蜂的10-HDA含量显著上升,而这种变化的出现,可能是因为无王群中没有了蜂王上颚腺信息素抑制因子的存在,从而对工蜂咽侧体产生影响,进而影响保幼激素(JH)的分泌,再对上颚腺产生影响的调控途径完成。但本试验结果与小蜜蜂[7]中的报道现象不同,具体原因尚不清楚。因为本次没有对测试工蜂的日龄进行控制,所以仍有必要进一步研究加以验证,同时,搞清这种变化的内部生理机制有助于揭示10-HDA的调控机制。
[1] 徐响,孙丽萍,董捷. 蜂王浆中脂类脂肪酸组成的研究. 2009,30(14):213-214.
[2] Spannhoff A, Kim YK, Raynal NJ, et al. Histone deacetylase inhibitor activity in royal jelly might facilitate caste switching in bees. EMBO Rep. 2011,12 (3):238-43.
[3] Plettner E, Slessor K N, Winston M L, et al. Mandibular Gland Components and Ovarian Development as Measures of Caste Differentiation in the Honey Bee (Apis melliferaL.). J. Insect Physiol.1993, 39(3):235-240.
[4] Plettner E, Otis GW, Wimalaratne PDC. Species-and castedetermined mandibular gland signals in honeybees (Apis). Journal of Chemical, 1997, 23(2): 363-377.
[5] Pankiw T. , Huang Z.Y. , Winston M.L. , Robinson G.E. Queen mandibular gland pheromone influences worker honey bee. (Apis melliferaL.) foraging ontogeny and juvenile hormone titers. Journal of Insect Physiology. 1998,(44): 685-692.
[6] Simon U E, Moritz R F A, Crewe R M. The ontogenetic pattern of mandibular gland components in queenless worker bees(Apis mellifera capensisEsch). Journal of Insect Physiology. 2001, 47:735-738.
[7] Keeling CI, Slessor KN, Koeniger N, Koeniger G, Punchihewa PWK.Quantitative analysis of the mandibular gland components of the dwarf honey bee (Apis floreaFabricius). Apidologie. 2000,(31): 293-299.
