蜜蜂中肠一株耐氯霉素细菌的筛选与鉴定
2012-11-28陈大福陈梅强李江红
陈大福 陈梅强 李江红 梁 勤
(福建农林大学蜂学学院,福州 350002)
蜜蜂的肠道内栖息着相当数量的微生物类群。这些微生物对于蜜蜂的营养和代谢起着重要的作用。根据微生物与蜜蜂的关系可将其大致分为两类:病原微生物和共生菌。蜜蜂肠道内存在一定量的病原微生物,其中细菌性病原菌主要包括拟幼虫芽孢杆菌、蜂房球菌、尤瑞狄斯杆菌、粪链球菌、蜂房芽孢杆菌、败血病杆菌、尘埃芽孢杆菌等。其中对于引起美洲幼虫腐臭病的拟幼虫芽孢杆菌和引起欧洲幼虫腐臭病的蜂房球菌的研究报道最多。2006年,戎映君等分离了一种新的蜜蜂细菌性幼虫病病原菌,经分离鉴定此致病菌为肠球菌属的屎肠球菌[1]。蜜蜂与微生物的共生是一种普遍存在的现象,许多共生菌对蜜蜂的生长、发育起着重要作用。蜜蜂与其他昆虫抵御疾病可能是通过与其共生的微生物的屏蔽效应。Evans & Armstrong的研究表明,某些共生菌对蜜蜂主要病原细菌拟幼虫芽孢杆菌具有抑制效应,并且共生菌可能对普遍的病原体有自然的拮抗作用[2]。
细菌的16S rRNA因其编码基因集“保守、变异”于一身,作为生物系统指标最为合适[3]。不同种细菌基因序列的比较研究表明,16S rRNA基因在同种细菌间高度保守,因此,在细菌“种”水平的鉴定上,16S rRNA基因的全序列分析可作为“金标准”[4,5]。16S rRNA基因保守性又是相对的,在保守区间存在着9或10个变异区,不同细菌属、种间有不同程度的差异。因此,可利用保守区序列设计细菌通用引物将细菌16S rRNA片断扩增出来,利用可变区序列的差异来对不同菌属、菌种的细菌进行分类鉴定[6]。
本研究通过用含氯霉素的LB培养基筛选和分离蜜蜂中肠中的细菌,并运用PCR的方法体外扩增并克隆该细菌的16S核糖体RNA基因的片段序列,通过比对序列对细菌进行分类鉴定。
1 材料与方法
1.1 材料
意大利蜜蜂(Apis mellifera ligustica)采自福建农林大学蜂学学院教学蜂场;菌株是从意大利蜜蜂成年工蜂中肠中筛选分离培养所得。
1.2 方法
1.2.1 蜜蜂中肠细菌的筛选分离
制作若干含终浓度为20 μg/mL氯霉素的LB培养基,取成年蜜蜂中肠的内容物,捣碎加适当的灭菌水稀释搅匀,均匀涂布在培养基上,挑取菌斑,提取细菌基因组DNA。
1.2.2 细菌的裂解
用灭菌移液枪的枪头挑取单个菌斑,加入到含有200 μl细菌裂解液和1 μl蛋白酶K的离心管中,用震荡器将之混匀,置PCR仪中裂解反应。反应程序:65 ℃温育30 min,98 ℃裂解20 min,裂解反应结束后12000 rpm离心5 min取上清液6μl做PCR反应模板。
1.2.3 引物的设计与合成
在GenBank中检索出多种细菌的16 S rRNA基因序列,通过Blast软件在线进行同源性比较,在16S rRNA基因序列的保守序列区间设计通用引物。引物由上海生工生物有限公司合成。
1.2.4 细菌16s rRNA基因片段的克隆
1.2.4.1 聚合酶链式反应(PCR)
(1)反应体系:模板DNA(细菌裂解液)6 μl,10×PCR缓冲液5 μl,dNTPs 4 μl,引物F、R各2 μl,Taq酶2μl,补ddH2O至50 μl。
(2)反应程序:98 ℃预变性3 min,95 ℃ 变性45 s、52 ℃退火合成105 s、72 ℃延伸30 s,共30个循环,最后72 ℃延伸10 min,8 ℃保存。
1.2.4.216s rRNA基因片段的克隆与测序
本研究采用低熔点琼脂糖凝胶法,用DNA快速纯化回收试剂盒(北京鼎国昌盛生物技术有限责任公司产品)纯化回收PCR产物。利用pGEM-T Easy Vector SystemⅠ试剂盒(Promega)进行载体连接与转化,用质粒快速提取试剂盒(北京鼎国昌盛生物技术有限责任公司产品)提取质粒DNA,经限制性内切酶EcoRⅠ进行酶切鉴定。一般反应体系为:EcoRⅠ1 μl,10×Buffer 2 μl,质粒DNA 3 μl(≤1 μg),灭菌水补至20 μl。37℃温浴反应2~3 h。反应产物经琼脂糖凝胶电泳后,能切出相应片段的即为阳性。将鉴定为阳性克隆的菌液,委托生工生物工程有限公司进行测序。
2 结果与分析
2.1 引物的设计与合成
利用Primer-BLAST软件在线与细菌的16S rRNA基因片段序列进行多重比对分析各序列的保守区和变异区,设计并合成细菌16S rRNA基因片段序列的通用引物:
F:5'- GAGAGTTTGATCCTGGCTCAG-3'R:5'- CTACGGCTACCTTGTTACGA-3'
2.2 细菌16s rRNA基因片段序列的克隆
2.2.1 PCR扩增与产物回收
用设计的通用引物分别对DNA样品进行PCR扩增,使用DNA快速纯化/回收试剂盒回收PCR产物,溶解于20μl的TE溶液中。取5μl回收的产物经1.5 %(W/V)的琼脂糖凝胶电泳,可见到1500bp左右的单一条带非常清晰,说明回收得率较高(图1)。
2.2.2 重组质粒的酶切鉴定
将重组质粒DNA和原空载体质粒DNA分别用限制性内切酶EcoRⅠ进行酶切反应。反应产物经琼脂糖凝胶电泳。空载体质粒DNA经酶切后,仅产生2000bp以上的单一条带。而重组质粒DNA酶切产物中产生大小为750bp左右2个片段,该2个片段大小之和与1500bp左右的PCR产物基本相等(图2),酶切产生2个片段可能是PCR产物片段内部还有一个EcoRⅠ位点。因此,该重组质粒即可鉴定为阳性克隆。
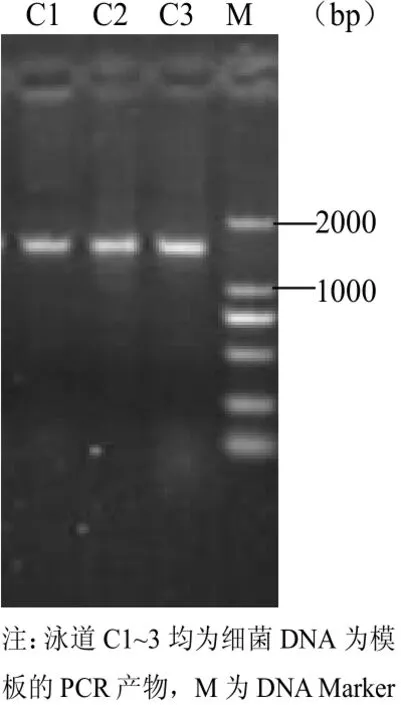
图1 细菌DNA的PCR产物纯化回收凝胶电泳图谱
2.3 16S rRNA基因片段的序列分析
将鉴定为阳性的克隆C3委托上海生工生物工程公司进行测序。测序结果表明所克隆的16S rRNA基因片段为1506 bp的DNA片断(图3)。使用RESEARCH软件查找结果如预计一样在第666位有一个EcoRI酶切位点,经EcoRI酶切为665bp和835bp的2个片段。
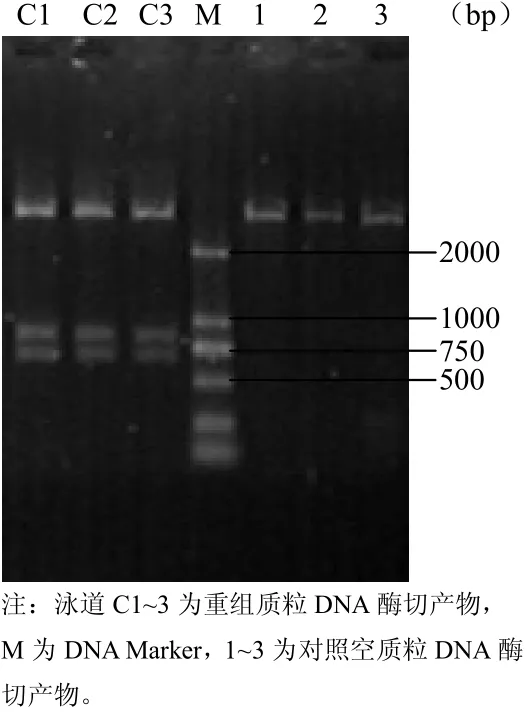
图2 重组质粒酶切鉴定

图3 细菌16S rRNA基因片段序列
2.4 耐氯霉素细菌菌株的鉴定
将所测得序列与NCBI(http://blast.ncbi.nlm.nih.gov/)GenBank收录细菌16S rRNA基因序列进行比对。结果可以搜索到大量细菌的16S rRNA基因片段序列与所测得细菌的序列有较高的相似度(图4)。该序列与GQ259887序列吻合度100 %,证明该序列为克雷伯氏菌(Klebsiella pneumoniae)的特有序列,说明从蜜蜂中肠中培养分离出的耐氯霉素细菌菌株为克雷伯氏菌。
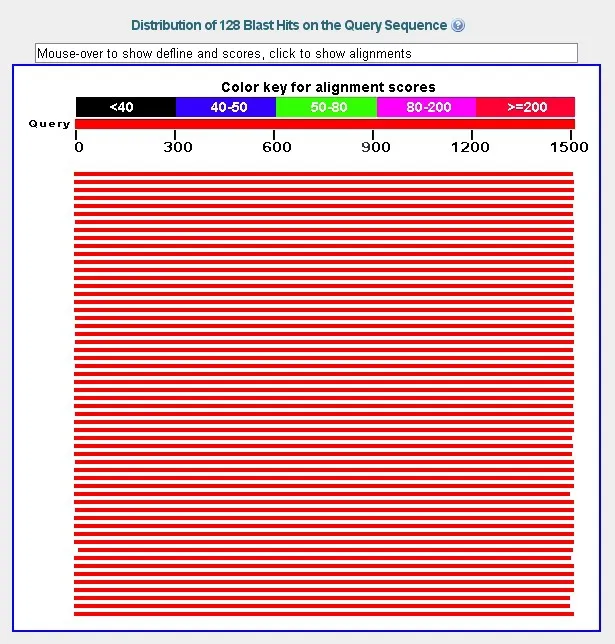
图4 所测细菌的16S rRNA基因片段序列与数据库比对结果
4 讨论
(1)细菌16S rRNA鉴定方法作为分子生物学快速发展的产物,与传统的诊断方法相比,准确性和灵敏度均有了较大的提高。由于l6S rRNA序列的保守性和存在的普遍性,以及核酸序列本身的稳定性,序列分析的重现性极高,基于当今分析技术的改进,应用16S rRNA作为分子指标,可以实现快速、微量、准确简便的对微生物进行分类鉴定。
(2)本研究从蜜蜂中肠分离出的耐氯霉素菌株经鉴定为克雷伯氏菌。克雷伯氏菌为肠杆菌科中一类有荚膜的革兰氏阴性杆菌,对外界抵抗力强对多数抗生素易产生耐药性。与肠杆菌科其他细菌一样,具菌体抗原和荚膜抗原。克雷伯氏菌广泛存在于人和动物肠道、呼吸道以及水、土壤和谷物中[7]。Singh等[8]于1992年在鱼、虾、蟹等水产类食品中检测到肺炎克雷伯菌,但未对其致病性展开研究。还有一些学者先后在患病石龟、中华鳖(Trionyx sinensis)、鲢(Hypophthalmichthys molitrix)中分离到该菌[9,10];在蜜蜂体内尚属首次发现该菌。一般情况下克雷伯氏菌不致病,因为它是一种条件致病菌,对畜禽危害不大,发病与寄主防御功能缺陷及诱发因素有关。目前尚未发现有克雷伯氏菌引起的蜜蜂疾病,但不排除有和其他细菌共同作用引起蜜蜂疾病的可能性。
(3)本研究结果证明在蜜蜂肠道中存在某些耐药性的菌株。这一现象很可能是在养蜂生产过程中给蜂群防病、治病而长期、频繁使用抗生素造成的。蜂群用药过程中所使用的抗生素对蜜蜂肠道细菌,无论是共生菌还是病原菌均产生影响,长此以往,蜜蜂肠道细菌都会对所使用的抗生素产生一定程度的耐药性。因此,在蜂群中不科学使用抗生素,不仅会使蜜蜂病原菌产生耐药性,影响防治效果,还会对蜂产品质量产生严重影响。这就要求在养蜂生产过程中谨慎用药,避免大剂量使用,长期使用,以延缓病原菌耐药性的产生。
[1]戎映君, 苏松坤等.一种新的蜜蜂细菌性幼虫病病原菌的分离鉴定.微生物学报, 2006, 46(6): 994-998.
[2]Evans JD, Armstrong TN.Antagonistic interactions between honey bee bacterial symbionts and implications for disease.BMC Ecol,2006, 6: 4.
[3]Perea EJ.Orat flora in the age of molecular biology.Med Oral Patol Oral Cir Bucal, 2004, 9(Supp1): 6-10.
[4]Woo PC, Ng KH, Lau SK, et a1.Usefulness of the MicroSeq 50016S ribosomal DNA-based bacterial identification system for identification of clinically significant bacterial isolates with ambiguous biochemical profiles.J Clin Microbial, 2003, 41(5): 1996-2001.
[5]Lau SK, Woo PC, Woo GK, et al.Catheter-related mycobacterium identified by 16S rRNA gene sequencing.J Clin Microbiol, 2002,40(7): 2681-2685.
[6]姜静, 杨圣辉, 王松灵.16S rRNA基因及16S-23S rRNA基因间隔区在口腔微生物鉴定中的应用.口腔医学, 2006, 14(4): 297-299.
[7]黄印尧, 万沅, 陈信忠, 等.鸡源肺炎克雷伯氏菌的致病性和生物学特性研究.福建畜牧兽医, 1996, 18(2): 4-5.
[8]Singh BR, Kulshreshtha SB.Preliminary examinations on the enterotoxigenicity of isolates of Klebsiella pneumoniae from sea foods.Int J Food Microbiol, 1992, 16(4): 349-352.
[9]陶锦华, 李康然, 韦平.石龟肺炎克雷伯氏菌感染的诊断与防治.广西畜牧兽医, 2002, 18(6): 20.
[10]徐海圣, 舒妙安.中华鳖肺炎克雷伯氏菌病的病原研究.浙江大学学报, 2002, 29(6): 702-706.
