毛囊干细胞体外诱导分化为血管内皮细胞的实验研究
2012-01-16许志成李宏张群
许志成 李宏 张群
毛囊干细胞体外诱导分化为血管内皮细胞的实验研究
许志成 李宏 张群
目的 探讨体外诱导人毛囊干细胞成血管内皮细胞的可行性。方法 采用中性蛋白酶(Dispase)分离人毛囊干细胞,用含10 ng/mL VEGF、2 ng/mL bFGF及10%血清的EGM-2诱导液对其诱导,以无诱导因子的基础培养液为对照组,对每代细胞形态进行观察。诱导4代后,检测vWF(von Willebrand factor)与CD31的表达。结果 在诱导液的作用下,细胞形态逐步向内皮细胞的铺路石样形态转变,对照组细胞形态改变不明显。至第4代,实验组已明显表达vWF与CD31,对照组表达不明显;流式细胞仪检测显示,实验组阳性表达率近80%,对照组则低于5%;RT-PCR显示,实验组表达vWF,对照组未见明显表达。结论 使用含10 ng/mL VEGF、2 ng/mL bFGF及10%血清的EGM-2诱导液,可在体外诱导人毛囊干细胞分化成血管内皮细胞。
毛囊干细胞 血管内皮细胞 组织工程
血管内皮细胞是构建组织工程化血管主要的种子细胞,来自成年哺乳动物主动脉消化的成熟内皮细胞。由于成熟内皮细胞体外大量扩增技术的不成熟,内皮细胞易老化,与生物材料黏附不牢,易被血流冲走而形成血栓等原因,使组织工程血管的研究受到限制[1],干细胞可能为解决该问题带来曙光[2-3]。最近的研究表明,存在于毛囊外根鞘的毛囊干细胞于体外分离纯化后,经诱导可向多种组织转化,并有利于组织再生[4-6]。Amoh等[7]研究发现,鼠皮肤新生毛细血管可源自毛囊干细胞;Liu等[8]证实,绵羊毛囊干细胞中含有平滑肌前体细胞,纯化培养后可形成有收缩功能的平滑肌细胞,说明头发毛囊中的干细胞具有形成血管壁细胞的潜力。自体毛囊干细胞来源广泛,取材时生理干扰小;有很强增殖能力,不易老化;体外诱导可多向分化;回植无免疫排斥反应,而成为种子细胞的良好选择。本实验分离人毛囊干细胞,采用VEGF和bFGF对其进行体外诱导,观察细胞在诱导扩增后,表达内皮细胞相关指标的比例,以期为进一步体外血管构建提供种子细胞。
1 材料和方法
1.1 材料
整形外科手术切除的成人头皮5例;分离毛囊的器械包括眼科剪刀、镊子、解剖显微镜和显微器械;中性蛋白酶(Dispase,Gibco公司);胰蛋白酶(Gibco 公司);K—SFM(Define Keratinocyte Serum Free Medium)培养液,添加EGF和牛垂体提取物(Gibco 公司);DMEM 培养液(Gibco 公司);EGM-2培养液(Cambrex公司);胎牛血清(Hyclone公司);维生素 50 mg/L(Sigma 公司);L-谷氨酰胺 300 mg/L(Sigma公司);青霉素;链霉素(Sigma公司)。 鼠抗人vWF(DAKO 公司),鼠抗人 CD31(DAKO 公司); 二抗:羊抗鼠 lgG-FITC(Santa Cruz公司)。
1.2 方法
1.2.1 毛囊干细胞的分离与培养
毛囊外根鞘的富集方法参考文献[9];毛囊干细胞的富集方法同文献[10]。
1.2.2 VEGF和bFGF诱导分化毛囊干细胞
将VEGF和bFGF用稀释液(EGM-2培养液)稀释成每支1 μg/mL,分装至Ep管中,-20℃冷冻保存,应用前即时加入,在培养液中的终浓度分别为10 ng/mL和2 ng/mL。取第1代毛囊干细胞进行体外诱导,在细胞全部贴壁后,加入含10 ng/mL VEGF、2 ng/mL bFGF及 10%血清的 EGM-2诱导液,置于37℃、5%CO2、100%饱和湿度的条件下培养,隔日更换2/3量的培养液,注意观察细胞形态的变化,一般7 d后达到融合状态,可继续用诱导液传代培养。当出现血管内皮细胞类似形态时,可进行内皮细胞特异性表型的鉴定。对照组仅用含10%FBS的EGM-2培养液培养,与实验组同期传代、观察。
1.2.3 形态学观察
倒置相差显微镜(Olympus)观察各代毛囊干细胞形态变化,以确定在诱导与未诱导的培养情况下,两组细胞的形态结构上是否有向内皮细胞发生转变的可能。
1.2.4 细胞免疫荧光检测vWF和CD31的表达
分别收集实验组第4代细胞与对照组第4代细胞,用丙酮固定15 min,PBS漂洗,10% 羊血清封闭30 min,加入以0.1%BSA稀释的1:100的vWF和CD31抗体,37℃孵育45 min;PBS漂洗,滴加FITC标记相应二抗,37℃孵育30 min,PBS漂洗。碘化丙啶衬核后,荧光显微镜下观察。以脐动脉内皮细胞作为阳性对照,人耳廓软骨细胞为阴性对照。
1.2.5 流式细胞仪检测阳性细胞表达率
采用胰酶消化法收集实验组第4代细胞与对照组第4代细胞,消化得细胞悬液,离心5 min制备单细胞悬液,滴加0.25%TritonX-100作用5 min,PBS漂洗,离心5 min;分装入4个1.5 mL Ep管,保证每管含1×106个以上细胞,其中3管内分别加入抗vWF抗体和抗CD31抗体各10 μL,4℃孵育40 min;PBS漂洗,离心5 min,洗掉未结合抗体;各管同时加入FITC标记的羊抗鼠二抗4 μL,4℃孵育30 min,离心5 min,洗掉未结合抗体。 用只加有FITC标记二抗,而未加一抗的细胞作同型对照,1%多聚甲醛固定后送检。
1.2.6 RT-PCR 检测 vWF 表达
实验分4组:实验组第4代细胞;对照组第4代细胞;正常内皮细胞作为阳性对照;软骨细胞作为阴性对照。抽提各组细胞mRNA后按以下逆转录反应与聚合酶链反应条件进行,反应产物于1%琼脂糖凝胶中,在80V电压下,电泳45 min,条带与标准条带位置进行比较,判断各种检测目的mRNA的表达。应用天能电泳图象分析系统在紫外光下观察各基因表达,以β-actin作为cDNA定量的内参照。根据GenBank报告的序列设计引物,β-actin上游引物为:5’-ATCATGTTTGAGACCTTCAA-3’; 下游引物为:5’-CATCTCTTGCTCGAAGTCCA-3’,vWF 上游引物为:5’-CAGTGGTGTGAACGGGCATCT-3’;下游引物为:5’-CCCTGCGTAAGTCCATTCC-3’。
1.2.7 统计学分析
数据采用SPSS 13.0软件进行统计分析。数据以(x±s)表示,组间比较采用 t检验,P<0.05 为差异有统计学意义。
2 结果
2.1 倒置相差显微镜观察
原代毛囊干细胞刚贴壁时仍保持其原有的特性(图1)。4~5 d后,细胞逐渐伸展,在诱导液的作用下,细胞形态逐步由小圆形向铺路石样转变。至第4代,内皮样形态更加明显(图2),呈良好的分化状态;未诱导组细胞形态改变不明显。

图1 原代毛囊干细胞形态学观察(100×)Fig.1 Morphological observation of FSCs P0(100×)
2.2 细胞免疫荧光检测
对体外诱导至第4代的毛囊干细胞进行细胞免疫荧光检测内皮细胞相关指标vWF与CD31(图3、4),可见细胞呈现绿色荧光表达,即毛囊干细胞经诱导后已产生内皮细胞相关指标的表达,而为对照组胞浆荧光表达不显著。

图3 诱导后毛囊干细胞表达vWF(200×)Fig.3 Induced FSCs expressed vWF(200×)

图4 诱导后毛囊干细胞表达CD31(200×)Fig.4 Induced FSCs expressed CD31(200×)
2.3 流式细胞仪检测
vWF与CD31在原代接种时的表达阳性率分别为(3.25±0.45)%和(2.83±0.36)%,经诱导与传代至第4代,实验组中阳性率分别为(78.16±2.51)%和(81.58±3.73)%,明显高于诱导培养前(P<0.05);对照组中阳性率分别为(4.82±0.74)%和(3.28±0.62)%,明显低于实验组(P<0.05)。可见两种标记在不同组有相似的表达趋势,即实验组细胞阳性率明显高于培养前和对照组(P<0.05)(表1)。
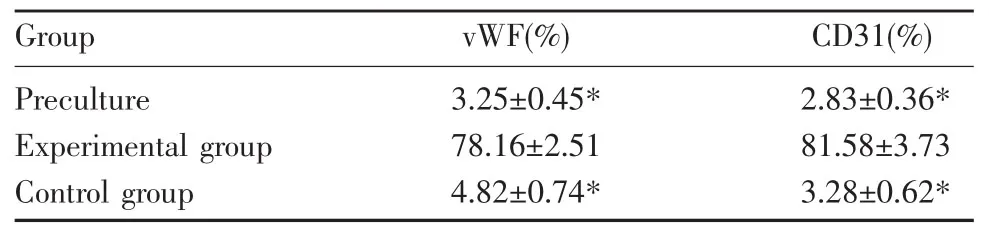
表1 各组流式细胞仪检测阳性细胞表达率(x±s,n=8)Table 1 Posive cells expressed in each group by FACS(x±s,n=8)
2.4 RT-PCR检测vWF表达
诱导组和阳性对照(正常血管内皮细胞)在180 bp有明显条带,说明有vWF表达(图5),对照组和阴性对照(软骨细胞)则无表达,且各组均有内参照物β-actin在318 bp的表达,说明实验组表达了内皮细胞vWF的指标。

图5 RT-PCR结果Fig.5 The results of RT-PCR
3 讨论
血管内皮细胞是血管内膜的主要成分,随血流呈单层纵向排列,细胞长轴与血流方向平行。内皮细胞对维持血流的稳定,维护血管壁的完整,稳定物质交换平衡,参与凝血与抗凝血活动,分泌血管舒缩物质等方面都具有至关重要的作用。血管内皮细胞一般可从大中型的动静脉中用灌注消化法获取,自Jaffe等[11]首创从新生婴儿脐带培养脐静脉内皮细胞后,内皮细胞的培养方法得到了不断改进。我们发现,应用终末成熟分化的血管内皮细胞为种子细胞体外培养易老化,扩增效率降低,直接影响到构建血管的力学性能和组织结构。
毛囊组织来源丰富,利用它进行组织工程研究有以下优势:①微创取材,方便且对机体无害;②取自自体,来源充足,诱导的组织不存在组织配型及免疫排斥问题;③分化的组织类型广泛,有多向分化潜能。毛囊干细胞可在体外大量扩增,若能分化为血管壁细胞,可提供充足的细胞量,从而解决心血管组织工程中的细胞来源问题。
培养液的选择也直接影响细胞的生长。本实验采用的是EGM-2培养液,添加物中含有血管内皮细胞生长因子、表皮生长因子、碱性成纤维母细胞生长因子、胰岛素样生长因子、氢化可的松、肝素、血清与抗生素等,对内皮细胞生长极为有益。其中,各种生长因子配合激素使用,对血管内皮细胞有高效特异的促有丝分裂作用和促增殖作用;肝素可显著增强生长因子对血管内皮细胞的增殖作用,配合母液的使用,能使体外培养的细胞较好维持内皮细胞的表型及功能,同时避免了寻求添加物与具体用量选择的不便,节省了工作时间,提高了工作效率。
在鉴定毛囊干细胞是否诱导为血管内皮细胞时,本实验选择了vWF与CD31。前者是内皮细胞特有的超微结构,CD31即血小板内皮细胞黏附分子-1广泛存在与内皮细胞表面,两者是判别干细胞是否诱导分化为成熟内皮细胞的重要指标。观察结果显示,经诱导的毛囊干细胞生长形态逐渐转化为铺路石样的内皮细胞,对照组则形态改变不明显。荧光检测显示实验组细胞呈现绿色荧光表达,可见干细胞已表现内皮细胞的类似结构,而对照组细胞的荧光较弱;RT-PCR从基因水平进一步证实了这点。流式细胞仪检测表明,实验组细胞有明显的内皮细胞标记表达,诱导率近80%,明显高于对照组表达(近5%),证明本实验的诱导体系有较高的诱导效率。
本实验建立了一个较为有效的诱导体系,同时摸索出一套较为完整的毛囊干细胞分离纯化培养和表型检测的方法,诱导后已表达有血管内皮细胞的表型,为进一步进行血管构建与血管缺损的修复研究奠定了基础,也为血管疾病的治疗提供了新的思路与选择。
[1]曹谊林.组织工程学理论与实践[M].上海:上海科学技术出版社,2004,271.
[2]Badylak SF,Nerem RM.Progress in tissue engineering and regenerative medicine[J].Proc Natl Acad Sci U S A,2010,107(8):3285-3286.
[3]Lasala GP,Minguell JJ.Vascular disease and stem cell therapies[J].Br Med Bull,2011,98:187-197.
[4]Amoh Y,Li L,Campillo R,et al.Implanted hair follle stem cells form Schwann cells that support repair of severed peripheral nerves[J].Proc Natl Acad Sci U S A,2005,102(49):17734-17738.
[5]Blazejewska EA,Schlotzer-Schrehardt U,Zenkel M,et al.Corneal limbal microenvironment can induce transdifferentiation of hair follicle stem cells into corneal epithelial-like cells[J].Stem Cells,2008,27(3):642-652.
[6]Amoh Y,Kanoh M,Niiyama S,et al.Human hair follicle pluripotent stem(hfPS)cells promote regeneration of peripheral-nerve injury:an advantageous alternative to ES and iPS cells[J].J Cell Biochem,2009,107(5):1016-1020.
[7]Amoh Y,Li L,Yang M,et al.Nascent blood vessels in the skin arise from nestin-expressing hair-follicle cells[J].Proc Natl Acad Sci U S A,2004,101(36):13291-13295.
[8]Liu JY,Peng HF,Andreadis ST.Contractile smooth muscle cells derived from hair-follicle stem cells[J].Cardiovasc Res,2008,79(1):24-33.
[9]张群,杨光辉,丛笑倩,等.人毛囊外根鞘细胞的分离及培养明[J].组织工程与重建外科,2006,2(2):79-82.
[10]张群,杨光辉,丛笑倩,等.差速贴壁法分选人毛囊干细胞的实验研究[J].中华实验外科杂志,2006,23(6):755-757.
[11]Jaffe EA,Nachman RL,Becker CG,et al.Culture of human endothelial cells derived from umbilical veins:identification by morphologic and immunologic criteria[J].J Clin Invest,1973,52(11):2745-2756.
Preliminary Study on Inducing Hair Follicle Stem Cells into Vascular Endothelial Cells in Vitro
XU Zhicheng1,LI Hong2,ZHANG Qun1.1 Department of Plastic&Reconstructive Surgery,The Ninth People's Hospital,Shanghai Jiaotong University School of Medicine,Shanghai 200011,China.2 Hangzhou Electronic Science and Technology University,Hangzhou 310018,China.
XU Zhicheng(E-mail:xuzhichengmd@163.com).
ObjectiveTo investigate the feasibility of inducing human hair FSCs(follicle stem cells)into VECs(vascular endothelial cells)in vitro.MethodsThe dispase was used to isolate the stem cells and stem cells were cultured in EGM-2 plus 10 ng/mL VEGF and 2 ng/mL bFGF as long as 4thpassage as a experimental group,the control group was cultured in EGM-2 without growth factor.The morphological change of each passage was observed and vWF(von Willebrand factor)and CD31 were tested 4 passages later.ResultsThe morphological change to VECs was obviously found in the increasing passage of the induced FSCs,but the phenomenon was not distinct in the control group.Induced FSCs of 4thpassage expressed vWF and CD31 in immunocytochemical staining,while little expression was observed in the control groups.FCM showed nearly 80%of induced FSCs expressed vWF and CD31,much higher than the control ones which were lower 5%.RT-PCR further confirmed the experimental group expressed vWF,but not obvious expression in the control group.ConclusionFSCs can be induced to VECs in vitro by EGM-2 plus 10 ng/mL VEGF and 2 ng/mL bFGF.
Follicle stem cells;Vascular endothelial cells;Tissue engineering
Q813.1+1
A
1673-0364(2012)05-0241-04
10.3969/j.issn.1673-0364.2012.05.001
国家自然科学基金青年科学基金(81000842)。
200011 上海市 上海交通大学医学院附属第九人民医院整复外科(许志成,张群);310018 浙江省杭州市 杭州电子科技大学(李宏)。
许志成(E-mail:xuzhichengmd@163.com)。
2012年7月22日;
2012年8月16日)
