大麦成熟胚培养高再生率品种的筛选
2012-01-15杨建明
蓝 庆 杨建明 华 为
(1.云南农业大学,云南 昆明 650201;2.浙江省农科院国家大麦改良中心,浙江 杭州 310021)
大麦是我国以及世界上重要的农作物之一,其种植面积和产量位列第四,是啤酒工业与饲料工业的主要原料。利用植物基因工程的原理和技术对大麦进行改良,已经引起了人们的高度重视,它将成为优质大麦新品种培育的有效新途径之一[1-6]。与水稻、玉米等其他主要农作物相比,大麦的组织培养、植株再生非常困难,且遗传转化效率非常低,这严重阻碍了转基因技术在培育大麦新品种的应用。所以,寻求高效能提升大麦组织培养再生率和遗传转化率的方法,是大麦遗传转化研究工作的重点。本文利用30个大麦品种对成熟胚愈伤组织诱导率和植株分化再生率等进行了研究,筛选出了大麦高组培再生率品种,对大麦遗传转化改良研究中品种的选择提供了一定依据。
1 材料与方法
1.1 材料
供试材料有30个大麦品种:sloop、Golden promise、Metcalfe、Baudin、Gairdner、Franklin、Hamelin、Igri、Morex、云啤2号、扬农啤9号、08PJ-37青、苏啤3号、苏啤3号白、08PJ-37黄、浙啤33、浙大8号、浙秀12、浙秀22、浙皮8号、驻大麦5号、甘啤4号、甘啤5号、花30、垦啤麦9号、单二、秀麦11、扬饲麦3号、保大麦12号、短芒紫青稞。以上品种均由浙江省农科院国家大麦改良中心提供。
1.2 培养基
所有培养基调节pH值至5.8,无机成分和糖分均高压蒸汽灭菌,于121℃和0.1Mpa压力下灭菌25min。所有其余有机成分均在无菌条件下过滤灭菌,且在培养基冷却至60℃以下加入。
1.3 取材与培养方法
将所有供试材料,用筛种机过筛,选取粒径2.5mm级别的材料,浸泡10h,随后置于50%(V/V)硫酸溶液中,摇床振荡40min。将去壳的种子用75%乙醇消毒5min,12%过氧化氢溶液消毒25min,最后用灭菌水冲洗4次,每次1min。然后在无菌条件下,用解剖刀刮取种子成熟胚,将刮碎的胚组织接种到诱导培养基上,于25℃黑暗条件下诱导13d后,将初代愈伤组织转入继代培养基暗培养10d,再转到MS修饰培养基1上暗培养10d,最后将愈伤组织转移至MS修饰培养基2上进行光照分化培养(25℃、2000lx,16h/d),培养基种类见表1,30d后统计结果。
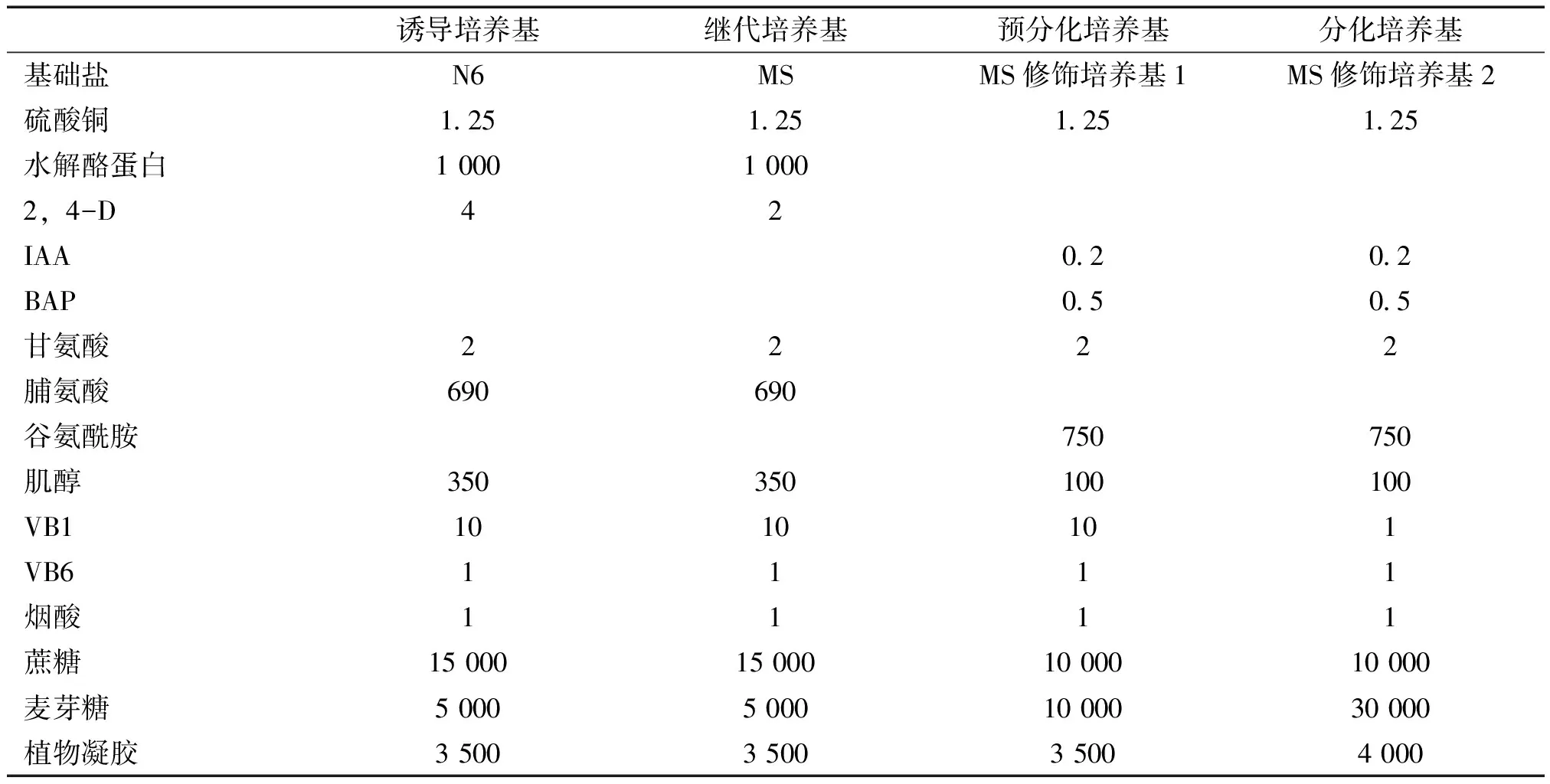
表1 培养基种类 mg
1.4 统计分析方法
每皿接种12个外植体,每个处理接种200个。每个品种3次重复。
愈伤诱导率(%)=(出愈外植体数/接种外植体数)×100
分化率(%)=(分化愈伤数/接种愈伤数)×100
再生率(%)=(出苗数/接种愈伤数)×100
绿苗率(%)=(绿苗数/接种愈伤数)×100
白化苗率(%)=(白化苗数/接种愈伤数)×100
将诱导率等百分数先用Excel进行反正弦转换,再采用SPSS统计分析软件进行方差分析,显著水平α=0.05。
2 结果与分析
2.1 不同大麦品种成熟胚愈伤组织诱导
大麦成熟胚刮碎的外植体在诱导培养基上培养2~3d时,开始变白膨大,出现初级愈伤组织(图1)。6d后刮碎接种的外植体形成愈伤组织团块,在12d时愈伤组织形成可达到最大。初级愈伤组织一般为半透明白色,结构松软,多成不规则片状或球状,含水量丰富,不具备分化再生能力。经过继代培养的愈伤组织才具备分化、再生的能力。经过继代培养的愈伤组织形成淡黄色球状,表面呈现许多疣状突起的胚性愈伤组织[7]。胚性愈伤组织具有分化和再生的能力。不同大麦品种成熟胚愈伤组织出愈率差异显著(表2,表3),所有供试材料中共有27个品种的出愈率超过60%,其中Golden promise、Hamelin、08PJ-37青、云啤2号和Morex的愈伤诱导率最高分别达到了93.4%、94.05%、94.75%、94.8%、94.95%,而短芒紫青稞的出愈率最低,仅为5.3%。
图1 初代愈伤组织(彩图见封2)

图2 分化带绿点的愈伤(彩图见封2)

图3 再生成苗(彩图见封2)

表2 不同大麦品种成熟胚愈伤组织诱导的比较
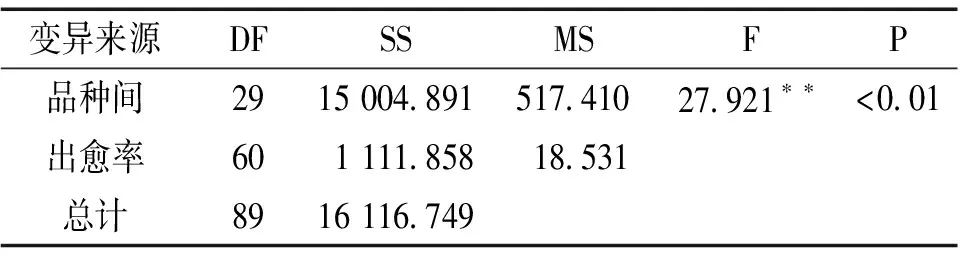
表3 成熟胚出愈率的方差分析
2.2 不同大麦品种成熟胚愈伤组织分化和再生
在N6诱导培养基上诱导出的初代愈伤组织,转移到MS继代培养基上进行10d的暗培养。然后转移到MS修饰培养基1上预分化处理10d。最后在MS修饰培养基2上光照条件下进行分化。在光照下1周,胚性愈伤组织表面分化出绿点(图2),继续培养2周,其中一部分可以继续分化形成绿苗(图3);而另一些愈伤组织只能保持绿点的状态或者分化成根,不会分化成苗。不同大麦品种的分化率、再生率、绿苗形成率以及白化率均有显著差异(见表4~8)。所有供试材料中共有24个品种的分化率超过50%,其中Franklin、苏啤3号和浙秀22的分化率较高,分别达到了93.05%、96.3%、97.6%,而驻大麦5号的分化率最低,仅为11.85%,参见表4、表5。
在再生能力方面,不同品种间的大麦具有显著差异。共有3个品种的再生率超过40%,6个品种再生率在30%~40%之间,6个品种在20%~30%之间,7个品种在10%~20%之间,8个品种的再生率在10%以下。其中sloop、扬农啤9号、Golden promise的再生率较高,分别达到了40.6%、43.85、44.7%,而再生率最低的垦啤麦9号仅为1.4%,参见表6、表7。
在愈伤组织分化培养的过程中,有6个品种的绿苗率在30%以上,6个品种在20%~30%之间,9个品种在10%~20%之间,9个品种的绿苗率在10%以下。其中,sloop的绿苗率最高,达到了40.6%。而绿苗率最低的垦麦啤9号仅为1.05%。
产生绿苗的同时会伴有白化苗的生成,对供试材料的白化率进行了统计分析,发现共有24个大麦品种的愈伤组织可以产生白化苗,扬农啤9号、08PJ-37青、Franklin、浙秀12、Golden promise的白化率分别为13.25%、9.85%、6.15%、5.85%、3.9%,其余品种的白化率均低于3%,参见表8。
2.3 成熟胚愈伤组织出愈率、分化率、再生率、绿苗率的相关性分析。
将以上所有各比率用SPSS软件进行相关性分析(见表9),发现出愈率与分化率之间的相关性达到了极显著的水平,而出愈率与再生率以及绿苗率没有相关性。分化率与再生率之间的相关性达到了显著水平,分化率与绿苗率之间的相关性也达到显著水平,再生率与绿苗率之间达到了极显著水平的相关性。
综合分析,品种Golden promise、浙皮8号、浙秀12、Metcalfe、Franklin、浙大8号六个品种的成熟胚组织培养再生能力较强,可以作为大麦遗传转化的受体进行利用。
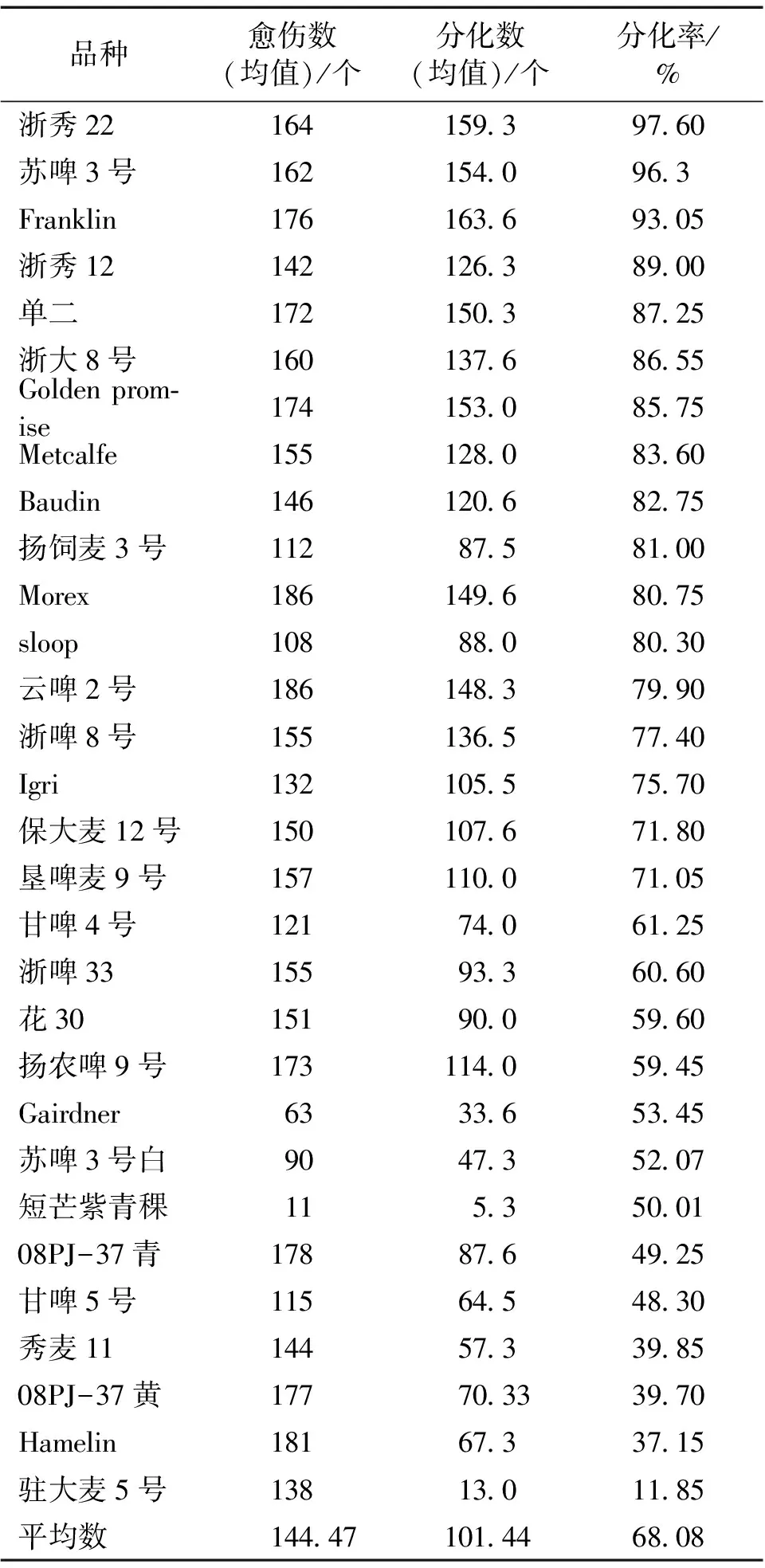
表4 不同大麦品种成熟胚愈伤组织分化的比较

表5 成熟胚分化率的方差分析
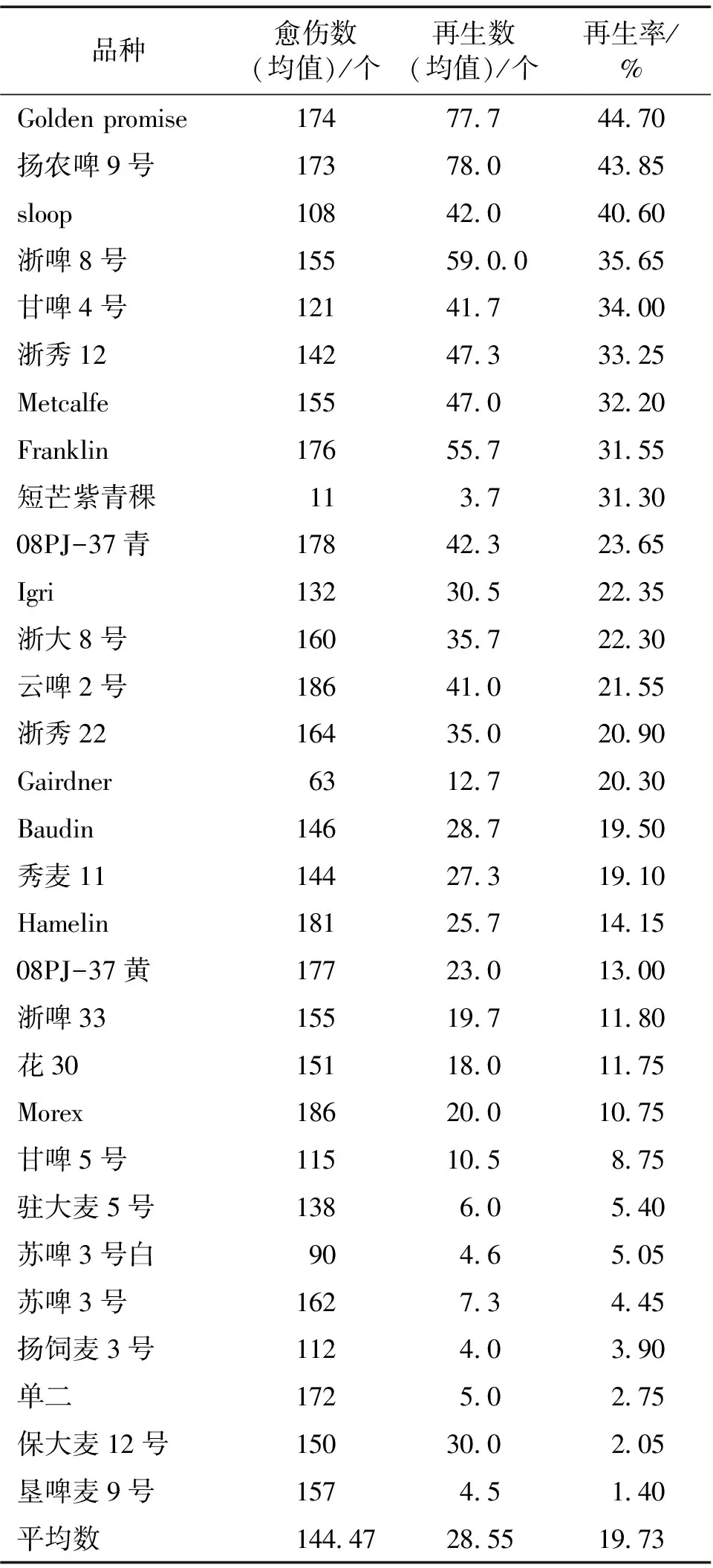
表6 不同大麦品种成熟胚愈伤组织再生的比较

表7 成熟胚再生率、绿苗率的方差分析
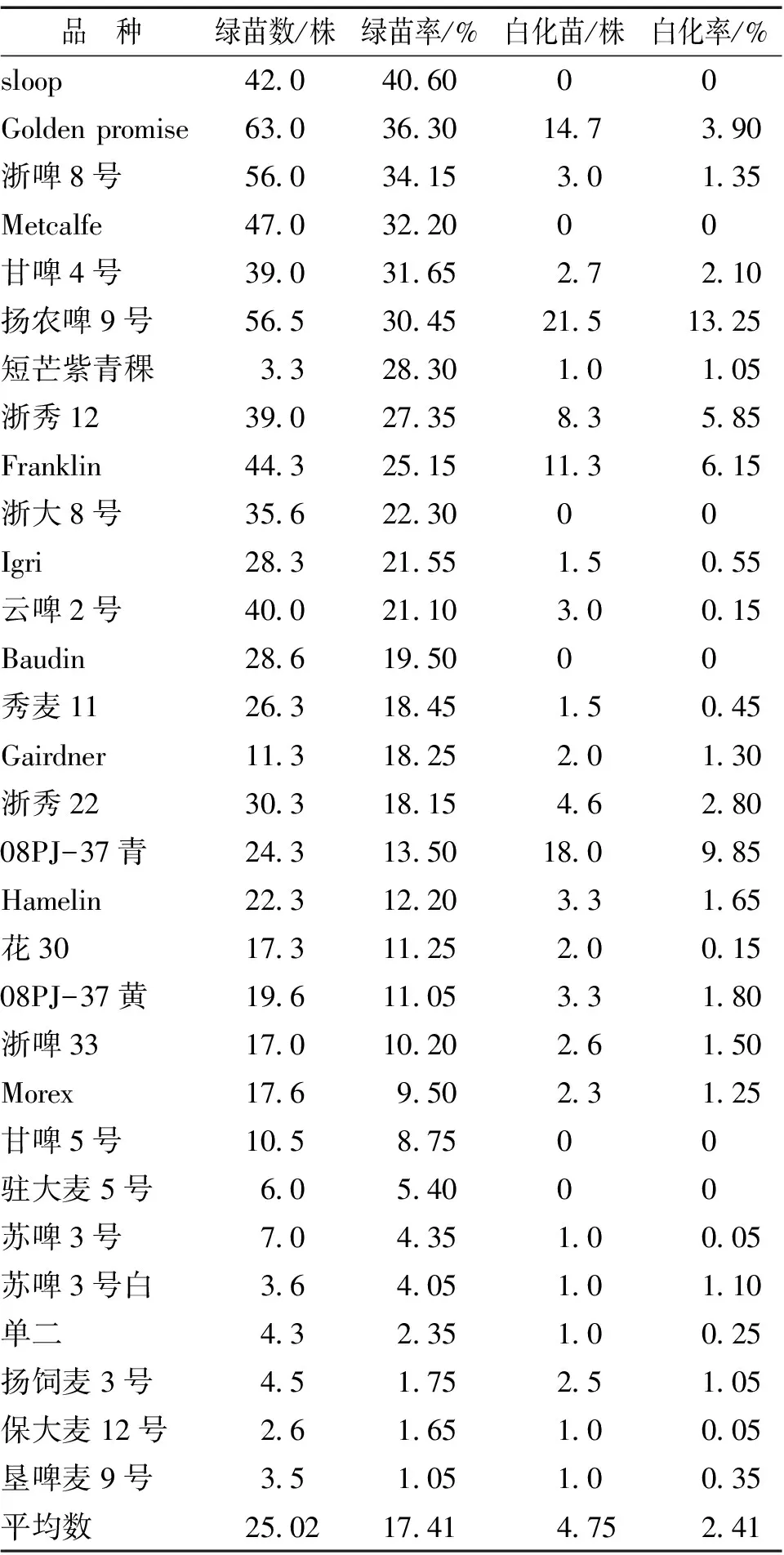
表8 不同大麦品种成熟胚愈伤组织绿苗、白化苗的比较
3 讨论
本研究结果表明,不同的大麦基因型成熟胚具有不同的愈伤组织诱导力。总体上说,大麦成熟胚的诱导率都高于60%。在30个品种中,出愈率高于80%的品种就有16个。郭晓琳等[9]的研究表明,在大麦成熟胚愈伤组织的诱导过程中,较高浓度的KH2PO4以及VB1可促进诱导出愈伤组织。本实验采用的N6培养基辅以10mg/L的VB1获得了较高的出愈率,证明了对于大麦成熟胚的组织培养来说,KH2PO4和VB1可能是两个关键因素,对未来大麦成熟胚的组培研究提供了思路。
共有24个大麦品种的分化率超过了50%,最高的浙秀22达到了较高的97.6%。预分化培养基的设置,以及所含的激素配比,可能对大麦成熟胚的愈伤组织分化起到了作用。
所有的供试品种都有绿苗的再生。Sloop、Golden promise、浙啤8号、Metcalfe、甘啤4号、扬农啤9号等品种的绿苗率超过了30%,魏日凤[8]研究了蔗糖与麦芽糖的配比对水稻成熟胚培养的作用,当有适当比例的蔗糖与麦芽糖存在时,愈伤组织的分化率和绿苗率都会有相应的提高。本研究表明,在大麦成熟胚的组织培养中,也可能有相似的作用。
从相关性分析上可以看出,出愈率与分化率之间有较为密切的相关性,而与再生率以及绿苗率没有相关性。分化率与再生率、绿苗率之间有明确的相关性。而且再生率与绿苗率之间的相关性更为密切。其中供试材料短芒紫青稞的出愈率仅为13.3%,但该品种的分化率为45.07%,再生率以及绿苗率分别为34%、32.15%。Morex的出愈率为94.95%,在所有供试品种中是最高的,但分化率以及再生率分别为80.75%和10.75%,呈现逐渐走低的趋势。由此可见,诱导培养基对大麦成熟胚愈伤的诱导起着关键的作用,而分化培养基则对大麦再生有着一定影响。因此,可根据大麦不同的品种,设计相适应的诱导培养基提高愈伤组织的出愈率,同时设计筛选合适的分化培养基,则可进一步提高大麦的分化再生能力。
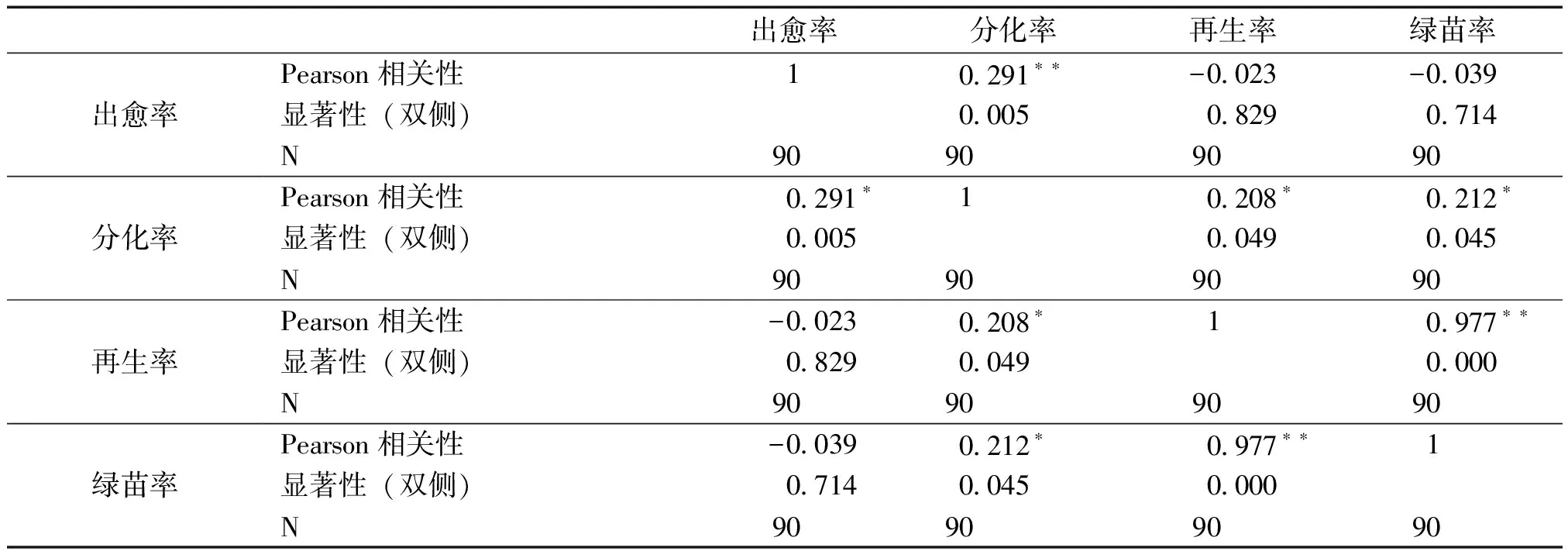
表9 相关性分析
注:**在0.01水平(双侧)上显著相关。*在0.05水平(双侧)上显著相关。
[1]OKAS,SAITON,KAWAGUCHI H.Histological observations on initiation and morphogenesis in immature and mature embryo derived callus of barley(Hordeum vulgare L.)[J].Ann Bot,1995,76:487-492
[2]GONZALEZ-MELENDI P,RAMREZ C,TESTILLANO P S.Three dimensional confocal and electron microscopy imaging define the dynamics and mechanisms of diploidisation at early stages of barley microspore-derived embryogenesis[J].Planta,2005,222:47-57
[3]CHANG Y,ZITZEWITZ J,HAYES P M.High frequency plant regeneration from immature embryos of an elite barley cultivar(Hordeum vulgare L.cv.morex)[J].Plant Cell Rep,2003,21:733-738
[4]ABEBE T,SKADSEN R,PATELAND M.The lem2 gene promoter of barley directs cell and development-specific expression of gfp in transgenic plants[J].Plant Biotech J,2006(4):35-44
[5]SHARMA V K,MONOSTORI T,GOBEL C.Transgenic barley plants overexpressing a 13-lipoxygenase to modify oxylipin signature[J].Phytochemistry,2006,67:264-276
[6]万建民,陈建民,CARLSON AR,等.转基因大麦中gfp基因的染色体位置及其表达[J].遗传学报,2003,30(8):697-705
[7]王君晖,黄纯农.大麦成熟胚细胞去分化和再分化的组织学研究[J].杭州大学学报,1995,22(1),102-106
[8]魏日凤.蔗糖与麦芽糖质量浓度及添加成分对水稻成熟胚培养的效应[J].福建农林大学学报,2006,35(6),565-568
[9]郭晓琳,张红伟等.大麦成熟胚愈伤组织的诱导和植株再生的研究[J].植物遗传资源学报,2005 ,6 (4) :418-422
