转化生长因子β1在胃癌患者血清和组织中的表达及意义
2012-01-13刘义文胡燕梅熊小青赵英培胡建国
刘义文,胡燕梅,熊小青,赵英培,胡建国
1.湖北省荆州市第二人民医院肝病二科,湖北荆州 434000;2.宁夏回族自治区人民医院感染科;3.宁夏医科大学总医院消化内科
转化生长因子β1在胃癌患者血清和组织中的表达及意义
刘义文1,胡燕梅2,熊小青3,赵英培3,胡建国3
1.湖北省荆州市第二人民医院肝病二科,湖北荆州 434000;2.宁夏回族自治区人民医院感染科;3.宁夏医科大学总医院消化内科
目的检测胃癌患者血清中转化生长因子β1(TGF-β1)水平及相对应的胃癌组织中 TGF-β1的表达,探讨 TGF-β1在胃癌发生、发展中的作用。方法应用酶联免疫吸附法测定56例胃癌患者、30例胃不典型增生(轻-中度)及20例健康对照组的血清TGF-β1水平,应用免疫组织化学SP法检测相应胃癌组织、胃不典型增生(轻-中度)组织及正常胃组织中TGF-β1的表达水平,分析其与胃癌病理特征的关系。结果胃癌组血清TGF-β1表达水平为(36.19±18.67)pg/mL,明显高于胃不典型增生(轻-中度)组及健康对照组(P<0.01),TGF-β1在胃癌组中的表达率为83.9%(47/56),在胃不典型增生(轻-中度)组及健康对照组中的表达率分别为 43.3%(13/30)和10%(2/20),3组间差异有统计学意义(χ2=45.46,P<0.01);TGF-β1在胃癌患者血清和组织中的表达与胃癌的分化程度、浸润深度、淋巴结转移及临床分期(TNM)有关(P<0.05),而与胃癌的发生部位无关(P>0.05)。结论TGF-β1过度表达与胃癌的发生和发展有一定关系,TGF-β1可作为反映胃癌恶性生物学行为的指标之一。
转化生长因子β1;胃肿瘤;酶联免疫吸附法;免疫组织化学
TGF-β1作为负性生长因子,主要参与细胞的增殖、分化及凋亡等生理病理过程,同时在多种肿瘤的发生、发展中也发挥重要作用,据 Helmy等[1]研究发现,TGF-β1可以作为抗癌治疗中的一个检测指标,但是国内外[2-3]对于 TGF-β1在胃癌发生、发展过程中所起的作用及其与胃癌的生物学行为有无相关性均存在一些争议,它能否作为检测胃癌的生物学指标还有待进一步研究。本研究通过免疫组织化学SP法和酶联免疫吸附法分别检测胃癌组织及血清中 TGF-β1的表达,并评估其与胃癌临床病理之间的相关性,了解TGF-β1在胃癌发生、发展中的意义,为临床胃癌的诊断治疗提供一定依据。
1 材料与方法
1.1 材料
1.1.1 一般资料:病例包括2009年4月-2009年11月在宁夏医科大学附属医院经病理确诊为胃不典型增生(轻-中度)患者30例、胃癌患者56例,并收集体检时胃镜检查胃基本正常且留有空腹血液样本者20例作为健康对照组。胃癌组:男44例,女12例,年龄31~78岁,平均年龄(57.5±10.3)岁;胃不典型增生(轻-中度)组:男22例,女8例,年龄30~73岁,平均年龄(50.6 ±11.2)岁;对照组:男14 例,女 6 例,年龄27~68岁,平均年龄(40.3±10.5)岁。胃癌病例根据1997年美国癌肿委员会(AJCC)制订的TNM分期标准,分为 Ⅰ+Ⅱ期组19例和Ⅲ+Ⅳ期组37例;按分化程度分为分化程度较好组(高分化和中分化腺癌)31例和分化程度较差组(低分化腺癌和黏液腺癌)25例;按浸润深度分为未侵及浆膜层组19例和侵及或穿透浆膜层组37例;按有无淋巴结转移分为有淋巴结转移组29例和无淋巴结转移组27例;根据肿瘤部位分为贲门组14例、胃体组18例、胃窦组24例。所有患者均选自经检查均未发现心、肝、肾、肺等主要脏器病变,均未行放疗、化疗和生物治疗。胃癌组(病理组织学均为腺癌)于手术前3 d内空腹采血,不典型增生组经病理证实后即空腹采血。胃癌患者,胃不典型增生(轻-中度)患者和健康志愿者均知情并签署知情同意书。
1.1.2 试剂:人 TGF-β1 ELISA试剂盒购自武汉博士德生物工程有限公司,兔抗人TGF-β1多克隆抗体购自Santa Cruz公司(工作浓度为1∶100),免疫组化 SP-9001试剂盒及DAB显色剂购自北京中杉金桥生物技术公司。
1.2 方法
1.2.1 酶联免疫吸附法检测血清中 TGF-β1浓度:各组样本均取外周静脉血3 mL,放置1 h后,2 000 r/min离心10 min分离血清,于-80℃低温保存待测,应用酶联免疫吸附法检测血清中TGF-β1浓度,按SP-9001试剂盒说明书进行操作。
1.2.2 免疫组织化学 SP法检测组织中 TGF-β1表达:所有组织标本经10%甲醛固定后常规石蜡包埋,根据HE染色切片进行挑选蜡块,5 μm厚连续切片,免疫组化染色采用SP法,按试剂盒说明书进行操作。
1.2.3 TGF-β1 在组织中表达的阳性标准:可见棕黄色颗粒分布于细胞质,细胞核中偶见散在表达。结果判断采用半定量积分法,即根据每张切片的阳性细胞比例及着色深浅积分,阳性细胞比例:<1/3计1分、1/3~2/3计2分、>2/3计3分,着色程度:无着色计0分,浅黄色计1分,棕黄色计2分,棕褐色计3分,根据二者乘积判断阳性等级:0分为阴性(-),l~4分为阳性(+),>4分为强阳性(++)。
1.3 统计学处理 采用 SPSS 16.0软件对数据进行统计分析。计量资料两组间比较用t检验,多组间比较用方差分析,计数资料采用等级相关检验,P<0.05为差异有统计学意义。
2 结果
2.1 TGF-β1在胃癌组、胃不典型增生组及对照组的组织和血清中表达情况 TGF-β1主要细胞质中表达,细胞核中偶见散在表达,阳性反应产物表现为棕黄色颗粒(见图A、B、C)。在56例胃癌、30例不典型增生和20例正常胃组织中,TGF-β1的阳性表达率分别为83.9%、43.3%、10.0%,TGF-β1 的阳性表达在 3 种组织之间差异有统计学意义(χ2=45.46,P <0.01)。TGF-β1在胃癌组患者血清中的表达水平为(36.19±18.67)pg/mL,明显高于胃不典型增生(轻-中度)组及健康对照组,差异有统计学意义(P<0.01)。

表1 TGF-β1在各组患者血清和组织中表达情况Tab 1 The expressions of TGF-β1 in the tissues and serum of each group
2.2 TGF-β1的表达与胃癌临床病理特征的关系TGF-β1在胃癌患者血清及组织中表达与胃癌的分化程度、浸润深度、淋巴结转移及临床(TNM)分期明显相关(P均<0.05),而与胃癌发生部位似无相关性(P >0.05,见表2)。
3 讨论
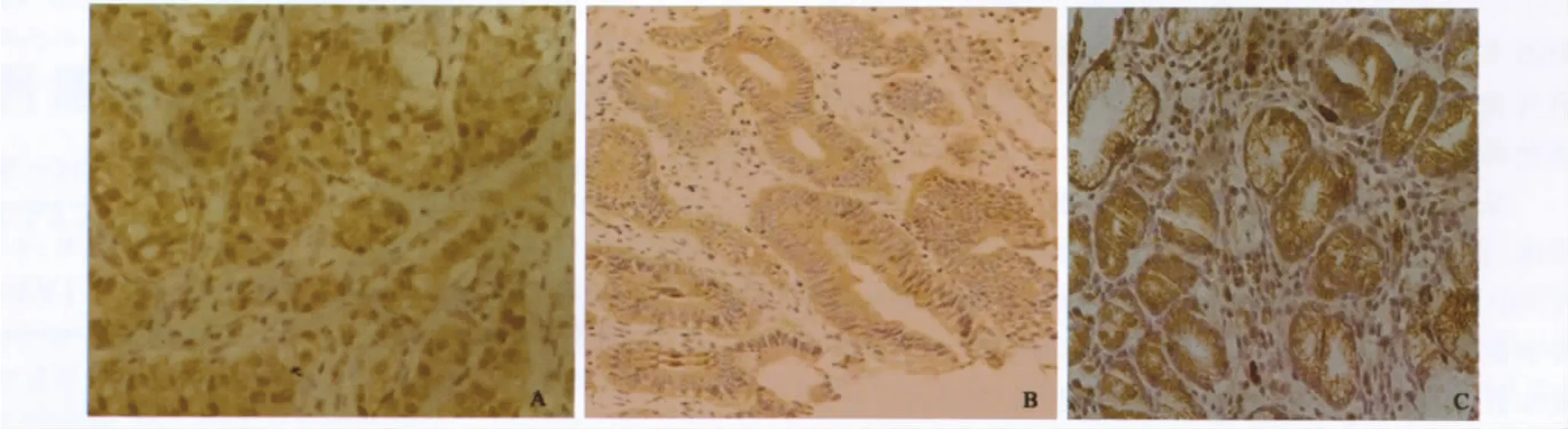
图1 TGF-β1在3种组织中表达的免疫组化检测(SP 200×)A:胃癌组织;B:胃不典型增生组织;C:对照组Fig 1 Immunohistochemical assay of TGF-β1 in 3 kinds of gastric tissues(SP 200 × )A:gastric carcinoma tissue;B:atypical hyperplasia of gastric mucosa tissue;C:normal gastric mucosa tissue

表2 TGF-β1在胃癌组织和血清中的表达及与胃癌临床病理特征关系Tab 2 The expressions and clinicopathological characteristics of TGF-β1 in the tissues and serum of gastric cancer
TGF-β1基因定位于染色体19q3,属TGF-超家族,是由两个分子量为12KD的单体分子通过二硫键连结成的二聚体,其功能十分复杂,主要参与细胞的增殖、分化及凋亡等病理生理过程。在肿瘤的发生及发展中,TGF-β1亦具有相当重要的作用。研究表明TGF-β1可通过活化CDKs抑制因子,进而阻断细胞的生长于细胞周期的G期,抑制多种正常细胞和肿瘤细胞的生长,因此属于负性生长因子[4],但在结、直肠癌,胃癌等肿瘤发生、发展过程中,可摆脱TGF-β1的抑制,甚至被TGF-β1刺激而生长。胃癌的发病机制尚未完全清楚,但有研究发现TGF-β1在胃癌发病机制中起一定作用[5],而且 TGF-β1的 C-509T 和 T869C 基因多态性可能与中国人群胃癌遗传易感性相关[6]。本组研究显示,从正常胃黏膜到胃不典型增生及胃癌组织,随着病变程度的加重,TGF-β1在血清及组织中的表达呈逐渐增加的趋势,提示TGF-β1在胃癌的发生发展过程中可能起重要作用。
TGF-β1的过度表达与肿瘤的侵袭性关系密切[7],在胃癌的发生过程中,TGF-β1通过增加 Fascin1介导的ERK和JNK信号通路,使信号转导通路发生异常,从而促进胃癌细胞浸润和转移[8]。有研究显示TGF-β1表达还与胃癌的分化程度显著相关,并可作为胃癌发生浸润转移[2]和手术预后[9]的重要评估指标。本组研究也发现,胃癌组织中TGF-β1的过度表达与肿瘤的分化程度、浸润深度、淋巴结转移及临床分期(TNM分期)有明显的相关性,这与Ebert等[3]研究结果一致。同时从胃癌患者血清TGF-β1着手研究也显示,胃癌患者血清TGF-β1水平与肿瘤的分化程度、浸润深度、淋巴结转移及临床分期(TNM分期)亦明显相关,但与肿瘤发生的部位无明显相关性,这与相关的研究结果一致[10-14]。这些都说明胃癌组织及血清中TGF-β1的高表达水平与胃癌的发展程度有关。TGF-β1上述的作用机制尚未完全清楚,大多数研究均显示TGF-β1不能直接促进肿瘤细胞增殖,目前认为是肿瘤细胞本身失去了对TGF-β1的敏感性及TGF-β1促进血管和肿瘤基质生成、刺激黏附蛋白和蛋白酶形成等多种因素的综合作用。
综上所述,本组研究表明TGF-β1与胃癌的分化程度、浸润深度、淋巴结转移及临床分期有明显的相关性,由于浸润深度为判断早期胃癌和进展期胃癌的重要参数,淋巴结转移又是衡量肿瘤转移潜能大小的重要参数,而胃癌的分期与转移是评价胃癌预后的指标,所以有理由认为TGF-β1可作为评价胃癌分期、转移及预后的参考指标之一。
[1] Helmy A,Hammam OA,EI Lithy TR.The role of TGF-beta-1 protein and TGF-beta-R-1 receptor in immune escape mechanism in bladder cancer[J].MedGenMed,2007,9(4):34.
[2] Song GQ,Wang Q.Expression of reversion-inducing-cysteine-rich protein with Kazal motifs,matrix metalloproteinase-9 and transforming growth factor-β1 and their correlations in gastric carcinomas [J].World Chinese Journal of Digestology,2007,15(15):1731-1737.
宋国庆,王强.RECK,MMP-9及 TGF-β1在胃癌组织中的表达及其相互关系[J].世界华人消化杂志,2007,15(15):1731-1737.
[3] Ebert MP,Yu J,Miehlke S,et a1.Expression of transforming growth factor beta-1 in gastric cancer and in the gastric mucosa of first-degree relatives of patients with gastric cancer[J].Br J Cancer,2000,82(11):1795-1800.
[4] Chen XM,Li HX.Expression and significance of TGF-β1,TGF-βRII receptor and CDK4 in primary hepatocellular carcinoma[J].Chinese Journal of General Surgery,2005,14(2):146-148.
陈学敏,李厚祥.TGF-β1,TGF-βRII和 CDK4在原发性肝细胞肝癌中的表达及其意义[J].中国普通外科杂志,2005,14(2):146-148.
[5] Vagenas K,Spyropoulos C,Gavala V,et al.TGF beta1,TGF beta2,and TGF beta3 protein expression in gastric carcinomas:correlation with prognostics factors and patient survival[J].J Surg Res,2007,139(2):182-188.
[6] Li T,Cao BW,Dai Y,et al.Correlation of transforming growth factor beta-1 gene polymorphism C-509T and T869C and the risk of gastric cancer in China [J].J Gastroenterol Hepatol,2008,23(4):638-642.
[7] Lin Y,Kikuchi S,Obata Y,et al.Serum levels of transforming growth factor beta 1 are significantly correlated with venous invasion in patients with gastric cancer[J].J Gastroenterol Hepato1,2006,21(2):432-437.
[8] Fu H,Hu Z,Wen J,et al.TGF-beta promotes invasion and metastasis of gastric cancer cells by increasing fascin 1 expression via ERK and JNK signal pathways[J].Acta Biochim Biophys Sin(Shanghai),2009,41(8):648-656.
[9] Guo RF,Zang SZ,Zhang L,et a1.Relations of transforming growth factor-beta1 expression to differentiation and prognosis of advanced gastric cancer [J].Zhonghua Yi Xue Za Zhi,2006,86(46):3249-3254.
[10] Su MQ,Quan ZJ,Zhang SH,et al.Analysis of CA19-9,CEA,TGF-β1 and VEGF in serum of patients with gastric carcinoma and its significance[J].J Clin Res,2008,25(8):1403-1405.
粟美栖,全主见,张少宏,等.血清 CA19-9、CEA、TGF-β1 及 VEGF检测在胃癌患者诊治中的意义[J].医学临床研究,2008,25(8):1403-1405.
[11] Niki M,Okajima K,lsozaki H,et al.Measurement of the plasma transforming growth factor-beta 1(TGF-beta 1)level in patients of gastric carcinoma-compared with the serum IAP level and the lymphocyte subsets(CD3,CD4,CD8)[J].Nihon Shokakibyo Gakkai Zasshi,1996,93(5):303-311.
[12] Lin Y,Kikuchi S,Obata Y,et al.Serum levels of transforming growth factor beta 1 are significantly correlated with venous invasion in patients with gastric cancer[J].J Gastroenterol Hepatol,2006,21(2):432-437.
[13] Li X,Yue ZC,Zhang YY,et al.Elevated serum level and gene polymorphisms of TGF-beta 1 in gastric cancer[J].J Clin Lab Anal,2008,22(3):164-171.
[14] Suda A,Saito N,Seshimo A,et al.Examination of transforming growth factor beta 1 expression in the serum and tumor tissue of gastric cancer[J].Int Surg,2009,94(2):182-188.
The expressions and significances of transforming growth factor beta 1 in the tissues and serum of gastric cancer
LIU Yiwen1,HU Yanmei2,XIONG Xiaoqing3,ZHAO Yingpei3,HU Jianguo3
1.Department of the Second Hepatopathy Surgery,the Second People’s Hospital of Jingzhou,Jingzhou 434000;2.Department of Infections,the People’s Hospital of Ningxia Hui Autonomous Region;3.Department of Gastroenterology,General Hospital of Ningxia Medical Univisty,China
ObjectiveTo detect the expression levels of transforming growth factor beta 1 in serum and tissues of patients with gastric cancer,and explore the possible pathological mechanism of that involved in the development of gastric cancer.MethodsThe level of serum TGF-β1 was measured by ELISA in 56 patients with gastric carcinoma,30 patients with atypical hyperplasia(low-moderate)of gastric mucosa and 20 normal persons.By using S-P method of immunohisto-chemical technique,the expression of TGF-β1 in the same cases of gastric carcinoma tissue,atypical hyperplasia(low-moderate)of gastric mucosa tissue and normal gastric mucosa tissue,and their relationship with clinicopathological characteristics were analyzed.ResultsThe level of TGF-β1 expression in serum of patients with gastric cancer group was(36.19 ±18.67)pg/mL,higher than those in atypical hyperplasia(low-moderate)and normal gastric mucosa group(P <0.01);the positive rate of TGF-β1 expression in cancer tissues was 83.9%(47/56),higher than those in atypical hyperplasia(low-moderate)of gastric mucosa group 43.3%(13/30)and normal gastric mucosa group 10%(2/20),with a significiant difference(χ2=45.46,P <0.01);the expressions of TGF-β1 in the tissues and serum of gastric cancer was correlated with the differentiation of tumors,the invasion depth,lymph node metastasis and clinical stage(TNM tumor stage)(P <0.05),but had no correlation with different part of gastric carcinomas(P >0.05).ConclusionTGF-β1 overexpression in gastric cancer suggest that it probably plays some roles in the origin and development of gastric cancer,TGF-β1 could be considered as reference points in evaluating the malignant biological behavior of gastric cancer.
Transforming growth factor beta 1;Gastric neoplasms;ELISA;Immunohistochemical
R735
A
1006-5709(2012)11-1023-04
2012-04-26
10.3969/j.issn.1006-5709.2012.11.012
刘义文,硕士研究生。E-mail:lyw258@qq.com
胡建国,教授,主任医师,研究方向:消化系统肿瘤的基础与临床。E-mail:Jianguo-h@hotmail.com
