SCF和G-CSF对骨髓单个核细胞移植治疗急性肝损伤的研究
2012-01-13韩明子金世柱王洪亮
房 霞,韩明子,张 敏,金世柱,王洪亮
哈尔滨医科大学附属第二医院重症医学科,黑龙江哈尔滨 150086
SCF和G-CSF对骨髓单个核细胞移植治疗急性肝损伤的研究
房 霞,韩明子,张 敏,金世柱,王洪亮
哈尔滨医科大学附属第二医院重症医学科,黑龙江哈尔滨 150086
目的探索联合应用干细胞因子(SCF)和粒细胞集落刺激因子(G-CSF)动员骨髓单个核细胞向急性肝损伤小鼠肝脏的迁移情况及对肝损伤的修复作用。方法应用CCl4/2-AAF制备急性肝损伤模型,然后行骨髓单个核细胞移植(体外先经PKH26标记)和皮下注射细胞因子SCF、G-CSF(实验按注射细胞因子的种类随机分为4组,A组:SCF+G-CSF;B组:SCF;C组:GCSF;D组:移植对照组),分别于移植后2周、4周处死小鼠,取其血清检测肝功(ALT、AST、ALB值),取肝组织观察小鼠骨髓单个核细胞向肝脏迁移的情况及损伤肝脏的修复情况。结果(1)PKH26标记阳性细胞数:A组>C组>B组、D组。A组与C组、B组、D组比较差异均有统计学意义(P<0.05);(2)病理组织学检测:A组小鼠肝脏修复较其他组好;(3)肝功指标:与B组、C组、D组比较,A组ALT,AST值差异有统计学意义(P<0.05),ALB值差异无统计学意义(P>0.05);移植后4周与2周比较差异有统计学意义(P<0.05)。结论(1)SCF和G-CSF可以通过动员骨髓干细胞促进急性肝损伤小鼠肝脏的修复。(2)联合应用SCF和GCSF比单独应用更能有效保护受损肝脏,并加快受损肝脏的再生。
干细胞因子;粒细胞集落刺激因子;骨髓单个核细胞;急性肝损伤;移植
肝移植用于治疗终末期肝病,尽管技术上取得了一定的进步,但并发症及死亡率仍高,而一部分患者由于供肝短缺而在等待中死亡。进行危险性更小的肝细胞移植替代肝移植或作为患者等待供肝的过渡性移植无疑具有广阔的前景[1]。目前,干细胞研究已在医学领域取得了令人瞩目的成就,也为终末期肝病的治疗提供了新思路[2]。如何将干细胞高效率的诱导成肝细胞及如何安全有效的植入受损肝脏是目前亟待解决的问题。而细胞因子动员干细胞的方式简单、无创,细胞因子的应用为干细胞治疗肝脏疾病开创了新的前景。
SCF和G-CSF对骨髓干细胞均有动员作用,G-CSF的动员作用强于SCF的动员作用,二者联合使用动员效果更强。大量试验[3-7]均证实了SCF和G-CSF对骨髓干细胞的迁移、归巢和促分化作用。虽然SCF和G-CSF单独应用均可修复肝损伤,但二者在肝损伤治疗方面的联合应用目前鲜有报道。本实验旨在探索联合应用SCF和G-CSF动员骨髓单个核细胞向急性肝损伤小鼠肝脏的迁移情况及对肝损伤的修复作用。
1 材料与方法
1.1 材料
1.1.1 实验动物:雄性BALB/c小鼠,体质量为18~22 g,恒温(22℃),光照周期(12 h:12 h),自由食水,购买于哈尔滨医科大学动物实验中心,饲养于哈尔滨医科大学公共卫生学院动物实验中心。
1.1.2 实验分组:A组(16只):rmSCF+rhG-CSF+骨髓移植组;B组(16只):rmSCF+骨髓移植组;C组(16只):rhG-CSF+骨髓移植组;D组(16只):仅骨髓移植组;E组(5只):模型检测组;F组(48只):供体组。
1.1.3 主要试剂:重组鼠干细胞因子(rmSCF)Pepro-Tech公司;重组人粒细胞集落刺激因子(rhG-CSF),麒麟鲲鹏生物药业有限公司;红色荧光染料PKH26美国Sigma公司;2-乙酰氨基芴(2-AAF),Fluka Biochemika;四氯化碳哈尔滨市鑫鹏化学试剂厂;小鼠淋巴细胞分离液,天津灏洋生物制品科技有限公司;聚乙二醇-400,天津天泰精细化学品有限公司;DMEM培养基及胎牛血清Invitrogen公司;苏木素伊红(HE)染色试剂盒,碧云天生物技术研究所。
1.2 方法
1.2.1 肝损伤模型的制备和检测:将溶于聚乙二醇的2-乙酰氨基芴按20 mg/kg灌胃共7 d,第8天按20 mL/kg腹腔注射0.1%四氯化碳橄榄油溶液,第9天行骨髓移植,第10天起继续按20 mg/kg灌胃2-乙酰氨基芴。模型检验:四氯化碳腹腔注射24 h后将E组5只小鼠摘眼球取血检测血清谷丙转氨酶(ALT),谷草转氨酶(AST)及白蛋白(ALB)值,并取出肝脏,苏木素-伊红染色观察其病理变化。
1.2.2 骨髓单个核细胞悬液的制备:取F组健康雄性BALB/c小鼠,摘眼球取血,离心后取其血清,暂时存放于-20℃冰箱内,待测ALT、AST、ALB值。将刚处死的小鼠碘伏消毒腿部皮肤,无菌手术取出供体鼠双侧股骨,放于无菌纱布上,用纱布尽量剥去肌肉组织,剪掉股骨两端,用无菌DMEM培养基,从一端插入骨髓腔,冲洗出骨髓,收无菌离心管中,再经过7→5号针头,吸管吹打成均匀的细胞悬液。
1.2.3 骨髓单个核细胞的分离与染色:将上述制备的细胞悬液以3 000 r/min离心5 min,弃上清,加入2 mL磷酸盐缓冲液(PBS)重悬,另取无菌离心管,加入2 mL密度为1.092的小鼠淋巴细胞分离液,将2 mL骨髓细胞重悬液加入装有淋巴细胞分离液的离心管中,1 500 r/min离心,20 min,可见离心管中液体分为4层,用无菌吸管将第2层(从上向下数)粉红色云雾状液体移入另一无菌离心管中,用PBS稀释。用计数板计数已分离的骨髓单个核细胞,每只动物分离出约2×107个单个核细胞(所有操作均在25℃进行)。将上述制备的骨髓单个核细胞悬液用5 mL PBS洗涤1次,3 000 r/min离心5 min,使细胞在离心管底部形成一个松散的细胞团,小心吸去上清,细胞团上剩余液体<25 μL。加入2 mL Diluent C重悬细胞保证细胞完全离散。以微量加样器取16 μL PKH26放入另一已装有2 mL Diluent C的离心管中,将骨髓细胞和Diluent C混悬液加入已装有PKH26和Diluent C的离心管中并迅速混匀,25℃孵育2~5 min,定时轻轻摇动离心管,加入等量血清终止染色反应,孵育1 min,再用等量含血清DMEM培养基稀释终止的反应液,3 000 r/min 25℃ 离心10 min,去上清。细胞团转入新试管中,PBS洗涤3次,加完全培养基将细胞浓度调至3×107/mL。(所用的PKH26浓度为4 μmol/L)。将细胞悬液调至106个/mL,取9滴细胞悬液于试管中,加1滴 0.4%台盼蓝染液,摇匀。用血细胞计数板在3min分别计数活细胞数(未染色者)和死细胞数(染色者)。活细胞率=活细胞总数/(活细胞总数+死细胞总数)×100%。细胞成活率>95%,可用于细胞移植。
1.2.4 骨髓单个核细胞移植:A组:将小鼠置于简易固鼠器中,用碘伏消毒尾部,于四氯化碳损伤1 d后经尾静脉注入0.3 mL骨髓单个核细胞悬液(细胞数均为3×106个)。同时,碘伏消毒腹部皮肤,连续5 d皮下注射 rmSCF(10 ug/kg·d)、rhG-CSF(30 ug/kg·d)。B组:碘复消毒尾部皮肤,于肝损伤1 d后经尾静脉注入等体积骨髓单个核细胞悬液,同时给予皮下注射等量rmSCF。C组:碘复消毒尾部皮肤,于肝损伤1 d后经尾静脉注入等体积骨髓单个核细胞悬液,同时给予皮下注射等量rhG-CSF。D组:碘复消毒尾部皮肤,于肝损伤1 d后经尾静脉注入等体积骨髓单个核细胞悬液,同时给予皮下注射等量生理盐水。
1.2.5 标本收集、保存及检测:分别于骨髓干细胞移植2周、4周后摘眼球取全血,离心采集血清,用全自动生化分析仪检测ALT、AST及ALB值。小鼠处死后迅速取肝组织,一部分肝组织置液氮中速冻,待制备冰冻切片,荧光显微镜观察骨髓单个核细胞向肝脏迁移的情况。另一部分肝组织在4℃下用40 g/L多聚甲醛固定48 h以上,石蜡包埋和切片,进行苏木素-伊红(HE)染色,光学显微镜下观察肝细胞的坏死及修复情况。
1.2.6 检测指标:干细胞移植情况:取鼠肝组织制备冰冻切片,荧光显微镜观察已标记PKH26的干细胞向肝脏迁移的情况。肝功变化:比较各组及同组不同时间点血清中AST、ALT、ALB的值。病理学改变:肝脏的大体形态:质地、边缘、颜色、表面是否光滑等。肝脏的病理组织学改变:肝细胞坏死程度、组织修复程度等。
1.3 统计学处理 20倍镜下,每张冰冻切片随机观察10个非重复视野,将荧光标记阳性细胞数相加,记为 PKH26阳性细胞数/切片。ALT、AST、ALB、PKH26阳性细胞数/切片用SPSS 17.0统计学软件处理实验数据,均用均数±标准差表示,采用析因设计方差分析法,P<0.05为差异有统计学意义。
2 结果
2.1 急性肝损伤模型的检验 E组小鼠ALT、AST及ALB 值分别为:1978.12 ±795.07 U/L、2610.28 ±217.01 U/L、36.33 ±0.70 g/L。HE 染色结果显示:肝细胞大面积坏死,以中央小叶区坏死为主,坏死区肝细胞核消失,周围肝细胞胞浆疏松化(见图7、8),证明急性肝损伤模型建立成功。
2.2 PKH26标记阳性细胞的检测 PKH26在波长551 nm的激发光作用下发出红色荧光,在荧光显微镜下观察,发现小鼠肝脏组织冰冻切片上均可见红色的荧光光点,提示体外经PKH26标记的骨髓单个核细胞能够迁移至肝脏。移植2周后迁移至肝脏的骨髓单个核细胞主要位于汇管区,而4周后骨髓单个核细胞均匀分散在肝实质内(见图1~6)。图1~2骨髓单个核细胞移植后2周,移植的细胞主要位于汇管区,尚未弥漫性分散到肝实质内。图3~6骨髓细胞移植后4周各组荧光图片,PKH26标记阳性细胞数:A组>C组>B组、D组。同一时间点各实验组间相比较,A组荧光细胞数目较其他组多(P<0.05),同一实验组移植后2周与4周相比,迁移的细胞数目无统计学意义(P>0.05,见表1)。结果表明:SCF和G-CSF均可动员骨髓干细胞向受损肝脏迁移,二者联合应用具有协同作用。
2.3 肝脏组织学检测 HE染色观察发现,相同时间点A组、B组、C组均较D组损伤轻(2周、4周,其中A组较B组、C组轻,B组和C组无明显差别;移植后4周与2周时比较,肝脏损伤较轻,其中A组肝组织4周时已基本上恢复正常(见图7~16)。图7~8急性肝损伤模型HE染色图片,可见肝细胞大面积坏死,以中央小叶区坏死为主,坏死区肝细胞核消失,周围肝细胞胞浆疏松化,可见中性粒细胞浸润。图9~10A组小鼠骨髓细胞移植后2周、4周HE染色图片,图9可见肝细胞弥漫性脂肪变性,小灶状坏死,少量中性粒细胞浸润,肝实质内可见移植的骨髓单个核细胞。图10肝细胞几乎恢复正常,无坏死。图11~14B组,C组小鼠骨髓细胞移植后2周、4周HE染色图片,图11、13可见肝细胞弥漫性变性肿胀,小灶状坏死,肝实质内可见骨髓单个核细胞及中性粒细胞浸润。图12、14肝细胞变性减轻,仍可见少量点状坏死。图15~16D组小鼠骨髓细胞移植后2周、4周HE染色图片,图15可见肝细胞弥漫性变性,肿胀明显,肝实质内可见骨髓单个核细胞。图16肝细胞弥漫变性,仍明显肿胀,空泡变明显。各组均可见迁移至肝脏的骨髓单个核细胞。结果表明:SCF与G-CSF单独应用对受损肝脏的修复有一定作用,但作用均较弱,二者联合应用对受损肝脏的修复作用效果较单独应用好。
2.4 肝功检测 全自动生化分析仪检测血清ALT、AST、ALB值,用SPSS 17.0统计学软件进行析因设计方差分析,结果见表2~4。结果表明:ALT、AST值改善程度大小依次为:A组>C、B组>D组,B组与C组差异无统计学意义。骨髓细胞移植后4周与2周比较,4周时ALT、AST值基本已经达到正常或接近正常值。而ALB值各组间及各时间点之间差异无统计学意义。实验表明:SCF+G-CSF+骨髓细胞移植组ALT、AST值改善较其他组明显,肝脏修复也较其他组好。
表1 肝脏冰冻切片中PKH26标记阳性细胞数(± s)Tab 1 The contract of PKH26 labeled positive cells in the liver of four groups(± s)
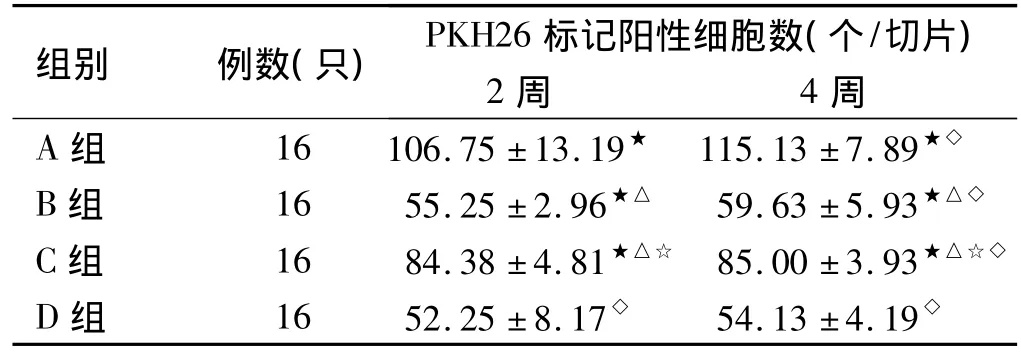
表1 肝脏冰冻切片中PKH26标记阳性细胞数(± s)Tab 1 The contract of PKH26 labeled positive cells in the liver of four groups(± s)
★与D组比较,P<0.05;△与A组比较,P<0.05;☆与C组比较,P <0.05;◇与2周比较,P>0.05
组别 例数(只) PKH26标记阳性细胞数(个/切片)2周 4周A 组 16 106.75 ±13.19★ 115.13 ±7.89★◇B 组 16 55.25 ±2.96★△ 59.63 ±5.93★△◇C 组 16 84.38 ±4.81★△☆ 85.00 ±3.93★△☆◇D 组 16 52.25 ±8.17◇ 54.13 ±4.19◇
表2 骨髓单个核细胞移植对小鼠血清ALT水平的影响(± s)Tab 2 The level of ALT in the serum of mice after bone marrow mononuclear cells transplantation(± s)
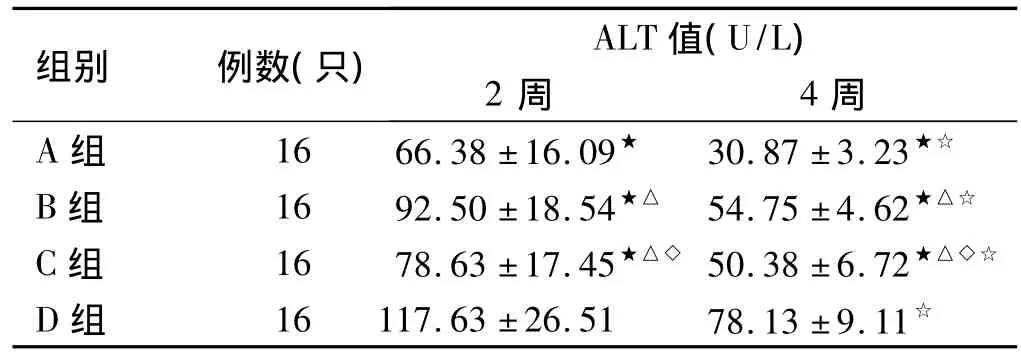
表2 骨髓单个核细胞移植对小鼠血清ALT水平的影响(± s)Tab 2 The level of ALT in the serum of mice after bone marrow mononuclear cells transplantation(± s)
★与D组比较,P<0.05;△与A组比较,P<0.05;◇与B组比较,P >0.05;☆与2周比较,P<0.05
组别 例数(只) ALT值(U/L)2周 4周A 组 16 66.38 ±16.09★ 30.87 ±3.23★☆B 组 16 92.50 ±18.54★△ 54.75 ±4.62★△☆C 组 16 78.63 ±17.45★△◇ 50.38 ±6.72★△◇☆D 组 16 117.63 ±26.51 78.13 ±9.11☆
表3 骨髓单个核细胞移植对小鼠血清AST水平的影响(± s)Tab 3 The level of AST in the serum of mice after bone marrow mononuclear cells transplantation(± s)

表3 骨髓单个核细胞移植对小鼠血清AST水平的影响(± s)Tab 3 The level of AST in the serum of mice after bone marrow mononuclear cells transplantation(± s)
★与D组比较,P<0.05;△与A组比较,P<0.05;◇与B组比较,P >0.05;☆与2周比较,P <0.05
组别 例数(只) AST值(U/L)2周 4周A 组 16 136.25 ±39.95★ 98.38 ±12.82★☆B 组 16 190.88 ±57.53★△ 134.38 ±37.70★△☆C 组 16 193.88 ±36.24★△◇115.25 ±13.94★△◇☆D 组 16 353.75 ±103.59 168.75 ±45.26☆
表4 骨髓单个核细胞移植对小鼠血清ALB水平的影响(± s)Tab 4 The level of ALB in the serum of mice after bone marrow mononuclear cells transplantation(± s)
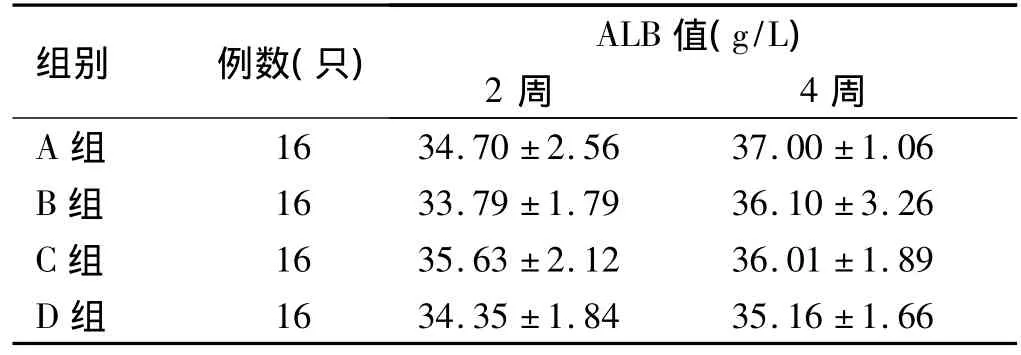
表4 骨髓单个核细胞移植对小鼠血清ALB水平的影响(± s)Tab 4 The level of ALB in the serum of mice after bone marrow mononuclear cells transplantation(± s)
各组之间、各时间点之间比较,均P>0.05
组别 例数(只) ALB值(g/L)2周 4周A组16 34.70 ±2.56 37.00 ±1.06 B 组 16 33.79 ±1.79 36.10 ±3.26 C 组 16 35.63 ±2.12 36.01 ±1.89 D组16 34.35 ±1.84 35.16 ±1.66
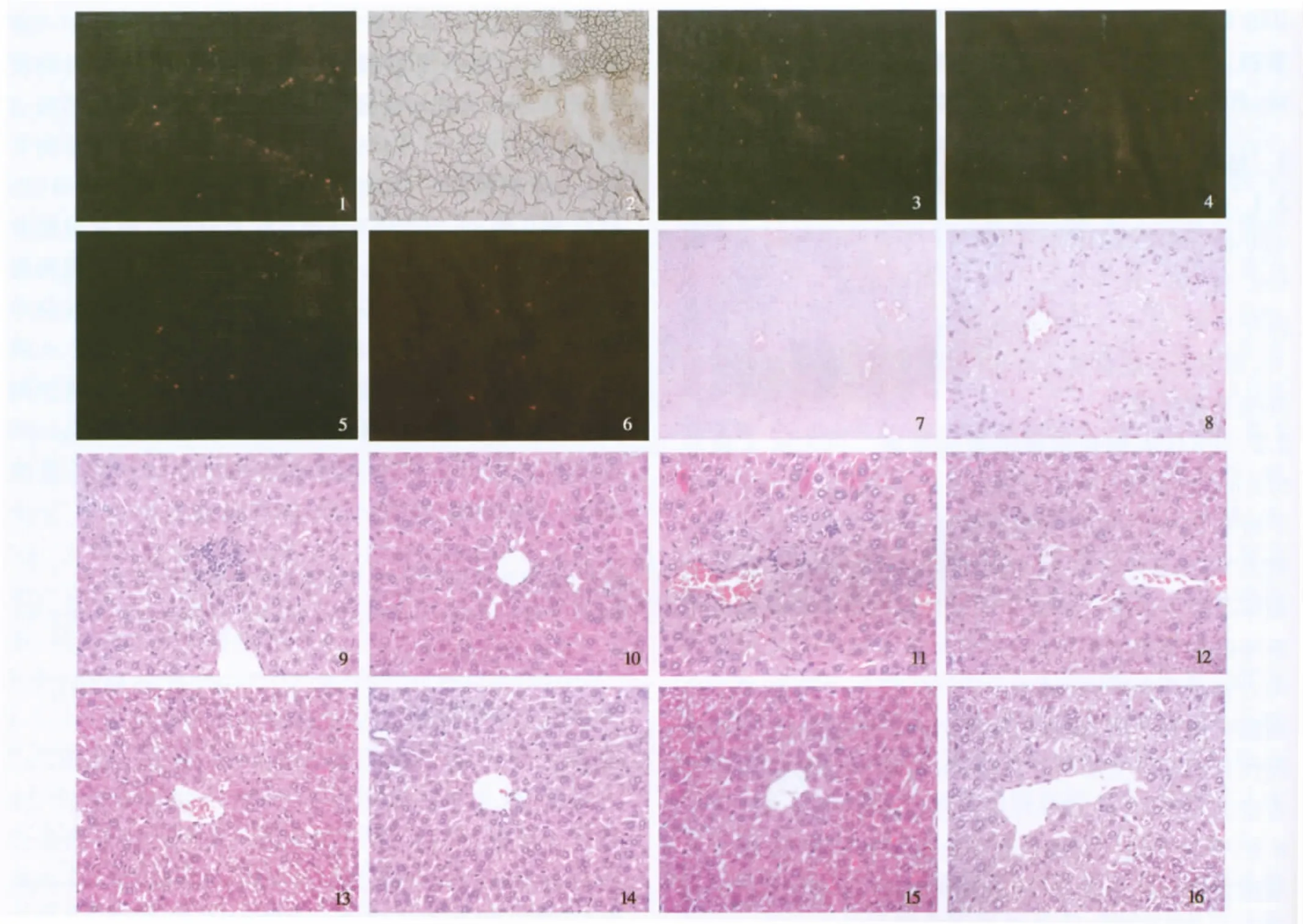
图1 移植后2周肝脏冰冻切片图像(200×);图2 图1所对应的光学显微镜下表现(200×);图3 移植后4周A组荧光图片(200×);图4 移植后4周B组荧光图片(200×);图5 移植后4周C组荧光图片(200×);图6 移植后4周D组荧光图片(200×);图7 急性肝损伤模型HE染色图片(100×);图8 急性肝损伤模型HE染色图片(400×);图9 移植后2周A组HE染色图片(400×);图10 移植后4周A组HE染色图片(400×);图11 移植后2周B组HE染色图片(400×);图12 移植后4周B组HE染色图片(400×);图13 移植后2周C组HE染色图片(400×);图14 移植后4周C组HE染色图片(400×);图15 移植后2周D组HE染色图片(400×);图16 移植后4周D组HE染色图片(400×)Fig 1 The fluorescence staining positive cells of the liver 2 weeks after transplantation(200×);Fig 2 The optical microscope image of the liver corresponding to pictrue 1(200×);Fig 3 The fluorescence staining positive cells of the liver 4 weeks after transplantation(group A:200×);Fig 4 The fluorescence staining positive cells of the liver 4 weeks after transplantation(group B:200×);Fig 5 The fluorescence staining positive cells of the liver 4 weeks after transplantation(group C:200×);Fig 6 The fluorescence staining positive cells of the liver 4 weeks after transplantation(group D:200×);Fig 7 Micrographs of histological specimens of hepatic tissue 24 hours after treatment of CCl4(HE staining:100×);Fig 8 Micrographs of histological specimens ofhepatic tissue 24 hours after treatment of CCl4(HE staining:400×);Fig 9 Micrographs of histological specimens of hepatic tis-sue 2 weeks after transplantation(Group A ,HE staining:400×);Fig 10 Micrographs of histological specimens of hepatic tissue 4 weeks after transplantation(Group A,HE staining:400×);Fig 11 Micrographs of histological specimens of hepatic tissue 2 weeks after transplantation(Group B,HE staining:400×);Fig 12 Micrographs of histological specimens of hepatic tissue 4 weeks after transplantation(Group B,HE staining:400×);Fig 13 Micrographs of histological specimens of hepatic tissue 2 weeks after transplantation(Group C,HE staining:400×);Fig 14 Micrographs of histological specimens of hepatic tissue 4 weeks after transplantation(Group C,HE staining:400×);Fig 15 Micrographs of histological specimens of hepatic tissue 2 weeks after transplantation(Group D,HE staining:400×);Fig 16 Micrographs of histological specimens of hepatic tissue 4 weeks after transplantation(Group D,HE staining:400×)
3 讨论
干细胞是具有自我更新、高度增生和多向分化潜能的细胞群体,特定条件下可以分化为不同的功能细胞,形成多种组织和器官。国内外众多试验表明[8],无论是在生理还是在病理条件下,骨髓干细胞均可以分化为肝细胞。有研究证实[9],在肝脏损伤的条件下,骨髓干细胞更易于定植于肝脏。其机制可能是肝损伤后机体产生了对肝再生有利的因子,例如:肝细胞生长因子、成纤维细胞因子-4、干细胞因子、基质细胞衍生因子-1等。众多实验表明[10],这些刺激因子的介入可能加速了骨髓对肝细胞的诱导过程。
如何将干细胞高效率的诱导成肝细胞是目前亟待解决的问题。而细胞因子动员干细胞的方式简单、无创,细胞因子的应用逐渐成为干细胞移植领域研究的热点[11]。干细胞因子(SCF)是一种重要造血细胞因子,它是酪氨酸激酶受体c-Kit的配体。SCF主要作用于早期造血干细胞、原始造血祖细胞,并且诱导这些细胞的存活、增殖和分化。作为骨髓干细胞的动员剂,SCF是当前国外研究的重点。SCF最初主要应用于血液疾病的研究,近年来,许多研究者开始将其应用于其他领域的治疗,例如:心血管疾病,神经系统疾病等[12]。最近的研究表明[13],SCF 在肝脏疾病中也发挥了很大的作用,SCF可以促进肝再生。而G-CSF是众所周知的外周血干细胞动员剂,G-CSF可以通过动员自体骨髓干细胞能够促进部分肝移植物的再生并且减少肝脏损伤[14]。研究表明,SCF单独使用生物学作用低,但它与其他细胞因子联合应用具有很强的协同作用。SCF和G-CSF联合使用,可使骨髓干细胞水平持续增高,比任何一种细胞因子单独应用增强,并且后续时间比单用G-CSF增加100倍[15]。
目前,对于细胞因子SCF和G-CSF在促进肝再生方面的机制尚不明确,许多学者从细胞内信号传导方面对SCF与G-CSF协同效应的机理进行了探讨。Papayannopoulou等[16]认为,SCF/c-kit可能是与动员有关的一条共同途径。而目前多数研究认为,G-CSF和SCF的协同效应依赖于磷脂酰肌醇3激酶(PI3K)及丝裂原活化蛋白激酶(MAPK),而信号传导和转录激活因子3(STAT3)可能是SCF与G-CSF受体下游信号互补途径的一个关键元素[17]。STAT在造血细胞中是细胞因子信号传递的关键中介,借助于调节周期素依赖激酶(cdk)抑制剂P27Kip-1的表达来控制细胞的增殖[18]。Duarte 等[17]在对 M07e-G 细胞系的研究中发现,G-CSF可以诱发STAT1/STAT3的酪氨酸磷酸化,使之激活。而SCF能够诱发STAT3的ser727磷酸化,且在与G-CSF同用时可引起ser727最大程度的磷酸化(G-CSF+SCF较SCF引起ser727磷酸化的程度高54%),ser727磷酸化可能有利于酪氨酸残基已磷酸化的STAT3发挥最大转录活性[19],增强STAT依赖基因的活性。G-CSF与SCF联用引起的这一系列变化,表现为二者的协同增殖效应。此外,还有实验证明[20],MO7e-G细胞可用于鉴别这两种细胞因子协同作用的关键之处(在扩增和基因表达方面)。这两种细胞因子通过下调p27kip1及使酪氨酸和丝氨酸残基STAT3独立磷酸化而在生化和分子水平产生作用。此外,在其他细胞因子如IL-17介导的粒细胞生成中,也证实需要G-CSF及SCF的协同作用[21]。
本实验旨在研究SCF和G-CSF联合应用对骨髓干细胞向急性肝损伤小鼠肝脏迁移的影响,并观察二者的应用是否可以加快受损肝脏的修复。目前虽有二者联合应用的报道,但在促进骨髓干细胞修复急性肝损伤方面鲜有报道。这是本实验的创新点。
在实验中,选择近交系BALB/c小鼠作为实验动物,利用其遗传相似性的特点,可看做是自体骨髓移植,这就避免了细胞移植过程中的免疫排斥反应等问题。
PKH26是一种标记细胞膜的带有长脂肪族末端的红色荧光染料,它可以与细胞膜上的脂类区域稳定结合,在551 nm激发光下可发出波长为567 nm的红色荧光,在荧光显微镜下即可观察标记的细胞。PKH26具有染色速度快,染色均匀,且性质稳定,无细胞毒作用,荧光衰减慢等特点,因此,是干细胞研究中常用的细胞标记物[22]。本实验选用PHK26红色荧光染料作为骨髓单个核细胞的示踪剂,经体外染色后输入小鼠体内进行追踪,在荧光显微镜下,可观察到小鼠肝脏冰冻切片中有散在红色荧光标记,表明体外经PKH26标记的骨髓单个核细胞可以迁移至肝脏。并且通过计数冰冻切片中PKH26标记阳性细胞数,比较SCF和G-CSF对骨髓单个核细胞的动员作用,从而为观察二者的协同作用提供依据。
本实验研究发现,SCF和G-CSF联合应用比二者单独应用确实能更好的改善肝功,加快受损肝脏的修复。其具体机制不清,可能与促进了骨髓干细胞向受损肝脏的迁移及分化有关,也可能促进了肝脏内源性修复有关。总之,二者联合应用加快了受损肝脏的修复,为终末期肝病的治疗带来了新的希望。
虽然骨髓干细胞具有广阔的应用前景,但是还有许多争论性的问题没有解决,如何有效地获得大量同质性的骨髓干细胞,有待于对其细胞学特点和异质细胞群中各类细胞标志物的进一步研究。揭示干细胞发育的分子机制的研究,干细胞移植的免疫问题,影响干细胞移植成功的因素都是有待深入研究和亟待解决的问题。尽管如此,由于骨髓干细胞具有公认的多向分化性,被认为是一种理想的细胞治疗和基因治疗的靶细胞,相信随着研究的进一步深入,一定会为其临床应用带来新的前景。
[1] Cai JR,Liu RG.Combined rhG-rhCSF anf rhSCF mobilization of bone-marrow stem cells for the treatment of acute myocardial infarction in rats[J].Int J Cardiovasc Dis,2006,33(2):129-132.
蔡继锐,刘仁光.rhG-CSF和rhSCF联合动员骨髓干细胞治疗大鼠急性心肌梗死[J].国际心血管病杂志,2006,33(2):129-132.
[2] Li YT,Qiu LG.The study on the effects of stem cell factor and granulocyte colony-stimulating factor on mobilization of peripheral blood stem cells[J].Anthology of Medicine,2004,23(3):368-371.
李云涛,邱录贵.干细胞因子与粒细胞集落刺激因子联合用于外周血干细胞移植动员的研究[J].医学文选,2004,23(3):368-371.
[3] Lin L,Zhou SH,Qi SS,et al.The effects of granulocyte colony-stimulating factor and stem cell factor for the treatment of acute myocardial infarction in rats[J].Chin J Cardiol,2005,33(4):376-377.
林玲,周胜华,祁述善,等.粒细胞集落刺激因子、干细胞因子对大鼠急性心肌梗死实验治疗作用的初步观察[J].中华心血管杂志,2005,33(4):376-377.
[4] Cai JR ,Liu RG,Liu DL.Effects of granulocyte colony-stimulating fac tor plus stem cell factor on the cardiac function of rats with acute myocardial in farction[J].Journal of Clinical Rehabilitative Tissue Engineering Research,2007,11(7):1394-1396.
[5] Glaspy J,Davis MW,Parker WR,et al.Biology and clinical potential of stem-cell factor[J].Cancer Chemother Pharmacol,1996,38(Suppl):S53-S57.
[6] Zhang GQ,Fang CH,Yan Z.Pathological examination of mesenchymal stem cells homing to liver during allografting in rats[J].World Chin J Digestol,2005,13(10):1198-1201.
张刚庆,方驰华,颜政.同种异体MSC移植在大鼠肝内定居的病理检测[J].世界华人消化杂志,2005,13(10):1198-1201.
[7] Xiang GA,Zhang GQ,Fang CH,et al.A preliminary study of the homing capacity of allograft mesenchymal stem cells to rat liver[J].J First Mil Med Univ,2005,25(8):994-997.
向国安,张刚庆,方驰华,等.同种异体骨髓间质干细胞移植在大鼠肝内定居能力初步研究[J].第一军医大学学报,2005,25(8):994-997.
[8] Okumoto K,Saito T,Haga H,et al.Characteris tics of rat bone marrow cells differentiated into a liver cell lineage and dynamics of the transplanted cells in the injured liver[J].J Gastroenterol,2006,41(1):62-69.
[9] Healey G,Veale MF,Sparrow RL,et al.A fluorometric quantitative erythrophagocytosis assay using human THP-1 monocytic cells and PKH26-labelled red blood cells[J].J Immunol Methods,2007,322(1-2):50-56.
[10] Yamamoto N,Terai S,Ohata S,et al.A subpopulation of bone marrow cells depleted by a novel antibody,anti-Liv8,is useful for cell therapy torepair dama-ged liver[J].Biochem Biophys Res Commun,2004,3l3(4):1110-1118.
[11] Ren X,Hu B,Colletti L.Stem cell factor and its receptor,c-kit,are important for hepatocyte proliferation in wild-type and tumor necrosis factor receptor-1 knockout mice after 70% hepatectomy [J].Surqery,2008,143(6):790-802.
[12] He WZ,Li YZ,Sha HF,et al.Pathologic changes of bone mesenchymal stem cell transplantation after acute myocardial infarction in rats[J].Journal of Clinical Rehabilitative Tissue Engineering Research,2007,11(3):486-489.
何卫中,李颖则,沙慧芳.骨髓间质干细胞移植治疗大鼠急性心肌梗死的病理学观察[J].中国组织工程研究与临床康复,2007,11(3):486-489.
[13] Dormady SP,Bashayan O,Dougherty R,et al.Immortalized multipotential mesenchymal cells and the hematopoietic microenvironment[J].J Hematother Stem Cell Res,2001,10(1):125-140.
[14] Woldbaek PR,Hoen IB,Christensen G,et al.Gene expression of colony-stimulating factors and stem cell factor after myocardial infarction in the mouse[J].Acta Physiol Scand,2002 ,175(3):173-181.
[15] Sun L,Lee J,Fine HA.Neuronally expressed stem cell factor induces neural stem cell migration to areas of brain injury[J].J Clin Invest,2004,113(9):1364-1374.
[16] Papayannopoulou T,Priestley GV,Nakamoto B.Anti-VLA4/VCAM-1-induced mobilization requires cooperative signaling through the kit/mkit ligand pathway[J].Blood,1998,91(7):2231-2239.
[17] Duarte RF,Frank DA.SCF and G-CSF lead to the synergistic induction of proliferation and gene expression through complementary signaling pathways[J].Blood,2000,96(10):3422-3430.
[18] Kaplan MH,Daniel C,Schindler U,et al.Stat proteins control lymphocyte proliferation by regulating p27Kip1 expression[J].Mol cell boil,1998,18(4):1996-2003.
[19] Wen Z,Zhong Z,Darnell JE Jr.Maximal activation of transcription by Stat1 and Stat3 requires both tyrosine and serine phosphorylation[J].Cell,1995,82(2):241-250.
[20] Duarte RF,Franf DA.The synergy between stem cell factor(SCF)and granulocyte colony-stimulating factor(G-CSF):molecular basis and clinical relevance [J].Leuk Lymphoma,2002,43(6):1179-1187.
[21] Schwarzenberger P,Huang W,Ye P,et a1.Requirement of endogenous stem cell factor and granulocyte-colony-stimulating factor for IL-17-mediated granulopoiesis [J].J Immunol,2000,164(9):4783-4789.
[22] Jin SZ,Han MZ,Qu B,et al.Study on the utilization of PKH26 in the transplantation of bone marrow mononuclear cells to liver in mice[J].Chin J Gastroentero Hepatol,2008,17(1):33-35.
金世柱,韩明子,曲波,等.PKH26荧光示踪迹在小鼠骨髓单个核细胞肝内迁移过程中标记作用的研究[J].胃肠病学和肝病学杂志,2008,17(1):33-35.
Effects of stem cell factor(SCF)and granulocyte colony stimulating factor(G-CSF)on the transplantation of bone marrow mononuclear cells(BMMCs)for the treatment of acute liver failure
FANG Xia,HAN Mingzi,ZHANG Min,JIN Shizhu,WANG Hongliang
Department of ICU,the second Hospital of Harbin Medical University,Harbin 150086,China
ObjectiveTo explore the amount of bone marrow mononuclear cells migrating to the liver during grafting in mice,and the effects on liver function.MethodsFirst,prepared acute liver failure model using CCl4/2-AAF,then,BMMCs(labeled with PKH26 before transplantation)were infused into the caudal veins of different mice with homogeneity and hypodermic inject SCF,G-CSF simultaneously.All the mice were divided into 4 groups randomly:group A:SCF+G-CSF and group B:SCF,group C:G-CSF and group D:control treatment.2 weeks and 4 weeks after transplantation,the values of ALT,AST and ALB were assessed,the status of grafting cells and the histological assessment of the liver were studied.Results(1)The PKH26 labeled cells:group A >group C>group B and group D.Compared with group A ,there was significant difference(P <0.05);(2)Histological finding of the liver:group A was better than others;(3)The levels of ALT,AST and ALB:compared with group A,there were significant differences in ALT,AST(P <0.05),but there was no difference in ALB between them(P >0.05).Compared with 2 weeks after transplantation,there was significant difference(P <0.05).Conclusion(1)SCF and G-CSF can promote migration of BMMCs to the liver in mice with acute injury,and accelerate the liver regeneration;(2)SCF combined with G-CSF are more effectively protect the liver than single use.
Stem cell factor;Granulocyte colony stimulating factor;Bone marrow mononuclear cells;Acute liver failure;Transplantation
R571
A
1006-5709(2012)11-1037-06
2012-08-20
10.3969/j.issn.1006-5709.2012.11.015
房霞,硕士研究生,研究方向:干细胞移植与肝脏再生。E-mail:afang919@163.com
韩明子,主任医师,教授,硕士研究生导师,研究方向:干细胞移植与肝脏再生。E-mail:hanmingzi@163.com
