海洋耐高温酸性α-淀粉酶水解玉米淀粉的研究
2012-01-12李瑛吕明生王淑军李华钟房耀维焦豫良刘姝
李瑛,吕明生,王淑军,李华钟,房耀维,焦豫良,刘姝
(1.江南大学工业生物技术教育部重点实验室,江苏无锡214122;2.淮海工学院海洋学院,江苏连云港222005)
高温α-淀粉酶是淀粉液化中主要采用的酶[1],该酶的应用对整个液化工艺起关键性作用。目前工业用高温α-淀粉酶主要来自嗜热脂肪芽胞杆菌(Geobacillus stearothermophilus)和地衣芽胞杆菌(Bacillus licheniformis),这些酶存在耐热性差、最适pH高(6.0)、酶热稳定性需Ca2+维持[2]等缺点。因此工业水解淀粉制糖时需先将粉浆由天然酸性pH 4.5左右调至6.0进行液化,在下一步糖化时还需根据糖化酶的性质将pH调回4.0~4.5。反复调节pH增加了生产成本和产生副产物的可能[3]。随着企业技术水平的提高和节约用水的管理,部分淀粉调浆水采用产品蒸发浓缩产生的二次冷凝水。这种冷凝水较为纯净,几乎不含有Ca2+、Na+等离子[4],目前用于工业生产的淀粉酶由于其热稳定性依赖于Ca2+,对于保持酶解效果的持续稳定和淀粉液化工艺的稳定还有所欠缺。海洋是微生物的宝库,从海洋中筛选获得符合工业生产的酶也已成为近几年的热点。可以在80~110℃范围内生长的深海嗜热古菌,是高温α-淀粉酶最重要的来源。许多研究者致力于高温α-淀粉酶的研究,以期获得新型高温α-淀粉酶以解决目前高温α-淀粉酶存在的问题,以研究较为深入的Pyrococcus furiosus的高温酸性淀粉酶基因[5]为例,1997年丹麦Steen[6]将Pyrococcus furiosus的α-淀粉酶基因分别在大肠埃希菌和枯草杆菌中成功表达,2003年国内的沈微等[7]实现了该基因在大肠埃希菌中的分泌表达,2006年郭建强等[3]实现了在毕赤酵母中的高效分泌表达。本研究小组从深海热液口获得了1株产耐高温酸性α-淀粉酶的超嗜热古菌Thermococcus siculi HJ21,并对该高温耐酸性α-淀粉酶的基因进行了克隆、表达、重组酶纯化、酶学性质、定向进化等研究[8-10]。该酶的最适作用温度为95℃,在100℃仍有60%的酶活力,酶的热稳定性不依赖于Ca2+,且热稳定性好,酶在90℃的半衰期为5 h,100℃处理2 h后仍有40%的酶活。酶的最适作用pH为5.0,在pH 4.5仍有80%的活力,pH在5.5~7.0较稳定。可以解决目前应用耐高温α-淀粉酶存在的3方面问题。本实验对该工程菌所产的海洋耐高温酸性α-淀粉酶的水解工艺进行研究,为新型高温淀粉酶的工业应用奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株重组耐高温酸性α-淀粉酶基因工程菌E.coli BL21/pET28a-amy,本实验室保存。
1.1.2培养基LB培养基(g/L):胰蛋白胨10,酵母粉5,NaCl 10,pH 7.5。使用时加入终浓度为50 μg/mL的卡那霉素。
1.1.3 材料与试剂玉米淀粉,无锡永丰淀粉工程有限公司;胰蛋白胨、酵母粉、氯化钠、可溶性淀粉、硫酸铜、酒石酸钾钠、氢氧化钠、葡萄糖等均为国产分析纯试剂。
1.1.4 仪器与设备回转式恒温调速摇瓶柜,上海欣蕊自动化设备有限公司;DK-S22型电热恒温水浴锅,上海精宏实验设备有限公司;PHS-2C型精密酸度计,上海精密科学仪器厂;DHG-9030A电热恒温鼓风干燥箱,上海旦鼎国际贸易有限公司;计时器及各种玻璃器皿。
1.2 方法
1.2.1 高温酸性α-淀粉酶的制备将工程菌E.coli BL21/pET28a-amy接种于含有50 μg/mL卡那霉素的液体LB培养基中,37℃、180 r/min培养过夜制备种子液;再将种子液转接至上述培养基中,37℃、180 r/min培养至OD600为0.6左右,加入终浓度为1 mmol/L的IPTG同条件下诱导培养5 h;4℃,10 000 r/min离心5 min收集菌体;将诱导表达收集的菌体用磷酸缓冲液(0.5 mmol/L、pH 7.0)重悬菌体,超声波破碎菌体(400 W,超声3 s,停7 s,共超声15 min),4℃,12 000 r/min离心10 min,收集上清液作为粗酶液。
1.2.2 酶解工艺流程精确称取一定质量的玉米淀粉,加水调成所需浓度的粉浆,加酸或碱调节至所需pH,移入恒温水浴锅中按要求加入一定量的耐高温α-淀粉酶,反应一段时间后取出灭酶并冷却液化液,测定DE值[11]。由于水分含量小于30%时,淀粉糊化较为缓慢且不完全,同时兼顾设备利用率等方面,文中采用300 g/L的粉浆浓度为起始浓度[12]。
1.2.3 DE值测定方法直接滴定法测定还原糖含量[13],水解液中还原糖以葡萄糖计占干物质的百分比为DE值。
1.2.4 单因素实验方法及最佳水解工艺的确定
以本实验室构建的基因工程菌所产的耐高温酸性α-淀粉酶为液化酶,以液化温度90℃,玉米淀粉天然pH,酶用量为16 U/g淀粉、粉浆浓度为300 g/L为基本实验条件,分别改变液化时间、酶用量、液化温度、粉浆浓度及液化pH等条件来考察其对玉米淀粉液化效果的影响。为了确定酶水解玉米淀粉的最佳工艺条件,根据单因素的实验结果,设计正交试验L9(34),试验因素水平见表1。
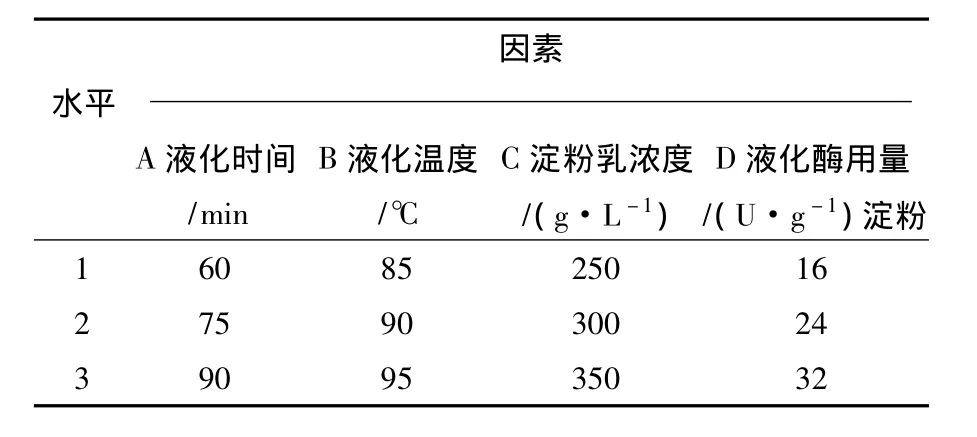
表1 耐高温酸性α-淀粉酶正交试验因素水平表Table 1 Factor and level of orthogonal test of the thermo-stable and acid-stable α-amylase
2 结果与分析
2.1 玉米淀粉液化影响因素研究
2.1.1 液化时间对液化的影响从图1中可以看出,淀粉液化在75 min以内时速度很快,DE值增加迅速,在75 min以后,DE值的增加量趋缓。分析原因可能是α-淀粉酶对长链淀粉或糊精水解的速度比短链快,随着水解的进行,液化液中短链多糖数量逐渐增加,从而使水解的速度变慢[14]。同时玉米淀粉中含有直链淀粉和支链淀粉,两者的比例和含量对淀粉的水解有一定影响[15],α-1,6糖苷键的存在又进一步影响了酶的水解速度。因此,该酶的液化时间控制在75 min左右为宜。后续的单因素试验水解时间均控制为75 min。

图1 液化时间对DE值的影响Fig.1 Effect of different time on DE value
2.1.2 酶用量对液化的影响从图2中可见,液化DE值随着酶用量的增加而增加,在酶用量8~16 U/g淀粉范围内增幅明显,酶用量超过16 U/g淀粉时,DE值增长渐缓。产生这种现象的原因可能是随着酶用量的增加,底物相对变少,使得酶用量对水解速率的影响减弱。因此酶的用量为16 U/g淀粉以上时开始趋于饱和,酶的催化效果也发挥到最大,选择该范围的酶用量可以平衡工业生产成本与产品质量(淀粉水解的程度)的关系,获得较理想的结果。
2.1.3 温度对液化的影响从图3中可以看出,液化DE值的最高点出现在90℃处,温度太低时淀粉链不能充分伸展,且酶分子的作用速率较低,导致酶切只能在局部较为缓慢的进行,液化的DE值较低;温度过高时超过了淀粉酶的最适作用温度,酶分子出现失活现象,导致液化DE值下降[16]。目前工业上采用液化的主流工艺为瞬间高温喷射液化,淀粉颗粒在喷射罐105~110℃经过5 min的高温喷射糊化变成液状[17],因此液化时采用的液化酶的作用温度越接近105~110℃越好,本实验室制备的淀粉酶最适作用温度为90℃,在105~110℃时仍有催化活性,基本可以满足工业应用需求。
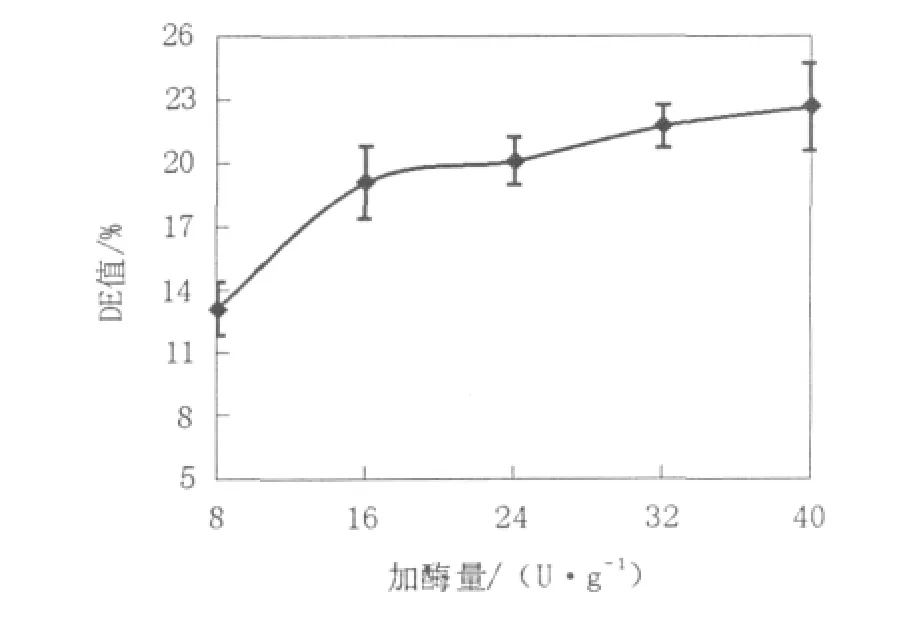
图2 酶用量对DE值的影响Fig.2 Effect of dosage of amylase on DE value

图3 温度对DE值的影响Fig.3 Effect of different temperature on DE value
2.1.4 不同粉浆浓度对液化的影响从图4中看出,随粉浆浓度的增加,玉米淀粉液化DE值下降,当粉浆浓度超过300 g/L时,DE值下降明显,液化DE值随粉浆浓度增大而下降的原因可能是粉浆浓度增大不利于底物与淀粉酶的结合。水作为一种增塑剂,可影响淀粉分子的迁移,决定淀粉分子链间的聚合速率,对淀粉的糊化和老化特性影响很大[18]。含水量太低时淀粉糊化不完全,使得淀粉酶不能很好地发挥作用。在工业应用上综合考虑提高设备利用率、降低用水量、保证液化效率等因素,选择200~300 g/L的淀粉浓度较为合适。

图4 粉浆浓度对DE值的影响Fig.4 Effect of different concentration of starch on DE value
2.1.5 不同pH对液化的影响从图5中看出,该酶的最适水解pH是4.5,高于或者低于这个pH后水解DE值均会有不同程度的下降。之前对该淀粉酶的酶学性质研究表明其最适作用pH为5.0,而本实验中获得的最适水解pH为4.5,这可能是由于高浓度的淀粉对酶分子具有保护作用,使得其作用的pH范围变宽,最适的水解pH出现了迁移。淀粉制糖工业中液化之后需再进行糖化,所采用的糖化酶一般有较窄的pH适应范围,最适pH一般为4.5~6.5[19]。目前工业上的糖化操作较为简单,将液化液冷却至55~60℃后,调节pH值为4.5左右,加人适量糖化酶进行保温糖化,到所需DE值时即可升温灭酶,进入后道净化工序。因此采用该酶液化淀粉时可以避免淀粉制糖过程反复调节粉浆pH,简化生产过程、节约成本,具有较好的应用潜力。
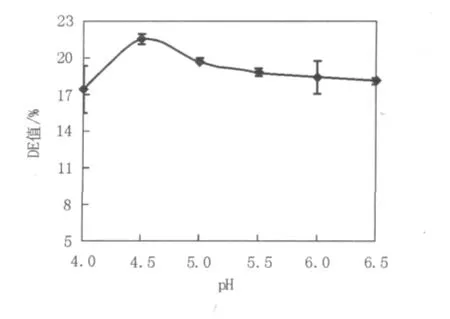
图5 pH对DE值的影响Fig.5 Effect of different pH on DE value
2.2 玉米淀粉液化优化参数研究
根据以上研究结果,分别选择液化温度、液化时间、粉浆浓度、酶用量4个影响较大的因素,并以各因素的最佳实验条件为依据确定其最佳使用范围,进行正交试验。试验结果见表2。采用SPSS软件进行方差分析[20],分析结果见表3。
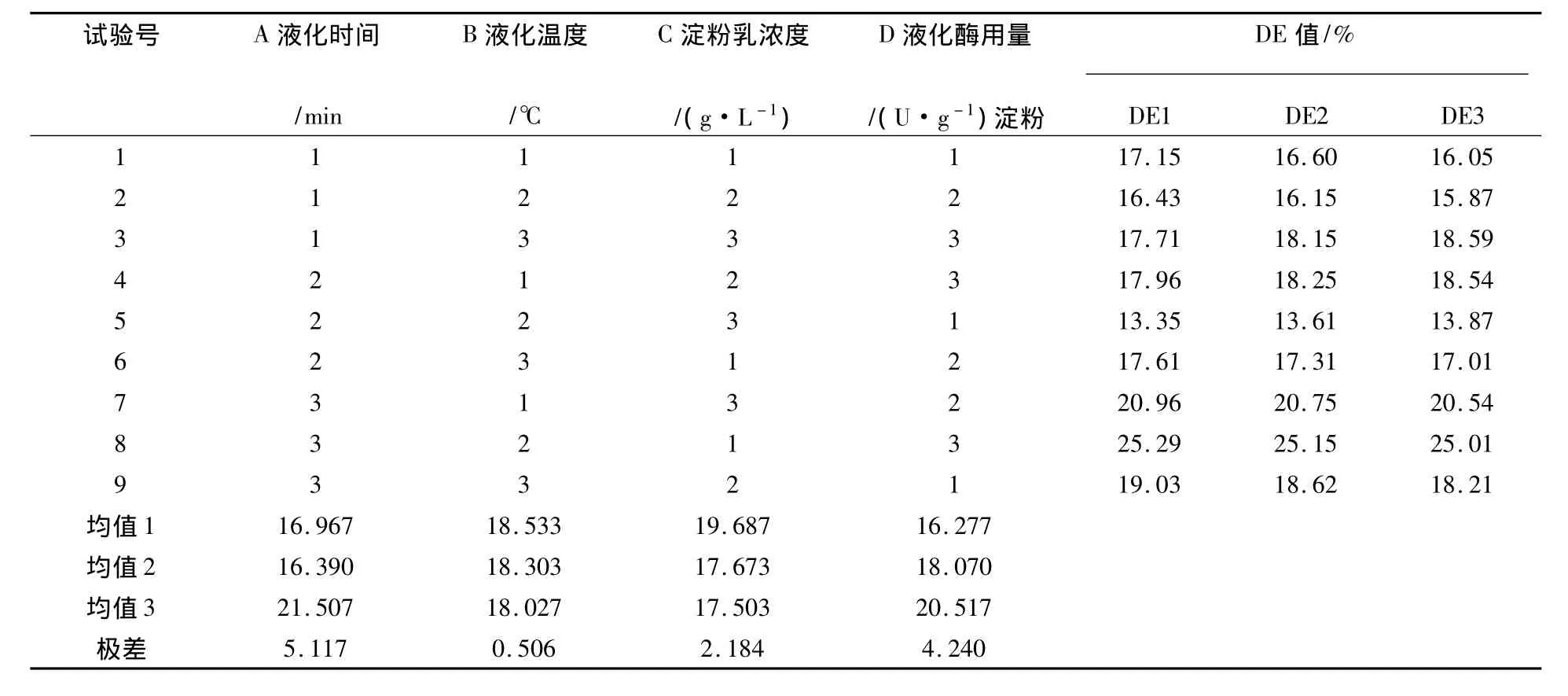
表2 耐高温酸性α-淀粉酶酶解试验方案及结果分析Table 2 Text scheme and result of the thermo-stable and acid-stable α-amylase
从表2中各因素不同水平的均值可直观地看出,各因素水平对结果影响的强弱顺序为A3>A1>A2,B1>B2>B3,C1>C2>C3,D3>D2>D1。从表3中可以看出,因素A(液化时间)、C(淀粉乳浓度)、D(酶用量)的显著性P<0.01,说明本次试验所选择这3个因素的改变对实验结果的影响是极显著的;因素B(液化温度)的显著性0.01<P<0.05,说明液化温度对实验结果有显著影响;影响因素主次顺序为A>D>C>B,经过统计分析得到的最佳水平组合为A3、B1、C1、D3,即液化时间90 min、液化温度85℃、粉浆浓度250 g/L、酶用量32 U/g淀粉。
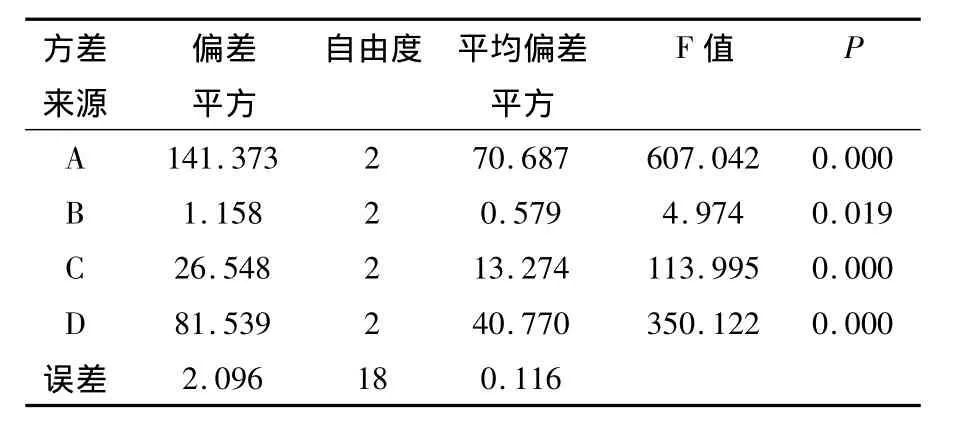
表3 正交设计的方差分析Table 3 Variance analysis of the experiments
3 讨论
通过试验得到新型海洋耐高温酸性α-淀粉酶水解玉米淀粉的最佳水解工艺为液化时间90 min、液化温度85℃、粉浆浓度250 g/L、酶用量32 U/g淀粉。该酶与传统的淀粉酶相比,水解过程不依赖于Ca2+,具有耐高温酸性的特点,符合工业生产,且水解过程简单易于操作,为新产品的开发应用奠定了基础。
[1] 孙晓菲,李爱江.α-淀粉酶的应用及研究现状[J].畜牧兽医科技信息,2008,(6):13-14.
[2] Van Der Maarel M,Van Der Veen B,Uitdehaag J,et al.Properties and application of starch-converting enzymes of the α-amylase family[J].Biotechnology,2002,94(2):137-155.
[3] 郭建强,李运敏,岳丽丽,等.超耐热酸性α-淀粉酶基因的克隆及其在酵母细胞中的表达[J].生物工程学报,2006,22(2):237.
[4] 徐正康,罗建勇,郭峰,等.Na+、Ca2+对淀粉浆中耐高温淀粉酶酶解效果的影响[J].现代食品科技,2010,26(7):700-702.
[5] Suganuma T,fujita K,Kitahara K.Some distinguishable properties between acid Stable and neutraltypes of α-amylases from acid producing koji[J].Tournal of Bioscience and Bioengineering,2007,104(5):353-362.
[6] Steen J,Constantin E.V,Garabed A.Cloning,sequencing,characterization,and expression of an extracellular α-amylase from the hyperthermophilic archaeon Pyrococcus furiosus in Escherichia coli and Bacillus subtilis[J].The Journal of Biological Chemistry,1997,272(2):16335-16342.
[7] 沈微,王正祥,唐雪明,等.古细菌Pyrococcus furiosus高嗜热α-淀粉酶基因在大肠埃希菌中的分泌表达[J].中国酿造,2003,(1):12-14.
[8] 姚婷,李华钟,房耀维,等.定点突变提高Thermococcus siculi HJ21高温酸性α-淀粉酶催化活性的研究[J].食品科学,2011,32(15):148-152.
[9] 胡建恩,曹茜,杨帆,等.高温α-淀粉酶高密度高表达发酵条件的研究[J].食品科学,2012,33(1):219-225.
[10] 王淑军,吕明生,秦松,等.热球菌HJ21高温-淀粉酶基因克隆、表达和性质研究[J].海洋学报,2011,33(3):158-164.
[11] 郝晓敏,王遂,崔凌飞.α-淀粉酶水解玉米淀粉的研究[J].食品科学,2006,27(2):141-143.
[12] 徐良增,许时婴,杨瑞金.酶法液化玉米淀粉制备麦芽糊精的研究[J].食品工业,2001,(3):24-25.
[13] 中华人民共和国卫生部.GB5009.7-85.食品中还原糖的测定方法[S].北京:中国标准出版社,1985.
[14] 王兆生,董海洲.耐高温α-淀粉酶在玉米淀粉制备结晶葡萄糖中的研究[J].中国食物与营养,2006,(4):27-30.
[15] 李海普,李彬,欧阳明,等.直链淀粉和支链淀粉的表征[J].食品科学,2010,31(11):273-277.
[16] 王立刚,胡晨俊,李安东.α-淀粉酶降解淀粉性能研究[J].辽宁化工,2008,37(4):223-226.
[17] 杨玉岭.淀粉转化生产葡萄糖的工艺研究[D].无锡:江南大学,2005.
[18] 周国燕,胡琦玮,李红卫,等.水分含量对淀粉糊化和老化特性影响的差示扫描量热法研究[J].食品科学,2009,30(19):89-92.
[19] 张秀媛,袁永俊,何扩.糖化酶的研究概况[J].食品研究与开发,2006,27(9):163-166.
[20] 夏传涛,袁秉祥.无空列正交试验的设计及SPSS软件的数据处理[J].数理医药学杂志,2006,19(1):91-92.
