电针联合脂肪源性干细胞移植对大鼠脑缺血/再灌注损伤后海马区CXCL2及受体CXCR2表达的影响*
2012-01-12李文媛冯克俭刘跃光
李文媛,王 莹,贾 桦,冯克俭,刘跃光
(1.牡丹江医学院解剖教研室,黑龙江 牡丹江 157011;2.宁夏医科大学解剖教研室,宁夏银川 750004)
电针联合脂肪源性干细胞移植对大鼠脑缺血/再灌注损伤后海马区CXCL2及受体CXCR2表达的影响*
李文媛1,王 莹1,贾 桦2,冯克俭1,刘跃光1
(1.牡丹江医学院解剖教研室,黑龙江 牡丹江 157011;2.宁夏医科大学解剖教研室,宁夏银川 750004)
目的:探讨电针联合脂肪源性干细胞(adipose-derived stem cell,ADSC)移植对大鼠缺血/再灌注损伤后海马区CXC趋化因子2(CXC chemokine ligand 2,CXCL2)及受体(CXC chemokine receptor 2,CXCR2)表达的影响。方法:采用线栓法复制大鼠大脑中动脉缺血再灌注模型,将动物随机分为正常对照组、模型对照组、电针组、ADSC移植组和电针+ADSC组5组。应用NSS法行神经功能损害评分,采用蛋白质印迹法和实时荧光定量PCR分别检测海马区CXCL2和CXCR2蛋白及其mRNA的表达水平。结果:电针+ADSC组海马区PKH-26标记的细胞个数高于ADSC组,差别有统计学意义(P<0.05)。电针+ADSC组NSS评分低于单独治疗组(P<0.05)。与模型对照组对比,电针+ADSC组和电针组的CXCL2和CXCR2蛋白和mRNA表达水平均下降,差别有统计学意义(P<0.05)。结论:电针联合脂肪源性干细胞移植促进脑缺血大鼠神经功能恢复作用优于单独治疗组,其机制可能是电针通过下调炎症递质CXCL2和CXCR2的表达抑制炎性反应,从而促进移植的ADSC迁移和存活。
电针;脂肪源性干细胞/治疗;缺血再灌注损伤;CXCL2;CXCR2
干细胞移植治疗脑缺血性疾病是近年来医学领域研究的一个热点。我们前期研究[1]发现:将脂肪源性干细胞(adipose-derived stem cell,ADSC)经尾静脉注射治疗大鼠脑缺血损伤,可减轻神经功能的缺损;但由于脑缺血区炎症反应,导致移植干细胞向缺血区迁移能力及存活率较低,其神经再生效果并不理想[2]。有研究[1]表明:脑缺血侵润的炎性细胞有中性粒细胞、单核细胞、淋巴细胞、自然杀伤细胞(NK)和树突状细胞等,CXC趋化因子2(CXC chemokine ligand 2,CXCL2)是炎症趋化因子,其相应的受体CXC趋化因子受体2(CXC chemokine receptor 2,CXCR2)主要表达于上述炎性细胞的表面[2]。当CXCL2与其受体CXCR2结合后会促进炎症反应,加重脑缺血的损伤。近年来有研究[3]发现:电针可增强脊髓损伤中移植的骨髓间充质干细胞存活的数量和迁移能力,两者联合治疗能协同促进脊髓损伤后神经功能恢复,但作用机制还不清楚。本研究将通过观察电针联合ADSC移植对脑缺血后炎症递质CXCL2和受体CXCR2表达的影响,探讨电针与干细胞联合治疗脑缺血损伤的作用机制。
1 材料与方法
1.1 动 物
雄性 SD大鼠48只,清洁级,体质量280~320 g,购于中国医科大学实验动物中心,动物质量合格证号:SYXK(辽)20030013。
1.2 试剂与仪器
兔抗大鼠CXCL2抗体、兔抗大鼠CXCR2抗体,购自北京中杉金桥生物技术有限公司;抗β-actin抗体,购自美国Santa Cruz公司;PKH-26试剂盒,购自美国Sigma公司;TRIzol试剂、SuperscriptII反转录酶、dNTPs,购自 Invitrogen公司;TaqDNA聚合酶、DL2000DNA标志物,购自日本 Takara公司;CXCL2、CXCR2和β-actin引物由宝生物工程(大连)有限公司合成。Stratagene 3005实时定量PCR仪,美国Stratagene公司产品;Meta Morph/DP10/BX41图像分析系统,日本奥林巴斯公司产品;G-6805电针仪,上海华谊仪器制造厂产品。
1.3 ADSC培养与PKH26标记
脂肪组织由中国医科大学整形外科提供,来自于25~35岁要求去除腹部多余脂肪的健康成人,供体无传染病及内分泌疾病,男女数量比例为2∶8。告知其脂肪抽吸物将用于科学研究并知情同意。脂肪源性干细胞参照Zuk等[4]的方法进行分离培养,并换液传代,分离培养取第3~5代的ADSC,制成单细胞悬液后,参照Tohill[1]的方法进行PKH-26标记ADSC。
1.4 模型的建立与动物分组
大鼠按体质量分层,随机分为正常对照组、模型对照组、电针组、ADSC组及电针+ADSC组5组。正常对照组2只,其余每组12只。参照Longa等[5]的线栓改良法复制大鼠大脑中动脉缺血模型。正常对照组不予任何干预。模型对照组:单纯造模,不予任何干预。电针组和电针+ADSC组于造模成功后即刻、60 min、120 min、180 min进行电针干预,针刺大椎、双侧内关穴位(参照华兴邦制定的《实验动物穴位图谱》)。采用疏密波,频率120次/min,强度1 mA,以局部肌肉轻微抖动为度,每次持续刺激30 min。ADSC组和电针+ADSC组于造模成功后180 min分别经尾静脉注射已制备好的PKH-26标记的同种异体 ADSC 悬液(500 μL ,4 ×106个/100 μL)[1],其余3组注射等体积的PBS。
1.5 检测指标
1.5.1 神经功能评估
采用 Chen等[4]报道的神经功能损害评分表(neurological severity scores,NSS),从运动、感觉、反射、平衡4方面进行神经功能损害评估,18分为最严重的神经功能损害,即评分越高神经功能损害越严重。分别于缺血后1 d、3 d及7 d对各组大鼠进行NSS评分。
1.5.2 蛋白质印迹检测
取每组6只大鼠海马组织加入裂解液提取总蛋白,采用 BCA定量试剂盒测定蛋白浓度。SDSPAGE凝胶电泳分离蛋白后转至硝酸纤维素膜;封闭缓冲液封闭后,加入一抗(anti-CXCL2 1∶100稀释,anti-CXCR2 1∶100稀释)4℃孵育过夜,二抗(1∶2000稀释)孵育2 h,TBS洗净后经显色液显示15 min,扫描后经Image J图像分析软件对印迹区进行灰度分析。
1.5.3 实时荧光定量PCR检测
取各组6只大鼠海马组织进行RNA提取,采用Zacharek等[6]报道方法进行PCR反转录、检测及荧光定量分析。引物设计及合成按照已报道的序列设计并合成CXCR2、CXCL2以及内参照β-actin的特异性引物。各引物的序列为:CXCL2,上游5’-CCCGAAGCTCCCATGGTTAAG-3’,下游 5’-CCCTGGAAACCAGCCATTCTC-3’,扩增长度为163bp;CXCR2,上游 5’-CTCCTGCCTAAGTGCAGCC-3’,下游5’-TAATTATGGCAAGGGGTGAGG-3’,扩增长度为202bp;β-actin,上游 5’-TGGTGGGTATGGGTCAGAAGGACTC-3’,下游 5’-CATGGCTGGGGTGTTGAAGGTCTCA-3’,扩增长度为265 bp。根据标准曲线将各样品测得的Ct值换算成拷贝数,分析各检测样本中目的基因拷贝数相对于阳性定量参考样品的基因拷贝数,分析方法利用 2-△△Ct方法。
1.6 统计学方法
2 结果
2.1 ADSC 的培养
于相差显微镜下观察。接种后24 h细胞贴壁,呈成纤维细胞样外观。培养48 h后可见细胞已经充分伸展呈长梭形,72 h后开始聚集形成细胞集落,6 d形成较密集的细胞群落。
2.2 NSS 评分检测
正常对照组缺血后1 d、3 d和7 d NSS评分均为0分。缺血后1 d和3 d,与模型对照组对比,电针组、ADSC组和电针+ADSC组NSS评分差别均无统计学意义(P>0.05)。缺血后7 d,与模型对照组对比,电针组、ADSC组和电针+ADSC组NSS评分降低,差别有统计学意义(P<0.05),其中电针 +ADSC组NSS评分低于电针组和ADSC组,差别有统计学意义(P<0.05)。见表1。
表1 各组NSS评分 分,±s
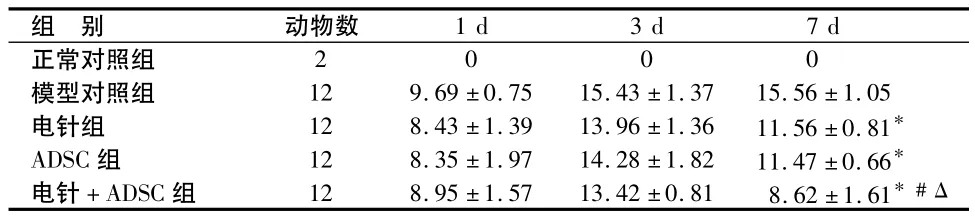
表1 各组NSS评分 分,±s
注:与模型对照组对比,*P<0.05;与电针组对比,#P<0.05;与 ADSC组的对比,ΔP<0.05。
组 别 动物数1 d 3 d 7 d正常对照组2000模型对照组 12 9.69 ±0.75 15.43 ±1.37 15.56 ±1.05电针组 12 8.43 ±1.39 13.96 ±1.36 11.56 ±0.81*ADSC 组 12 8.35 ± 1.97 14.28 ±1.82 11.47 ±0.66*电针 +ADSC 组 12 8.95 ±1.57 13.42 ±0.81 8.62 ±1.61*#Δ
2.3 PKH-26 标记观察
冰冻切片免疫荧光追踪PKH-26标记的移植ADSC,模型对照组、电针组、ADSC组和电针+ADSC组PKH-26标记阳性细胞吸光度值为分别为 0,0,(44.72 ±10.74)和(70.92 ±5.73)。电针 +ADSC 组PKH-26标记阳性细胞吸光度值高于ADSC组,差别有统计学意义(P<0.05)。
2.4 各组蛋白印迹检测结果
与模型对照组和ADSC组对比,电针+ADSC组和电针组海马区CXCL2和CXCR2蛋白相对表达均降低,差别有统计学意义(P<0.05),电针+ADSC组和电针组CXCL2和CXCR2蛋白相对表达对比,差别无统计学意义(P>0.05)。见表2。
表2 海马区CXCL2和CXCR2蛋白相对表达±s

表2 海马区CXCL2和CXCR2蛋白相对表达±s
注:与模型对照组对比,*P <0.05;与 ADSC 组对比,Δ P <0.05。
组 别 动物数CXCL2 CXCR2模型对照组6 0.88 ±0.05 1.07 ±0.11电针组 6 0.61 ±0.10* 0.73 ±0.09*Δ ADSC 组 6 0.98 ±0.06 1.08 ±0.10电针 +ADSC组 6 0.62±0.09*Δ 0.77±0.05*Δ
2.5 实时荧光定量PCR检测结果
与模型对照组对比,电针+ADSC组和电针组海马区CXCL2和CXCR2 mRNA相对表达均降低,差别有统计学意义(P<0.05),电针+ADSC组和电针组CXCL2和CXCR2 mRNA相对表达对比,差别无统计学意义 (P>0.05)。见表3。
表3 海马区CXCL2和CXCR2 mRNA相对表达±s

表3 海马区CXCL2和CXCR2 mRNA相对表达±s
组 别 动物数 CXCL2 mRNA(2-ΔΔCt) CXCR2 mRNA(2-ΔΔCt )模型对照组0.0126 ±0.0010 0.0136 ± 0.0014电针组 6 0.0044 ±0.0006* 0.0081 ±0.0013*ADSC 组 6 0.0129 ±0.0015 0.0143 ±0.0013电针 +ADSC 组 6 0.0047 ±0.0007* 0.0086 ±0.0011 6*
3 讨论
电针是针刺疗法中的一种,是电刺激和针刺效应的结合,因其具有低风险、操作方便、成本低等优点,是目前临床治疗缺血性脑血管疾病的常用针刺方法。许多研究证实:电针能有效促进脑缺血后神经功能恢复,但其作用机制尚不明确[3]。本实验中选取督脉大椎穴和心包经的内关穴进行电针治疗脑缺血大鼠模型。内关为心包经络穴,心包为心的护卫,心主血脉,可调理心气,促进气血的运行。针刺内关穴可调节心、脉、血、神,达宁心调血安神之目的。大椎为督脉之要穴,是阳气的集中点,针刺大椎可振奋六阳经和督脉之阳气,使气血流畅,上行于脑,而发挥活血化瘀,健脑补髓,醒脑开窍的作用[7]。本实验结果表明:电针组NSS评分低于模型对照组,证实大椎穴和内关穴行电针治疗能够促进脑缺血后神经功能恢复。
缺血后脑组织内趋化因子CXCL2及其受体CXCR2的表达增加。CXCL2与其受体CXCR2结合后其表达活性增强,诱导中性粒细胞、自然杀伤细胞、树突状细胞等炎性细胞向缺血损伤区趋化游走并聚集,加重损伤区的炎症反应[8]。本研究发现:电针组CXCL2和CXCR2蛋白和基因表达水平较模型对照组降低,而且电针+ADSC组海马区PKH-26标记ADSC阳性细胞个数多于ADSC组。因此我们推测电针治疗可通过下调海马区CXCL2和CXCR2的表达,抑制脑缺血损伤的炎症反应,促进了移植的ADSC在脑缺血区的存活和迁移。
近年来,ADSC由于其来源广、易于体外扩增纯化,已成为干细胞治疗脑缺血损伤研究的热点[1]。有研究者[3]发现:电针可增强脊髓损伤中移植的骨髓间充质干细胞存活的数量和迁移能力,联合电针和骨髓间充质干细胞能够协同促进脊髓损伤后神经再生。李晓滨等[9]也证实督脉电针与神经干细胞移植联合能够显著促进全离断脊髓的功能修复。但联合治疗是否同样协同促进脑缺血损伤神经再生则未见相关报道。为此,本实验联合电针和ADSC移植治疗脑缺血大鼠模型。研究结果表明:与模型对照组对比,虽然电针组和ADSC组均能降低NSS评分,但电针联合ADSC治疗效果明显优于单独治疗组。联合治疗的协同作用机制可能是:一方面电针可通过抑制与CXCR2和CXCL2的有关的炎性反应,促进移植的ADSC在脑缺血区的存活和迁移;另一方面,增多的ADSC通过分化为神经元细胞和分泌上调神经生长因子表达来促进神经再生。
综上所述,本研究证实了联合应用电针和ADSC移植治疗从功能上能够促进脑缺血神经再生,其机制可能与电针下调海马区炎症递质CXCL2和CXCR2的表达,抑制炎性反应,促进移植的ADSC迁移和存活有关。
[1]王莹,李文媛,李明秋,等.黄芪皂甙Ⅳ联合脂肪源性干细胞对老龄大鼠脑缺血再灌注中神经营养因子表达的影响[J].中国老年学杂志,2011,31(20):3963 -3966.
[2]Müller-Ehmsen J,Krausgrill B,Burst V,et al.Effective engraftment but poor mid-term persistence of mononuclear and mesenchymal bone marrow cells in acute and chronic rat myocardial infarction[J].Mol Cell Cardiol,2006,41(5):876-884.
[3]Ding Y,Yan Q,Ruan JW,et al.Bone marrow mesenchymal stem cells and elec-troacupuncture downregulate the inhibitor molecules and promote the axonal regeneration in the transected spinal cord of rats[J].Cell Transplant,2011,20(4):475 -491.
[4]王莹,赵斯达,李文媛,等.脂肪源性干细胞移植对脑缺血再灌注损伤大鼠 HIF-1α和 HIF-3α表达的影响[J].山西医科大学学报,2011,42(9):719 -722.
[5]李红艳,孙建宁,马百平,等.甾体皂苷TSA对局灶性脑缺血大鼠神经发生的影响[J].中医研究,2009,22(3):15-18.
[6]Zacharek A,Chen J,Cui X,et al.Angiopoietin1/Tie2 and VEGF/Flk1 induced by MSC treatment amplifies angiogenesis and vascular stabilization after stroke[J].Cereb Blood Flow Metab,2007,27(3):1684 -1691.
[7]孔立红,毛娟娟,孙国杰,等.穴位埋药对脑缺血再灌注大鼠脑梗死体积的影响[J].上海针灸杂志,2007,26(7):40 -42.
[8]Brait VH,Rivera J,Broughton BR,et al.Chemokine-related gene expression in the brain following ischemic stroke:no role for CXCR2 in outcome[J].Brain Res,2011,1372(4):169 -79.
[9]李晓滨,曾园山,陈玉玲,等.督脉电针与神经干细胞移植联合应用促进大鼠受损伤脊髓组织产生神经生长活性物质[J].解剖学报,2006,37(6):622 -626.
R245.9+7
B
10.3969/j.issn.1001 -6910.2012.09.031
1001-6910(2012)09-0061-04
book=0,ebook=102
王莹,博士,讲师,E-mail:yingwang770224@163.com
黑龙江省普通高等学校青年学术骨干支持计划项目(编号1152G050);黑龙江省卫生厅科研项目(编号2010243)
2011-11-13;
2012-02-22
(编辑 陶 珠)
·临床报道·
