盐酸帕洛诺司琼注射液的制备和质量控制
2012-01-12范新华屠永锐
范新华, 屠永锐
(常州四药制药有限公司,江苏常州213004)
新一代5-HT3受体拮抗剂盐酸帕洛诺司琼(palonosetron hydrochloride)由瑞士Helsinn Health-care SA公司开发,于2003年7月获美国FDA批准上市,商品名为Aloxi®,用于缓解化疗引起的恶心和呕吐[1]。盐酸帕洛诺司琼对表达5-HT3受体的人胚肾细胞株293EI和神经胶质瘤NGl08细胞的亲和力分别是同类药物盐酸格拉司琼的9.5和23.2倍[2],且其半衰期长达40 h[3-6],同类药物昂丹司琼、格拉司琼和托烷司琼的消除半衰期分别为3.1~6.2、6.2和7~9 h,因此,高亲和力和较长的半衰期使帕洛诺司琼在治疗恶心和呕吐方面有着较大的优势。本研究参照Aloxi®的处方制备了盐酸帕洛诺司琼注射液,并进行了质量控制研究。
1 材料
Agilent1260高效液相色谱仪(Agilent公司); Seven Multi pH检测仪(Mettler Toledo公司)。盐酸帕洛诺司琼对照品(批号:091201,含量100.4%,成都新恒创药业有限公司);盐酸帕洛诺司琼原料(批号:20091228,含量99.10%,常州四药制药有限公司);盐酸帕洛诺司琼注射液样品(批号:20100530, 201006011,201006012,常州四药制药有限公司); 0.9%氯化钠注射液(规格:250 mL,亚邦药业); 5%葡萄糖注射液(规格:250 mL,亚邦药业)。依地酸二钠(EDTA-2Na,国药集团);甘露醇(上海进出口公司),枸橼酸(湖南尔康制药有限公司)。
2 方法与结果
2.1 处方及工艺筛选
盐酸帕洛诺司琼注射液处方参照同类产品Aloxi®[7],规格为5 mL∶0.25 mg(以帕洛诺司琼计)。
2.1.1 金属络合剂用量的确定 按Aloxi®的处方配制盐酸帕洛诺司琼溶液900 mL,均分为3份,其中1份不加EDTA-2Na,另2份中加入的EDTA-2Na量分别为溶液体积的0.01%和0.05%(质量浓度分别为0.1和0.5 g·L-1),置100℃烘箱,5 h后取出,采用高效液相色谱法测定溶液中盐酸帕洛诺司琼含量和有关物质,结果见表1。由表1可见,EDTA-2Na的用量对溶液中主药含量和有关物质测定结果几乎无影响。故根据金属络合剂的常规用量,设定本处方中EDTA-2Na的用量为制剂体积的0.01%。
2.1.2 渗透压调节剂用量的确定 按Aloxi®的处方配制盐酸帕洛诺司琼溶液500 mL,其中渗透压调节剂甘露醇用量为每5 mL溶液中207.5 mg,采用冰点降低法测定溶液渗透压。结果显示:溶液渗透压为770 kPa,与生理盐水(0.1%NaCl溶液)及成人体液等渗,故将处方中甘露醇用量定为每5mL制剂中207.5 mg(质量浓度为41.5 g·L-1)。
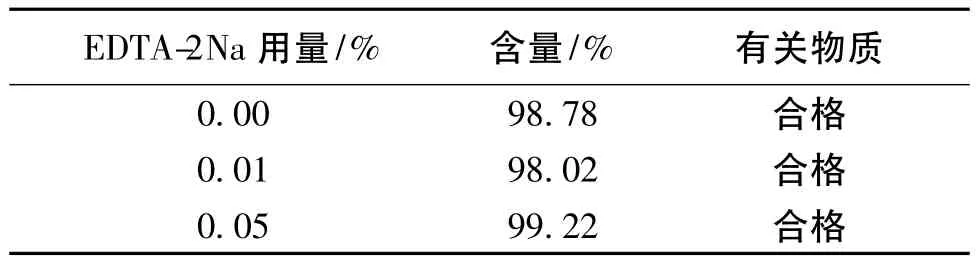
表1 含不同EDTA-2Na用量的处方中盐酸帕洛诺司琼的含量和有关物质测定结果Table1 Results of content of palonosetron hydrochloride and the related substances in formulation containing different amount of EDTA-2Na
2.1.3 针用活性炭用量的确定 按Aloxi®的处方配制盐酸帕洛诺司琼溶液1 000mL,均分为3份,其中1份不加针用活性炭的为对照品,另2份中加入的活性炭量分别为溶液体积的0.05%和0.01%(质量浓度分别为0.5和0.1 g·L-1),搅拌15 min后,膜过滤器过滤脱炭,采用高效液相色谱法测定溶液中盐酸帕洛诺司琼含量。结果显示:活性炭用量为溶液体积的0.05%和0.01%时,溶液中盐酸帕洛诺司琼含量分别为(99.37±0.02)%和(98.83± 0.45)%(n=3)。表明活性炭用量对溶液中主药含量的影响不明显。为了减少活性炭对主药的吸附,按用量少的原则,将其用量定为制剂体积的0.01%。
2.1.4 配伍试验 取盐酸帕洛诺司琼注射液样品(批号:20100530)2瓶分别注入注射用水5 mL,使其溶解均匀,再分别移入0.9%氯化钠注射液和5%葡萄糖注射液2种配伍试液各250 mL中,混匀,室温下分别于0、2、6、12、24 h测定各混合液中盐酸帕洛诺司琼含量,结果见表2。由表2可见,2种混合液在室温保存24 h后,盐酸帕洛诺司琼含量未见有明显变化。表明样品性质稳定,可与0.9%氯化钠注射液和5%葡萄糖注射液配伍。

表2 配伍试验含量测定结果(n=3)Table2 Results of compatibility test for content determination
2.1.5 灭菌参数对制剂的影响 盐酸帕洛诺司琼注射液样品(批号:20100530)10瓶,平均分成2组,分别经121℃下15 min和115℃下30 min流通蒸汽灭菌。采用高效液相色谱法测定灭菌前后样品中主药含量和有关物质,结果见表3。由表3可见,样品稳定性良好,经121℃下15 min及115℃下30 min流通蒸汽灭菌后,其主药含量及有关物质均无明显变化。故选择常规灭菌参数 121℃下15 min。

表3 灭菌参数对制剂的影响Table3 Effect of sterilization parameters on preparation
2.1.6 制备工艺 按1 000瓶配制量称取盐酸帕洛诺司琼原料0.28 g(相当于帕洛诺司琼0.25 g)、甘露醇207.5 g和EDTA-2Na 0.5 g,加至注射用水4 000 mL中,搅拌至溶解完全,加入针用活性炭0.5 g,充分搅拌后过滤脱炭,加枸橼酸适量并补加注射用水至总体积为5 000 mL,调pH为4.5~5.5,以0.22μm滤膜过滤,灌装(装量5 mL),封口,121℃下灭菌15 min,检漏,灯检,包装,即可。
2.2 含量测定方法的建立
2.2.1 色谱条件 采用Zorbax Extend-C18色谱柱(250 mm×4.6 mm,5μm),流动相为磷酸盐缓冲溶液(含水1 000 mL、磷酸二氢钾2 g、三乙胺2 mL和磷酸1mL)-甲醇(57∶43),检测波长为241 nm,进样量为20μL。理论塔板数以盐酸帕洛诺司琼主峰面积计算应不低于3 000。
2.2.2 贮备液的制备 取盐酸帕洛诺司琼对照品,精密称取适量(含帕洛诺司琼约为12.50 mg),置50 mL量瓶中,加0.1 mol·L-1盐酸溶液溶解并稀释至刻度,摇匀,即得。
2.2.3 准确度试验 精密量取贮备液,用0.1 mol·L-1盐酸溶液配制不同浓度梯度(80%、100%和120%)的低、中、高含量模拟制剂,作为供试液,进样测定,记录色谱图;另精密量取贮备液4.0 mL,置10 mL量瓶中,用流动相稀释至刻度,摇匀作为对照液,同法测定。结果表明该法准确度良好(见表4)。

表4 准确度试验结果(n=3)Table4 Results of accuracy test
2.2.4 精密度试验
取盐酸帕洛诺司琼注射液样品(批号:20100530)适量,不同日期、不同仪器、不同人员重复测定其含量,结果见表5。由表5可见,该法精密度良好。
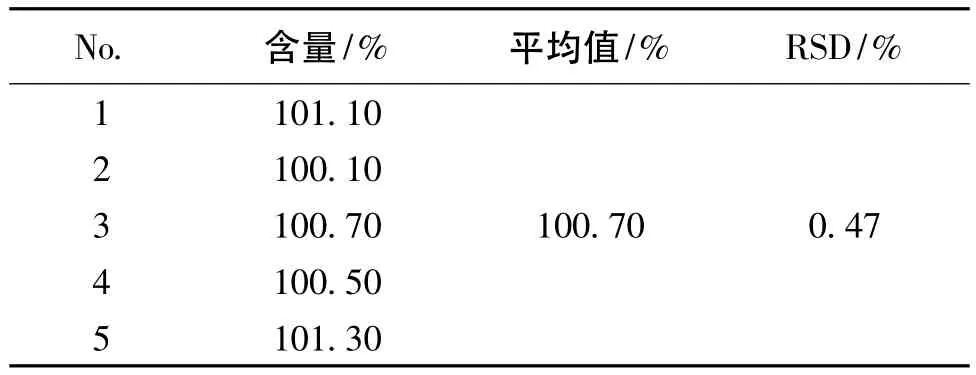
表5 中间精密度试验结果(n=5)Table5 Results of intermediate precision test
2.2.5 重复性试验 取盐酸帕洛诺司琼注射液样品(批号:20100530)作为供试液,进样测定,记录色谱图,重复5次。另取盐酸帕洛诺司琼对照品适量,精密称定,加流动相溶解并定量稀释制成每1mL中含帕洛诺司琼约为50μg的溶液,同法测定。按外标法,以峰面积计算样品含量,结果测得样品含量平均值为99.8%,RSD为0.18%(n=5)。表明该法重复性良好。
2.2.6 标准曲线的绘制 取盐酸帕洛诺司琼对照品适量,精密称定,用流动相溶解并稀释制成质量浓度分别为1.0、10、20、50、80、100和200 mg·L-1的供试液,进样测定,记录色谱图。以峰面积A为纵坐标,质量浓度C为横坐标,绘制标准曲线,得线性回归方程为:A=30.668C+18.23,r2=0.999 7。结果表明:在1~200 mg·L-1范围内,盐酸帕洛诺司琼的色谱峰面积与其质量浓度呈良好线性关系。
2.2.7 含量测定 按“2.2.1”项下色谱条件,取盐酸帕洛诺司琼注射液样品(批号:20100530,
201006011,201006012)作为供试液,进样测定,记录色谱图,各批次样品平行测定2次;另取盐酸帕洛诺司琼对照品适量,精密称定,加流动相溶解并定量稀释制成每1 mL中含帕洛诺司琼约为50μg的溶液,同法测定。按外标法,以峰面积计算样品含量,结果测得各批次样品平均含量分别为99.10%、100.7%和101.0%,RSD为0.23%(n=6)。
2.3 有关物质的测定
取盐酸帕洛诺司琼注射液样品(批号: 20100530,201006011,201006012)作为供试液,精密量取1 mL至100 mL量瓶中,加流动相稀释至刻度,摇匀,作为对照液,按“2.2.7”项下方法,进样,调节仪器灵敏度,使主成分峰高约为记录满量程的10%;再量取上述2种溶液,进样,记录色谱图至主峰保留时间的2倍。供试液的色谱图中如有杂质峰(溶剂峰及辅料峰除外),量取各杂质峰的面积及总和,并与对照液主成分峰面积进行比较分析,各批次样品平行测定2次。结果显示:各供试液中有关物质峰面积总和均不大于对照液主峰面积的1.0%,3批产品有关物质含量平均值分别为0.05%、0.05%和0.04%(n=6)。
2.4 稳定性考察
取盐酸帕洛诺司琼注射液样品(批号:20100530,201006011,201006012)进行下列稳定性试验。
2.4.1 高温、高湿和光照试验 分别将样品于(60±2)℃、(90±5)%相对湿度和(4 000±500)lx光照条件下放置,并于0、5、10 d取样观察,比较外观性状、pH值、含量、有关物质等指标。结果,试验结束时,样品各项指标均无明显变化。
2.4.2 恒温加速试验 将样品于(40±2)℃和(75±5)%相对湿度的条件下放置,于第0、1、2、3、6月分别取样,观察同上指标。结果,试验结束时,样品各项指标无明显变化。
2.4.3 长期留样试验 将样品于(25±2)℃和(60±10)%相对湿度条件下放置,分别于0、3、6、12、18、24月末取样,观察同上指标。结果,试验结束时,样品各项指标无明显变化。
3 讨论
帕洛诺司琼系杂环化合物,其盐酸盐水溶性良好。然而,在溶液中,其分子中的酰胺内酯结构在金属离子和光照的作用下会产生水解,导致疗效下降,故根据Aloxi®处方,本文在盐酸帕洛诺司琼注射液处方中也添加了金属络合剂EDTA-2Na,以消除金属离子对制剂的影响;此外,处方中还加入针用活性炭,以吸附溶液中的热原,并考察了EDTA-2Na和活性炭的用量对处方中盐酸帕洛诺司琼含量的影响,结果选择的两者用量与Aloxi®的处方相同。考虑到配伍液对制剂是否有影响关系到处方的设计合理性和使用安全性,笔者还进行了配伍试验,结果表明制剂含量不受配伍液的影响。
配伍试验旨在模拟临床使用时的安全性和有效性考察,对暂定处方和工艺的合理性进行验证;对灭菌参数的考察是在确定处方后进行的工艺筛选,以验证处方工艺及关键的灭菌工艺的合理性,故这两项试验均直接以按Aloxi®的处方制备的成品(批号:20100530)作为试验对象。
根据国家药品注册办法,盐酸帕洛诺司琼注射液属于3.1类新药。本文对本品的处方工艺及质量控制进行了一系列试验研究,为生产合格的盐酸帕洛诺司琼注射液打下了坚实基础。质量研究及稳定性试验结果表明:本品处方合理,工艺可行;制剂质量可控,稳定性良好。
[1] Vajda F J,Lander CM,Hitchcock A,et,al.Changing Australian prescribing patterns for antiepileptic drugs in pregnancy and their possible consequences[J].J Clin Neurosci,2007,14(7):611-617.
[2] Aapro M S.Palonosetron as an anti-emetjc and anti-nausea agent in oneology[J].Ther Clin Risk Manag,2007,3(6):1009-1020.
[3] SiddiquiM A,Scott L J.Palonosetron[J].Drugs,2004,64 (10):1125-1132.
[4] Stoltz R,Cyong JC,Shaha,et al.Phamacokinetic and safety evaluation of palonosetron,a 5-hydroxytrptamine-3 receptor antagonist,in U.S.and Japanese healthy subjects[J].JClin Pharmacol,2004,44(5):520-531.
[5] Eisenberg P,Mackintosh F R,Bitch P,et al.Efficacy,safety and pharmacokinetics of palonosetron in patients receiving highly emetogenic cisplatin-based chemotherapy;a doseranging clinical study[J].Ann Oncol,2004,15(2): 330-337.
[6] Hunt T L,Gallagher SC,Cullen M T,et al.Evaluation of safety and pharmacokinetics of consecutive multiple-day dosing of palonosetron in healthy subjects[J].J Clin Pharmacol,2005,45(5):589-596.
[7] Anon.Aloxi®[EB/OL].[2010-03-16].http://www.accessdata.fda.gov/drugsatfda _ docs/label/2006/ 021372s005lbl.pdf.
