辽五味子黄酮纯化及定性光谱分析
2012-01-11毛红燕石太渊张睿
马 涛, 毛红燕, 石太渊, 张睿
(1.辽宁省农业科学院 食品与加工研究所,辽宁 沈阳 110161;2.沈阳农业大学 食品学院,辽宁 沈阳 110161)
辽五味子黄酮纯化及定性光谱分析
马 涛1,2, 毛红燕2, 石太渊1, 张睿1
(1.辽宁省农业科学院 食品与加工研究所,辽宁 沈阳 110161;2.沈阳农业大学 食品学院,辽宁 沈阳 110161)
选用4种大孔树脂对辽五味子黄酮进行了静态吸附与解吸附试验。结果表明,HZ-818型树脂对黄酮的吸附率可达76.24%,解吸率达到67.30%,与其他4种型号树脂相比最适宜于辽五味子黄酮的分离纯化。通过对HZ-818树脂动态吸附试验,确定黄酮加样质量浓度为1.6 mg/m L时,上样体积为65 m L,上样流量1 m L/min,洗脱流量1.5 m L/min,用体积分数70%的乙醇进行洗脱,洗脱液用量为110 m L,可达到较好的洗脱效果,洗脱率可达到79.57%。提取物经光谱分析,证实为黄酮类化合物。
辽五味子;黄酮;大孔吸附树脂;光谱分析
辽五味子(LiaoSchisandrachinensis),木兰科植物也称为“北五味子”,主产地为我国辽宁省,是药食同源功能性保健食品[1]。目前,我国对辽五味子的化学成分研究比较深入,已报道的有木脂素、三萜、倍半萜、有机酸、挥发油及多糖等成分[2-4]。但是,关于辽五味子含黄酮的研究尚未见报道。
大孔吸附树脂是一类吸附分离材料,由于其自身具有多孔结构,可根据空隙大小对化学成分进行机械筛分,同时又带有极性基团,可通过范德华力和形成氢键对极性相近的化学成分进行选择性吸附[5]。它不溶于酸、碱及各种有机溶剂且有较好吸附性能的有机高聚物吸附剂,近年来逐渐被应用于中草药化学成分的提取、分离、纯化和中药新药的开发研制[6-7]。为更好地开发利用辽五味子黄酮类物质,作者采用大孔树脂对辽五味子黄酮进行纯化及定性分析,为辽五味子的合理利用提供一定的科学依据。
1 材料与方法
1.1 材料与仪器
1.1.1 试验材料辽五味子:购于辽宁省桓仁县;试验用水均为蒸馏水;芦丁标准品:中国药品生物制品检定所产品;AB-8、HZ-818、NKA-9、D-101大孔吸附树脂:安徽三星树脂有限公司产品;亚硝酸钠、硝酸铝、无水乙醇、氢氧化钠、石油醚(60~90℃):均为分析纯。
1.1.2 试验仪器DHL-A电脑恒流泵:上海沪西分析仪器厂产品;DBS-160电脑全自动部分收集器:上海沪西分析仪器厂产品;DZF-6050型真空干燥箱:上海一恒科技有限公司产品;JY92-Ⅱ超声波细胞粉碎机:宁波新芝生物科技股份有限公司产品;XA-1型固体样品粉碎机:河南省巩义市光压仪器厂产品;7200型可见分光光度计:尤尼柯(上海)有限公司产品;TDL-5000B型离心机:上海安亭科学仪器厂产品;Avatar 330傅立叶红外分光光度计:美国Thermo Nicolet公司产品。
1.2 方法
1.2.1 辽五味子黄酮的提取辽五味子果实→低温下烘干(50℃)→粉碎机粉碎→过筛→按1 g∶25 m L的料液质量体积比加体积分数65%的乙醇溶剂浸润→超声处理(300 W,15 min)→离心→提取液旋转蒸发挥去乙醇,浓缩→石油醚脱脂→旋转蒸发挥去石油醚→待纯化黄酮液
1.2.2 黄酮含量测定AlCl3比色法[8]。
1.2.3 树脂的预处理与再生用体积分数95%乙醇浸泡48 h,充分溶胀后用蒸馏水洗至无醇,用质量分数5%氢氧化钠溶液浸泡12 h,蒸馏水洗至中性,再用质量分数5%盐酸溶液浸泡12 h,用蒸馏水洗至中性,备用。
1.2.4 静态试验
1)静态吸附量考察[9]用滤纸吸干预处理好的树脂表面的水分后,准确称取1.0 g,置于250 m L具塞磨口三角瓶中,加入黄酮质量浓度为1.6 mg/m L的辽五味子黄酮的待纯化液30 m L,25℃下,置于摇床(150 r/min)振荡12 h,然后静置12 h使其充分吸附,平行3份,测定此时溶液中的总黄酮的含量,按照下式计算吸附量(Q)、吸附率(A)。
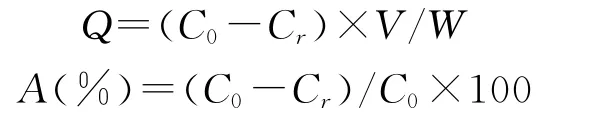
式中:Q为吸附量(mg/g);C0为起始质量浓度(mg/m L);Cr为剩余质量浓度(mg/m L);V为溶液体积(m L);W为树脂质量(g);A为吸附率。
2)静态解吸性能考察 将上述已吸附饱和的大孔吸附树脂滤出,用滤纸吸干药液 (用蒸馏水清洗至树脂表面无黄酮溶液残留),置于250 mL锥形瓶中,精确加入体积分数70%乙醇30 mL,置于摇床(150 r/min)振荡12 h,然后静置12 h,滤液进行含量测定,平行3份,测出吸收度值并计算静态解吸附率。

式中:D为解吸率;Q为吸附量(mg/g);Cr为解吸后溶液中总黄酮的质量浓度(mg/m L);W为树脂干重(g)。
3)静态吸附动力学曲线的绘制 分别准确称取1.0 g预处理好的树脂,置于250 m L三角瓶中,各加入30 m L辽五味子黄酮待纯化液(黄酮质量浓度为1.6 mg/m L),25℃下振摇(150 r/min)12 h,每隔1 h移取0.1 m L上清液,用体积分数80%乙醇定容至10 m L,测定其黄酮含量,绘制静态吸附动力学曲线。
1.2.5 动态试验通过静态试验,选择出一种较优的树脂,对上样量、上样流速、洗脱液浓度、解析流速、洗脱体积进行动态吸附实验。将预处理好的树脂湿法装入(D1.6 cm×30 cm)玻璃层析柱中,大孔吸附树脂充分自然沉降,使填装高度为柱高的2/3。将黄酮提取液上柱,待样品溶液全部通过树脂柱后用4BV的去离子水洗至流出液无色,用不同体积分数的乙醇以一定洗脱速度洗脱,收集洗脱液。通过测定总黄酮含量考察各因素对树脂吸附性能的影响,确定最佳吸附工艺条件。
1.2.6 定性光谱分析
1)紫外测定 分光光度计法:亚硝酸钠,硝酸铝显色法。
2)红外测定 KBr压片法。
2 结果与分析
2.1 辽五味子黄酮的纯化
2.1.1 大孔吸附树脂的选择4种大孔树脂预处理后,对辽五味子黄酮的静态吸附及解析实验,测得各种树脂对黄酮的吸附与解吸结果见表1。结果表明,树脂 HZ-818吸附黄酮效果最好,其次是NKA-9树脂,黄酮吸附量都在35 mg/g以上。每种树脂对黄酮的解吸结果分析表明,HZ-818树脂的黄酮解吸率较大,而NKA-9虽然吸附率较大,但是解吸较困难。
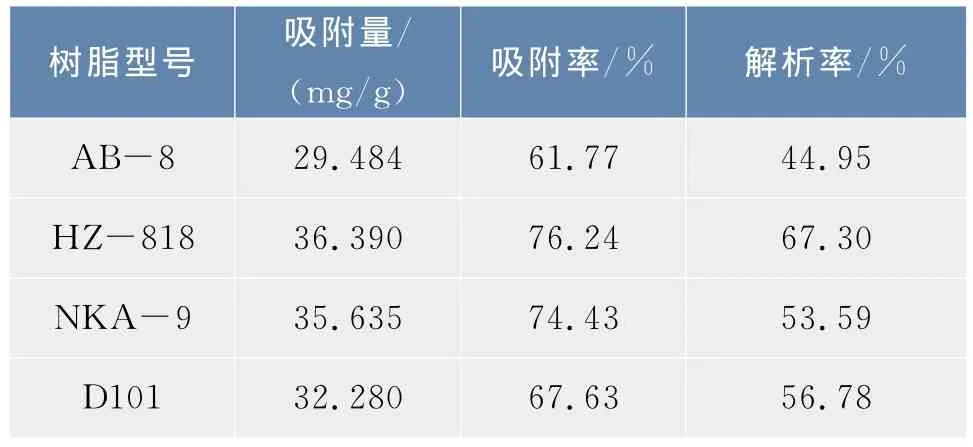
表1 不同树脂对五味子黄酮的吸附与解吸结果Tab.1 Adsorption capabilities and desorption rates of Liao Schisandra chinensis(Turcz.)Baill flavones
仅用树脂的平衡吸附量和解吸率来评价其吸附性能是不全面的,合适的树脂不仅要具有较大的吸附量、良好的解吸率,同时应具有较快的吸附速率,所以我们又研究了其静态吸附动力学特征。图1为3种树脂的静态吸附动力学曲线。
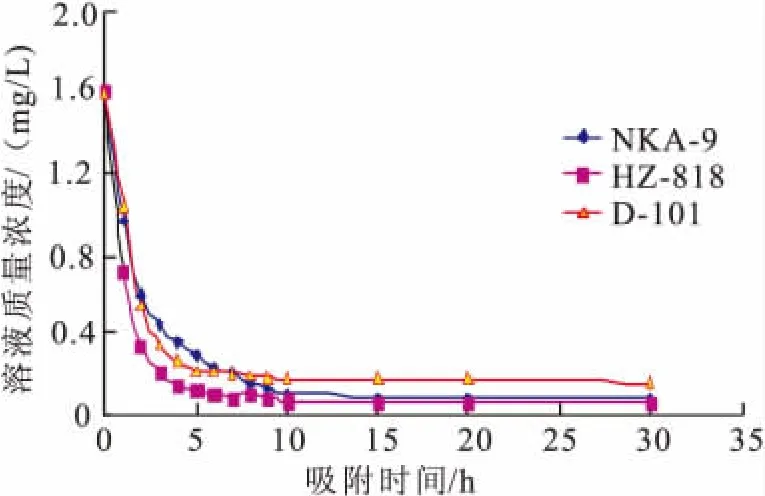
图1 大孔树脂静态吸附动力学曲线Fig.1 Static-adsorption dynamic curve of macroporous resins
由图1可知,HZ-818树脂对辽五味子黄酮的吸附为快速平衡型,起始阶段吸附量较大,5 h已基本接近吸附平衡,而NKA-9种树脂起始吸附量虽较大,但到达平衡的时间较长,10 h后才基本接近吸附平衡,D-101树脂吸附量相对较少。结合树脂对辽五味子黄酮的吸附与解吸附效果,选择HZ-818树脂进行动态吸附试验。
2.1.2 动态吸附-解析试验结果
1)上样流量及上样量的确定 通过调节恒流泵的流量对上柱样液进行吸附流量的选择,以泄漏点最迟出现的吸附流量为宜[10]。
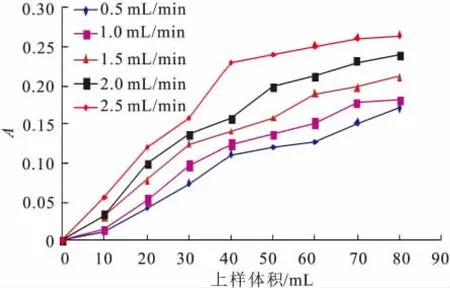
图2 吸附流量与吸光度关系图Fig.2 Relationship between adsorption velocity and absorbance
在上样质量浓度均为1.591 mg/m L,样液体积均为80 m L的条件下,控制流量分别进行动态吸附试验。5种吸附流速下的泄漏情况如图2所示。由计算可知,流量为0.5、1、1.5、2.0、2.5 m L/min时,泄漏点依次为71,67,50,43,40 m L。流量为0.5 m L/min时,虽然渗漏点出现的最迟,但因为流速慢,导致循环周期延长,工作效率低。而进样速度为1 m L/min时,泄漏点尽管出现得稍早,但工作效率高于0.5 m L/min。其它条件下泄漏点出现的太早,吸附效率低,而且在试验过程中发现,速度过快容易导致进样管堵塞。因此上样流量定为1 m L/min,上样量为65 m L。
2)洗脱液体积分数的确定 不同体积分数的乙醇极性不同,对黄酮的洗脱能力也不同。取已处理好的大孔吸附树脂柱,将待纯化液以1 m L/min流速上样,上样量为65 m L。用5 BV蒸馏水洗脱,除去蛋白质和多糖,然后依次用6 BV体积分数10%、30%、50%、70%和90%的乙醇梯度洗脱,流量定为2 m L/min,测定各部分洗脱液中总黄酮的含量,计算各部分解吸率。结果如图3所示,用体积分数70%乙醇洗脱时不仅能将大部分黄酮洗脱下来,而且最节省乙醇用量。
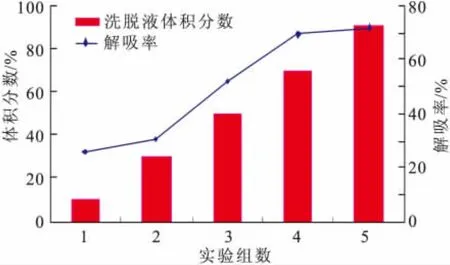
图3 不同洗脱剂体积分数对黄酮纯化的影响Fig.3 Effect of the concentration of ethanol on Purifieation
3)洗脱液流量的影响 洗脱液流量直接影响大孔吸附树脂对总黄酮的洗脱效果。流量过大容易形成拖尾现象且洗脱不彻底,过小则生产周期明显延长,成本增加。试验采用吸附黄酮后的树脂柱以体积分数70%的乙醇为洗脱液,洗脱流量分别对应0.5、1、1.5、2.0、2.5 m L/min。对解析效果作比较,结果如图4所示。

图4 不同解吸流量与吸光度的关系Fig.4 Relationship between desorption velocity and absorbance
由图4可以看出,以1.5 m L/min的流量进行洗脱得到的峰形没有明显拖尾现象,洗脱时间最短,效率最高,而2.0 m L/min和2.5 m L/min的洗脱峰比1.5 m L/min的峰形宽且拖尾比较严重,表明洗脱不彻底,效率较低。1.0 m L/min虽然洗脱率于1.5 m L/min时相当,但是洗脱时的峰拖尾严重,洗脱时间明显延长,效率低下,不利于生产。因此选择解析流量为1.5 m L/min为宜。
4)洗脱液用量的确定 吸附黄酮后的树脂柱以体积分数70%的乙醇为洗脱液,洗脱流量控制为1.5 m L/min。用部分收集器收集洗脱液,6 m L/管,测定其吸光度,结果如图5所示。
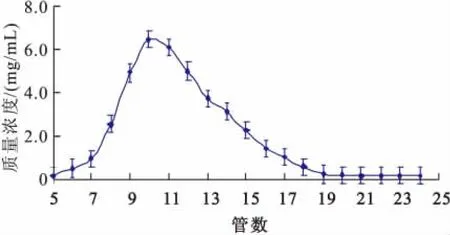
图5 不同洗脱剂用量对异黄酮纯化的影响Fig.5 Effect of the dosage of ethanol on Purification
由图5可知,随着洗脱液用量的增加,洗脱液中黄酮质量浓度逐渐增加,第10管洗脱液中黄酮质量浓度最高。随着洗脱时间的延长,随后各部分洗脱液中异黄酮质量浓度逐渐减少,至第19管时几乎没有所要的黄酮成分可以洗脱下来。因此,大孔吸附树脂的乙醇洗脱量为110 m L。
2.2 定性光谱分析
2.2.1 辽五味子黄酮的紫外—可见光谱分析辽五味 子 黄 酮 提 取 物 加 入 Na N02、Al(NO3)3和NaOH显色处理后,经过紫外—可见分光光度计扫描得到图谱6。由图可知,紫外—可见光谱中有两个主要的吸收峰组成,其中之一出现在430~450 nm(峰带Ⅱ),另一个在490~500 nm(峰带Ⅰ)。一般来说,峰带Ⅱ是苯甲酰基引起的,而峰带Ⅰ是由桂皮酰基系统引起。

图6 紫外—可见光谱Fig.6 UV-visible spectrum
2.2.2 辽五味子黄酮的红外分析取经过干燥的辽五味子黄酮样品1 g,与100~200 mg经干燥的KBr粉末在红外灯下,于玛瑙研钵研磨均匀,压成薄片,进行红外光谱测定[11],结果如图6所示。由图可见,波数3 415.76 cm-1为黄酮类化合物的羟基吸收峰;2 935.61 cm-1分子中饱和碳氢伸缩振动产生;波数1 735.17 cm-1的吸收峰是由C=O引起。1 518.48 cm-1为芳环振动吸收引起;图中1 074.21 cm-1为烷烃吸收峰;综上所述,推测提取物为多羟基黄酮类物质。

图7 黄酮的红外光谱图Fig.7 IR-spectrum of Ampelopsis gross edentate flavones
3 结语
通过对所选4种树脂辽五味子黄酮的吸附与解吸性能的研究,筛选出HZ-818树脂为理想的分离纯化的树脂,其吸附率为76.24%,解吸率为67.30%。
HZ-818树脂对辽五味子黄酮吸附分离的最佳工艺参数为:上柱量为65 m L,上柱流量1 m L/min,以体积分数70%乙醇为洗脱液控制洗脱液流量1.5 m L/min,洗脱液用量为110 m L。纯化物经光谱分析表明是多羟基黄酮类化合物。
(References):
[1]王森,张建国.五味子的研究概况及期开发前景[J].经济林研究,2003,21(4):126-127.
WANG shen,ZHANG jian-guo.General situation and developmental prospect onSchisandrachinensis(Turcz.)Baill[J].Current Researching Situation on Forest area,2003,21(4):126-127.(in Chinese)
[2]唐德才.中药现代研究与临床应用(第一卷)[M].上海:上海科学技术出版社,1997.
[3]戴好富,周俊,彭再刚,等.北五味子的水溶性化学成分[J].天然产物研究与开发,2000,13(1):24-26.
DAI haofu,ZHOU jun,PENG Zai-gang,et al.Water -soluble chemical composition of fructus schisandrae[J].Nature Product Research and Development,2000,13(1):24-26.(in Chinese)
[4]李恒.北五味子的现代研究[J].中国林副特产,2008,96(5):97-99.
LI Heng.Current study of northeast schisandra chinensis(Turcz.)Baill[J].Forest By-Product and Speciality in China,2008,96(5):97-99.(in Chinese)
[5]曹群华,瞿伟菁,李家贵,等.大孔树脂吸附纯化沙棘籽渣总黄酮的研究[J].中国中药杂志,2004,29(3):225-228.
CAO Qun-hua,ZHAI Wei-jing,LI Jia-gui,et al.Study on the purification capability of macroreticular resin flavonoids from seed residues of Hippophae rhamnoides(FH)[J].Magazine on Medicine of Chinese,2004,29 (3):225-228.(in Chinese)
[6]麻秀萍,蒋朝晖,杨玉琴,等.大孔吸附树脂对银杏叶黄酮的吸附研究[J].中国中药杂志,1997,22(9):539-542.
MA Xui-ping,JIANG Cao-hui,YANG Yu-qin,et al.Study on the adsorption capability of macroreticular resin to flavonoids on the leaves of Ginkgo biloba[J].Magazine on Medicine of Chinese,1997,22(9):539-542.(in Chinese)
[7]荣绍丰,付艳丽,王涛,等.大孔吸附树脂对发酵液中2-苯乙醇的吸附研究[J].食品与生物技术学报,2010,29(5):693-697.
RONG Shao-feng,FU Yan-li,WANG Tao,et al.Study on the adsorption capability of macroreticular resin to fermentation broth of 2- phenyl ethanol adsorption[J].Journal of Food Science and Biotechnology,2010,29(5):693-697.(in Chinese)
[8]熊浩平.分光光度法测定显齿蛇葡萄总黄酮含量[J].食品科学,2004,25(2):144-145.
XIONG Hao-ping.Determination the total flavonoids Ampelopsis content with spectrophotometry[J].Food Science,2004,25(2):144-145.(in Chinese)
[9]陈玉琼,李安琪,孟燕.大孔树脂纯化藤茶黄酮及主要成分结构鉴定[J].食品科学,2009,30(9):51-55.
CHEN Yu-qiong,LI An-qi,MENG Yan.Purification flavonoids and major components identification on Ampelopsis[J].Food Science,2009,30(9):51-55.(in Chinese)
[10]杨红.中药化学实用技术[M].北京:化学工业出版社,2004.
[11]沈秋仙.槲蕨根茎黄酮类物质提取条件的优化[J].丽水学院学报,2005,27(5):64-66.
SHEN quixian.Optimization of extracting condition of flavonoids from rhizoma of drynaria rhizoma drynariae[J].Journal of Lishui University,2005,27(5):64-66.(in Chinese)
Separation Purification and Spectrum of Flavonoids from LiaoSchisandrachinensis
MATao1,2,MAOHong-yan2,SHITai-yan1,ZHANGRui1
(1.Food Processing Institute,Liaoning Academy of Agricultural Sciences,Shenyang 110161,China 2.School of Food Science,Shenyang Agricultural University,Shenyang 110161,China)
This manuscript select four different macroporous resins that were used to static adsorption and desorption attached experiment for flavonoids of LiaoSchisandra chinensis(Turcz.)Baill.Among them,the highest adsorption capability of 76.24%and desorption rate of 67.30%were achieved at macroporous resin HZ-818 and was chosen.By using resin HZ-818,the optimum process conditions was determined and listed as follows:sample concentration 1.6 mg/m L,the sample size 65ml,and sample flow rate 1mg/min;70%ethanol as eluent at 1.5 m L/min,and eluent dosage for 110 m L.Under the optimum conditions,the elution ratio of flavones achieved at 79.57%.
LiaoSchisandrachinensis,favones,macroporous adsorption resin,spectral analysis
Q 657.32
A
1673-1689(2012)01-0101-05
2011-01-13
马涛(1962-),男,新疆喀什人,理学博士,教授,博士研究生导师,主要从事粮油食品储藏保鲜与深加工研究。Email:matao-09@163.com
