吉西他滨联合体外高频热疗治疗晚期胰腺癌的疗效观察*
2012-01-11张克勤魏红梅陆月香
张克勤 魏红梅 陆月香
(1. 从化市中心医院肿瘤中心,广东 广州 510900,2. 中国人民解放军第88医院肿瘤中心,山东 泰安 271000)
美国2010年统计胰腺癌(pancreatic carcinoma)为最常见癌症死亡的第4位,90%为导管腺癌,胰腺癌1年生存率为8 %,5 年生存率为3 %,中位生存期仅2~3 个月[1-2 ]。吉西他滨为脱氧胞苷类似物,在NCCN指南中吉西他滨单药已经作为一线治疗晚期胰腺癌的I类证据推荐[3 ]。热疗正在广泛用于临床,两者联合治疗62例晚期胰腺癌,以期提高晚期胰腺癌患者的客观缓解率和改善生存质量。
1 资料和方法
1.1 临床资料
2002年01月至2011年12月间共收治晚期胰腺癌48例,其中30例为组织学证实,18例为经内窥镜逆行胰胆管造影术(ERCP)、CT、MRI为主的影像学检查结合CA199升高而临床诊断为术后复发或失去手术机会的晚期胰腺癌,有29例患者以前均接受过氟尿嘧啶类药物的化疗,化疗疗程的中位数为5,其中男32例,女性16例。年龄37~72岁,中位年龄60岁。48例患者分为治疗组和对照组各24例。入组患者经进行体格检查、肝肾功、心电图、胸腹部CT等检查无化疗禁忌症。
1.2 治疗方法
治疗组采用吉西他滨联合体外高频热疗化疗:1000 mg/m2,静脉滴注30 min,第1、8、15天 给药,给药2 h后和2、9、16天辅以上腹部体外高频热疗(MTC-3D体外微波肿瘤热疗系统,频率2450±30 MHz,南京),温度恒定为45 ℃,每次治疗时间45 min,对照组仅给予吉西他滨单药静脉化疗:吉西他滨1000 mg/m2,静脉滴注30 min,第1、8、15天给药。28天为1个周期,全组病例均接受2或2个周期以上的热化疗。重度疼痛患者同时给予镇痛药物。
1.3 客观疗效评价
按照实体瘤疗效反应的RECIST 1.1评价标准(response evaluation criteria in solid tumors,RECIST)[4-5]评价客观疗效,完全缓解(complete response,CR):所有靶病灶均消失,全部病理淋巴结(包括靶结节和非靶结节)短直径必须减少至<10 mm;部分缓解(partial response,PR):靶病灶的最大直径总和比基线水平减少至少 30%;疾病进展(progressive disease,PD):以整个研究过程中所有测量的靶病灶直径之和的最小值为参考,直径和相对增加至少20%,或出现新病灶,除此外,必须满足直径之和的绝对值增加至少5 mm; 疾病稳定(stable disease,SD):靶病灶减小的程度没达 PR,增加的程度也没达到 PD 水平,介于两者之间。均需维持 4 周以上。
1.4 临床受益反应(clinical benefit response,CBR)[3]
① 疼痛。阳性:疼痛强度降低超过50%,止痛剂用量减少50%;阴性:疼痛程度加重,止痛剂用量增加;稳定:疼痛程度及止痛剂用量无变化。按VAS(visual analogue scale)数字疼痛分级标准评判疼痛强度[6]。② KPS 评分。阳性:较化疗前提高 20 分以上;阴性:较化疗前降低20 分以上;稳定:化疗前后无明显变化。③ 以上任一项阳性超过4周,其他指标没有持续恶化即被认为临床受益。若CBR 主要评估指标即疼痛和 KPS 评分均处于稳定状态,则体重增加幅度超过 7% 持续 4 周也视为阳性。
1.5 不良反应评价
药物毒性按照 NCI CTC 3.0 版的分级标准评价,分为0~4 级[7]。
1.6 统计学处理
采用 SPSS 13.0 统计软件进行分析,计数资料比较采用χ2检验,检验水准α = 0.05。
2 结 果
2.1 近期客观疗效
48 例患者均完成 2 个周期化疗后准备行第3周期治疗前进行腹部 CT 或 MRI 等影像学检查以评估客观疗效。根据 RECIST1.1 标准,治疗组其中完全缓解 0 例,部分缓解 6 例(25.0%),稳定 10例(41.7%),有效率为 25.0%(6/24),疾病控制率为 66.7%(16/24);对照组其中完全缓解 0 例,部分缓解 4 例(16.7%),稳定 7 例(29.2%),有效率为 16.7%(4/24),疾病控制率 45.8%(11/24)。治疗组各项指标和对照组相比P<0.05。详见表1.
2.2 临床受益反应
治疗组 24 例中有 17 例患者的疼痛、恶心呕吐、厌食、消瘦等相关症状有不同程度减轻。参照 CBR 指标,临床受益反应率为 70.9%(17/24);对照组患者临床受益反应率为 50.0%(12/24);临床受益反应持续时间最短 2 个月,最长达 8 个月。详见表1.
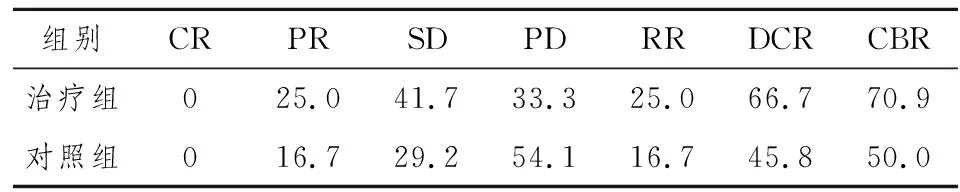
表1 两组患者治疗后的情况(%)
注:治疗组各项指标和对照组相比,P<0.05
2.3 安全性评价
全部患者均能耐受至少 2 个周期的热化疗,主要不良反应为与化疗药物相关的消化道反应及骨髓抑制。I-II度的消化道反应治疗组发生率 54.2%(13/24),对照组 58.3%(14/24),两者相比无统计学差异(P>0.05),给予地塞米松、甲氧氯普胺加强止吐,症状缓解。骨髓抑制主要为I~II度贫血、白细胞减少及血小板下降,其中III度白细胞和血小板下降治疗组发生率分别为 8.3%(2/24)、12.5%(3/24),对照组为 12.5% (3/24)、16.7%(4/24),两组相比无统计学差异(P>0.05),两组均无 IV 度骨髓抑制。患者没有因不良反应而退出治疗。
3 讨 论
胰腺癌在是恶性程度极高的消化道肿瘤,因解剖位置特殊,早期症状的隐匿性和非特异性,80% 以上的患者诊断时已经失去手术时机,无法手术的患者平均生存期仅6个月左右,是一预后较差的肿瘤,手术是唯一的根治手段[8-9]。
晚期胰腺癌治疗的首要目的在于对症支持治疗并延长生存期,尽管获得一些生存获益,但这些获益往往仅限于那些体力状况较好的患者(ECOG评分为0~1,疼痛控制良好,胆道支架通畅以及充足的营养摄入)。对于局部晚期或远处转移的肿瘤,吉西他滨被证明相对5-FU推注方案可提供更多的临床获益和一定的生存获益[3]。NCCN专家组推荐吉西他滨单药方案(1000 mg/m2,静脉滴注30 min,每周1次,共3周,每28天为1个周期)为肿瘤转移患者的治疗选择(I类推荐)[3]。虽然目前对体质状况好的已改善了晚期患者的生存期,但时间也是有限的,为了进一步提高疗效,改善生活质量,和其他高效低毒的治疗方法联用如热疗等,也是综合治疗的发展趋势。
热疗(Hyperthermia)即加热疗法,是指利用有关物理能量在组织中沉淀而产生热效应使肿瘤组织温度上升到有效治疗温度,并维持一段时间,改变肿瘤细胞所处的环境,抑制肿瘤血管生成和肿瘤细胞转移,并使其凋亡、坏死,从而达到治疗肿瘤的目的。由于其治疗恶性肿瘤、尤其是晚期恶性肿瘤有良好效果,并发症少,因此1985年被美国食品与药物管理局(Food and Drug Administration,FDA)认证热疗为治疗肿瘤的有效手段之一,目前有大量的随机小样本的临床试验验证了热疗是一种有效的治疗肿瘤的方法,与放疗、化疗联合有很好的协同增敏作用,并能调节机体的免疫功能[10-12]。有关热疗增敏化疗的临床试验研究报道不断增多,典型的有区域性马法兰热灌注治疗肢体恶性黑色素瘤有效率 70% 以上,肢体保存率超过 80%,目前欧洲已批准此疗法在临床推广[13]。热灌注化疗作为以减瘤术为主要手段的综合治疗的一部分,对选择性患者可能延长生存,在美国外科肿瘤年会上,专家们推荐腹腔灌注热化疗作为复发转移性结直肠癌或盆腔肿瘤腹膜转移的治疗方法之一[14]。
高热与化疗药物并用抗癌效应理论:①热疗提高了肿瘤细胞膜的通透性,有利于化疗药物的渗透和吸收,从而保持细胞内较高的药物浓度。②高温改变药物在体内的代谢,增加细胞内药物的堆积,增强靶结构的敏感性,提高药物对细胞的杀伤力;③热疗可以促进化疗药物诱发的细胞凋亡。④肿瘤中心部位血供较差,散热困难,热量容易集聚,而且该部位多为对高热敏感的乏氧细胞。相反周边部分血供较多,化疗药物容易到达;⑤高温抑制抗癌药引起的癌细胞损伤修复;⑥高温抑制抗癌药物引起的癌细胞损伤的修复;⑦热疗要减少或防止耐药性的发生,对化疗产生耐药性的肿瘤细胞热疗后,对化疗敏感性又大大加强。
本研究治疗组采用局部热疗联用吉西他滨方案治疗晚期胰腺癌患者 24 例,对照组为吉西他滨单药治疗,尽管没有一例患者达 CR,但治疗组疾病控制率(CR+PR+SD)率达66.7%,明显高于吉西他滨单药组(45.8%,P<0.05)。在取得较好的客观疗效的同时,热化疗所致的不良反应均可耐受,两组无明显差异(P>0.05)。由于胰腺解剖位置的特殊性,肿瘤边界难以与其他组织区分,即使是目前较为先进的三维影像技术对该类肿瘤的评估也会有偏差,大部分肿瘤应用WHO或RECIST来判断疗效较为困难。考虑到晚期胰腺癌是一种逐渐衰竭的疾病,大部分患者存在疼痛、消瘦、厌食等症状,因此,改善其症状的姑息治疗尤为重要。在这种背景下,国外学者提出了临床受益反应的概念,在胰腺癌的疗效评估中得到美国FDA的认可。临床受益反应是指与肿瘤相关的症状,包括疼痛、体力状况和体重等在治疗后得到改善,其中将疼痛和体力状况作为首要评估指标,而体重变化作为次要评估指标[3]。在本研究的患者中,治疗组中 17 例、对照组中 12 例患者经治疗后临床受益,主要表现为疼痛减轻或停用止痛药物或减少止痛药物的用量、食欲改善、体重增加及KPS评分提升,提高了患者的生存质量,临床受益反应率分别为 70.9%(17/24)、50.0%(12/24),两组相比有统计学差异(P<0.05)。这些数据也和许多文献所报道的晚期胰腺癌姑息化疗后的临床获益率相似。
综上所述,吉西他滨联合局部高频热疗治疗晚期胰腺癌近期疗效好于单药吉西他滨,改善了晚期患者的疼痛,提高了生活质量,毒副作用均可耐受。在晚期胰腺癌的综合治疗中,安全有效,值得在临床上推广和积累病例进一步深入研究。
[1] Jemal A, Siegel R, Xu J,et al.Cancer statistics, 2010. CA Cancer J Clin. 2010,60(5):277-300.
[2] 施健,吴诚,刘苏,等. 我国胰腺癌部分发病危险因素的Meta 分析. 胰腺病学,2004 ,4 (3) :154 - 158.
[3] Burris HA 3rd, Moore MJ, Andersen J, et al.Improvements in survival and clinical benefit with gemcitabine as first-line therapy for patients with advanced pancreas cancer: a randomized trial. J Clin Oncol. 1997 ,15(6):2403-2413.
[4] Edeline J, Boucher E, Rolland Y,et al.Comparison of tumor response by Response Evaluation Criteria in Solid Tumors (RECIST) and modified RECIST in patients treated with sorafenib for hepatocellular carcinoma. Cancer, 2012 ,118(1):147-156.
[5] Eisenhauer EA, Therasse P, Bogaerts J, et al.New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1).Eur J Cancer. 2009 Jan;45(2):228-247.
[6] Ware LJ,Epps CD,Herr K,et al.Evaluation of the Revised Faces Pain Scale,Verbal Descriptor Scale,Numeric Rating Scale,and Iowa Pain Thermometer in older minority adults. Pain Manag Nurs,2006,7(3):117-125.
[7] 刘宝瑞,钱晓萍.临床肿瘤学-基本理论与诊疗路径.北京:科学出版社,2007:121-124.
[8] Loos M, Kleeff J, Friess H,et al.Surgical treatment of pancreatic cancer. Ann N Y Acad Sci, 2008 ,1138:169-180.
[9] Hackert T, Büchler MW, Werner J.Surgical options in the management of pancreatic cancer. Minerva Chir. 2009,64(5):465-476.
[10] Maluta S, Schaffer M, Pioli F, et al.Regional hyperthermia combined with chemoradiotherapy in primary or recurrent locally advanced pancreatic cancer : an open-label comparative cohort trial. Strahlenther Onkol. 2011,187(10):619-625.
[11] Bakshandeh-Bath A, Stoltz AS, Homann N, et al.Preclinical and clinical aspects of carboplatin and gemcitabine combined with whole-body hyperthermia for pancreatic adenocarcinoma. Anticancer Res. 2009,29(8):3069-3077.
[12] Frey B, Weiss EM, Rubner Y, et al.Old and new facts about hyperthermia-induced modulations of the immune system. Int J Hyperthermia. 2012 Jun 12. [Epub ahead of print]
[13] Grünhagen DJ, de Wilt JH, van Geel AN,et al. Isolated limb perfusion with TNF-alpha and melphalan in locally advanced soft tissue sarcomas of the extremities. Recent Results Cancer Res, 2009,179:257-270.
[14] Vaira M, Cioppa T, D'Amico S,et al. Treatment of peritoneal carcinomatosis from colonic cancer by cytoreduction, peritonectomy and hyperthermic intraperitoneal chemotherapy (HIPEC). Experience of ten years. In Vivo, 2010 ,24(1):79-84.
