酶育牛黄对肉瘤S180的抑制作用及免疫调节作用的初步研究
2012-01-11刘化侠魏寅翼胡晓旭万学英
刘化侠 魏寅翼 胡晓旭 万学英 李 蕾
(泰山医学院护理学院,山东 泰安 271016)
天然牛黄 (natural calculus bovis, NCB) 是珍贵的中药材,主要含胆汁酸、胆色素、肽类物质、氨基酸、多种微量元素及维生素D和类胡萝卜素等多种活性物质。研究显示其具有良好的解热镇痛、抗肿瘤和免疫增强作用[1],但机制未明。由于天然牛黄资源奇缺,价格昂贵,因此研发天然牛黄的替代品是解决资源不足的主要途径之一。酶育牛黄(culculus bovis cultivated by glucuronidase, CBCG)是泰山医学院自行研制的一种在体外培育的牛黄[2],高效液相电化学法(HPLC) 检测发现其胆红素含量明显高于天然牛黄, 胆酸类成分与天然牛黄相当;HPLC-ELSD指纹图谱进一步证实制备工艺稳定。初步研究发现酶育牛黄在抗炎、解热镇痛方面的药理效应与天然牛黄相当。本实验旨在初步探讨酶育牛黄的抗肿瘤及免疫调节作用,为酶育牛黄抗肿瘤的深入研究提供理论依据。
1 材料和方法
1.1材料 动物:昆明种小鼠50只,体重20~26 g,清洁级。动物合格证号:0011932。小鼠标准颗粒饲料喂养,由泰山医学院实验动物中心提供。 药品: CBCG:由泰山医学院周广礼教授提供。注射用环磷酰胺:山西普德药业股份有限公司,批号:04110605。肉瘤S180细胞:上海博全尔生物科技有限公司。
1.2实验方法
1.2.1体内实验
1.2.1.1牛黄混悬液的制备 取淀粉1 g加入100 ml蒸馏水,煮沸,室温冷却。加入适量CBCG,即得酶育牛黄混悬液。

1.2.2体外实验
1.2.2.1含药血清的制备 取Wistar大鼠8只,雌雄各半,每天分别灌胃给予牛黄混悬液2 g/kg或腹腔注射CTX 20 mg/kg,连续7天,最后一次给药后2小时,水合氯醛麻醉,心脏取血,无菌分离血清,56℃、30 min灭活,-20℃保存备用。



2 结 果
2.1体内实验
2.1.1酶育牛黄对小鼠肉瘤S180的体内抑制作用 从表1可以看出,模型组小鼠体内肿瘤的平均瘤重明显增加;连续给予酶育牛黄10天剂量依赖性地抑制肿瘤生长,中剂量和高剂量组明显使平均瘤重减轻,与模型组相比,差异具有显著性。环磷酰胺组的抑瘤率达到74.24%,显示出较好的抑瘤作用。

表1 酶育牛黄对小鼠肉瘤S180的体内抑制作用(n=10)
注:与模型组比较,***P<0.001。
2.1.2CBCG对免疫器官的影响 与模型组比较,酶育牛黄各组脾和胸腺指数均有所增加,且呈现剂量依赖,其中高剂量组能够明显提高免疫器官重量,与模型组相比,差异具有显著性。环磷酰胺组,脾指数及胸腺指数均有所降低,结果见表2。

表2 酶育牛黄对小鼠免疫器官的影响(n=10)
注:与模型组比较,***P<0.001,###P<0.001。
2.2体外实验
2.2.1CBCG含药血清对S180的生长抑制作用 酶育牛黄含药血清处理24或48小时,肉瘤S180细胞生长受到抑制,其作用随含药血清浓度的增加而增强。10%、20%、30%酶育牛黄组和10%环磷酰胺组效果尤为明显,与对照组比较,具有显著性差异,结果见图1,2。

注:与对照组比较,***P<0.001。
图1 CBCG含药血清作用24小时抑制S180细胞增殖率

注:与对照组比较,*P<0.05 ,**P<0.01,***P<0.001 。
图2 CBCG含药血清作用48小时抑制S180细胞增殖率
2.2.2CBCG含药血清对脾细胞的促增殖作用 酶育牛黄含药血清作用24或48小时可促进脾细胞增殖,且其增殖程度与血清浓度、作用时间呈正相关。7.5%、10%、20%、30%酶育牛黄组效果明显,与对照组比较,具有显著性差异。环磷酰胺组对脾细胞增殖具有抑制作用,结果见图3,4。
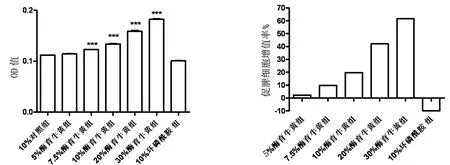
注:与对照组比较,***P<0.001。
图3 CBCG含药血清作用24小时促脾细胞率

注:与对照组比较,**P<0.01,***P<0.001。
图4 CBCG含药血清作用48小时促脾细胞率
3 讨 论
恶性肿瘤是二十一世纪人类健康的第一杀手。目前对恶性肿瘤的治疗还没有特效药,从中药复方或制剂中开发研制新的抗肿瘤药成为恶性肿瘤治疗的重要课题之一。牛黄常被制成复方制剂如犀黄丸(西黄丸)等, 用于各种恶性肿瘤如肝癌的治疗。研究发现,牛黄和人工牛黄都有增强免疫和抗肿瘤的作用,抑瘤率在30%~72.2.%[1,3-4]。但目前对牛黄及其复方制剂的抗肿瘤研究主要集中在体内实验和临床研究,对体外及细胞的抗肿瘤研究鲜有报道。而且,牛黄复方制剂产生的抗肿瘤作用是否来自于多种成分的复合效应还是单纯牛黄的作用也未见报道。 本研究主要从免疫机制着手,探讨我们自主研制的酶育牛黄在小鼠体内的抗肿瘤作用,同时采用体外细胞实验初步探讨其作用机制。
研究结果显示:酶育牛黄在小鼠体内外均呈现较好的抗肿瘤作用,酶育牛黄高剂量组对抑瘤率的影响超出了“抗癌药体内药效试验规程”所限定的30%标准[5]。酶育牛黄组抑瘤率虽略低于阳性对照药组,但其未出现环磷酰胺组的免疫抑制作用,相反其促进免疫器官代偿性增大(图3,4)。本研究的体外实验结果进一步验证了体内实验的结果。由此可见,酶育牛黄不仅具有良好的抑制瘤细胞增殖的作用,同时具有促进免疫细胞增殖的作用。本研究为酶育牛黄的抗肿瘤机制的深入研究提供了研究基础,也为开发新型抗肿瘤药提供了理论依据。
[1] 迟程,迟萍. 中国牛黄43年(1949-1992)研究动态[J]. 中国民族民间医药杂志,1996,18(1):27-35.
[2] 周广礼,张丰雪,朱长义.以大肠杆菌B-葡萄糖醛酸酶培育牛黄实验研究[J]. 泰山医学院学报,1991,12(1):13-14.
[3] 田彦玲,刘京生.牛黄天龙方药对荷瘤小鼠免疫功能的影响及其抗肿瘤作用的实验研究[J].河北医药,2009,31(23):3184-3185.
[4] 汪世元,陈孝平,蔡红娇,等.外培育牛黄诱导人肝癌HepG2细胞凋亡的实验研究[J].华中科技大学学报:医学版,2005,34(6):754.
[5] 潘启超.肿瘤药理学及化学治疗学[M].广州:广东高等教育出版社,1989:432.
