N-(4-吡啶基甲基)咔唑的合成、结构及性质研究
2012-01-10胡扬剑毛新平
胡扬剑, 毛新平
(怀化学院化学与化工系,湖南怀化418008)
咔唑及其衍生物分子由于具有优良的光电性能使它们在光电材料领域中也得到了广泛的应用,可用作光敏剂、电致发光材料、电荷传输材料、双光子引发剂等[1-3].它们的这种光电性能源自于其分子具有刚性平面结构的大π共轭体系,电子离域性好,有强的分子内电子转移性能,所以设计、合成具有光电功能的咔唑衍生物,一直是光电功能材料领域的研究热点之一[4-8].它的刚性平面结构也是人们用于构筑功能配合物或配位聚合物的重要结构单元.咔唑是一种含氮原子的杂环化合物,其衍生物可以有多配位点或是桥联配体,可以多种方式与金属或稀土金属离子配位,得到各种不同功能的材料[9-11].此外,许多咔唑衍生物具有生物活性,如消炎、抗菌、抗病毒活、抗抑郁和抗惊厥等.在咔唑环上或氮原子上引入不同取代基或功能基,可以得到药物中间体.
本文合成了一种氮上取代的咔唑衍生物,即N-(4-吡啶基甲基)咔唑.对其结构进行了表征,并测定其紫外吸收光谱和荧光光谱.
1 实验部分
1.1 实验药品和仪器
4-氯甲基吡啶盐酸盐,工业纯,上海瑞齐生物科技公司;氢氧化钾,分析纯,天津市化学试剂三厂;咔唑,化学纯,中国上海远航试剂厂;N,N-二甲基甲酰胺 (DMF),分析纯,西陇化工厂.U-2550型紫外可见分光光度计,日本岛津公司;FTIR-8400S傅立叶变换红外光谱仪,日本岛津公司;Bruker 300 Ultrashield核磁共振仪,德国Bruker公司;YRT-3型熔点测定仪,天津大学精密仪器厂;质谱Macromass GCT-MS(EI源);元素分析由德国Elementar公司Vario EL元素分析仪.
1.2 合成
合成反应:
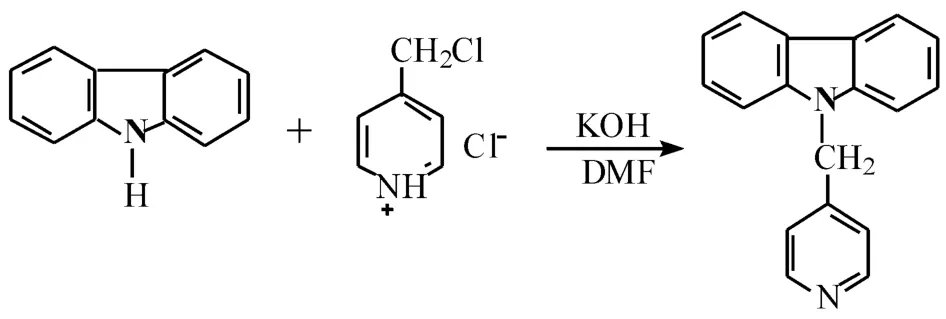
在装有磁搅拌子的150 mL圆底烧瓶中加入8.0 g氢氧化钠和50 mL溶剂,在室温下搅拌20 min.再加入4.0 g(0.024 mol)咔唑,继续搅拌40 min.在搅拌状态下缓慢滴加5.0 g(0.03 mol)3-氯甲基吡啶盐酸盐的N,N-二甲基甲酰胺溶液50 mL.滴加完后,继续在室温下反应12 h.然后倒入500 mL水中,静置4 h,有淡黄色沉淀析出.过滤,用去离子水洗涤数次,真空干燥,得粗产品.用95%乙醇重结晶,得5.2 g白色固体,收率84%,熔点125~126℃.1HNMR(500 MHz,d6-DMSO),δ:5.57(s,2 H),7.07(d,2 H),7.24(t,2 H),7.43(t,2 H),7.59(d,2 H);8.22(d,2 H);8.45(d,2 H).IR(KBr,cm-1):3026,2998,1272,1245,1592,1499.元素分析实测值 (%):C,82.98;N,10.52;H,5.25.理论值 (%):C,83.69;N,10.84;H,5.46.m/z:257.11(M+)
1.3 紫外光谱和荧光光谱的测定
在测试过程中所使用的溶剂均按照标准方法精制.选用的溶剂按照极性的大小依次为:甲苯,四氢呋喃,氯仿,丙酮,乙醇,N,N-二甲基甲酰胺 (DMF).紫外可见光谱测试的试样浓度为1.0×10-6mol/L.
2 结果与讨论
2.1 溶剂的影响
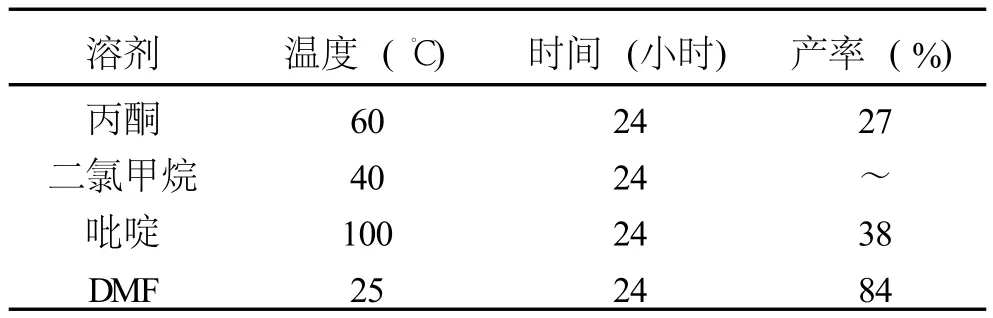
表1 咔唑与4-氯甲基吡啶盐酸盐在不同溶剂中反应产率
咔唑与4-氯甲基吡啶盐酸盐的反应一般是在无水的极性有机溶剂中进行.因为在氢氧化钾的作用下咔唑氮原子上的氢原子被脱去,转变成咔唑钾盐,如果有水存在,就会影响咔唑钾盐的形成,不利于后续反应.另外,4-氯甲基吡啶盐酸盐在一般的有机溶剂中的溶解度比较小,但易溶于水,相对来说在吡啶中的溶解度较大,在N,N-二甲基甲酰胺 (DMF)有一定的溶解度,而在丙酮、二氯甲烷中难溶.在不同溶剂中反应的结果见表1.
在所选的溶剂中,吡啶虽然对咔唑和4-氯甲基吡啶盐酸盐的溶解度很大,但反应的产率却很低,其原因可能是吡啶的存在影响了反应的进行.由于在丙酮中的溶解度不大,所以反应产率很低,而在二氯甲烷中基本上没有产物生成.DMF的极性很强,虽然不能完全溶解4-氯甲基吡啶盐酸盐,但反应的产率比较好,达到了84%.从表中反应条件可以看出,在用DMF作溶剂时,反应是在常温下进行的,因为反应是以碱为催化剂,DMF在碱性或酸性条件下随温度的升高会显著的分解,所以采取常温进行反应.而其它几种溶剂,产品的收率都不高或不反应.
2.2 结构表征
2.2.1 红外光谱
测定了产物的红外光谱,谱图如图3.1所示.从图中可以发现,在3 026 cm-1处有明显的不饱和C-H伸缩振动峰,即咔唑环和吡啶环上的C-H伸缩振动峰,2 998 cm-1是饱和CH2的伸缩振动峰,1 272 cm-1和1 245 cm-1是咔唑叔胺的特征吸收峰,1 592 cm-1和1 499 cm-1是吡啶环和咔唑环的C=C的特征吸收,这初步说明了产物为所合成的目标产物.

图1 N- (4-吡啶基甲基)咔唑的IR谱图
2.2.2 核磁共振波谱分析
对产物做了核磁共振氢谱,见图2.从一维氢谱可以看出有九组峰,化学位移在2.5 ppm处的峰是氘代试剂DMSO的残余氢峰,而3.32 ppm处的峰应该为杂质水的单峰,这与文献相符[12].5.74 ppm处的峰为吡啶环4位上连的亚甲基 (c)上的氢化学位移.7.05 ppm处的峰为吡啶环上3位 (b)上的氢化学位移,7.24 ppm处的峰为咔唑环上f位上的氢峰,7.44 ppm的峰对应e位上的氢位移,7.58 ppm处峰对应于d处上的氢,8.20 ppm处峰则属g位上的氢位移,8.45 ppm处峰属于a位上的氢位移峰.由于这些峰靠得比较近,归属有时有困难.为了确定上述峰的归属是否正确,可以从二维1H-1HCOSY谱上得到进一步确证.从二维谱上左下角开始,a峰 (8.45 ppm处)与b峰是相关峰,它们有偶合,对应分子中的吡啶环上的a、b位置上的氢原子;g峰与f峰相关,是咔唑环上的g位与f位置上氢的偶合;d峰与e峰是相关峰,分子中这两个位置上的氢偶合;同样e峰与f峰偶合.还可以看出b峰与c峰的氢相关,这是通过双键的远程偶合.溶剂峰和水峰与产物分子上的氢峰无任何偶合关系.所以从二维谱上可以更进一步的确定分子结构.

图2 N-(4-吡啶基甲基)咔唑1H-NMR谱

图3 N- (4-吡啶基甲基)咔唑1H-NMR谱为二维谱图
2.3 光谱性质
2.3.1 紫外可见光谱
图4是产物在不同溶剂中的紫外吸收光谱.从谱图上看,在290 m左右的吸收峰可能是芳香环的π-π*吸收,在340 nm附近的吸收是咔唑环的大π-π*体系的跃迁.此外,还测定了产物在这六种不同溶剂中的紫外光谱.结果见表2.从测定的紫外光谱来看,不同溶剂中的吸收峰的数目和位置没有大的变化,只是吸收峰的强度在不同的溶剂中有所不同,其中在前三种溶剂中产物的最大吸收峰变化不大,出现在330 nm左右,在后三种溶剂中产物的最大吸收峰却在295 nm左右,说明不同的溶剂对不同的跃迁有一定的影响.

表2 产物在不同溶剂中的最大吸收
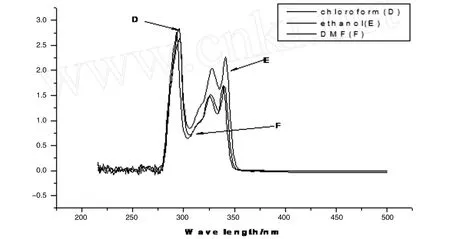
图4 N- (4-吡啶基甲基)咔唑的紫外电子吸收谱
2.3.2 荧光光谱
产物的荧光光谱如图5所示.从图可知,N- (4-吡啶甲基)咔唑具有较好的荧光性能.在绝对乙醇中,浓度为1.0×10-6mol/L,在300 nm~450 nm之间有双峰,荧光发射峰分别位于335 nm和354 nm处.这种双峰现象可能是由分子内吡啶环的影响而产生的,不过这需要进一步的研究来探明形成双峰吸收的原因.

图5 产物在不同溶剂中的荧光谱图
3 结论
采用N-烷基化反应制备了N- (4-吡啶基甲基)咔唑,在室温下进行反应,产率可达84%,其反应具有操作简单、产率高、易提取等优点.采用红外光谱、核磁共振光谱、质谱等对产物进行了表征,结果与所设计结构一致.最后对所合成产物的性质进行了一定的研究,其中主要研究了紫外光谱和荧光光谱子性质,对产物的紫外和荧光光谱性质做了测定,有较好的荧光性能.在后续工作中,我们准备利用吡唑所含的氮原子作为配位原子,与金属的多种配位形成配合物或配位聚合物,将功能性基团引入到无机分子中,将两者的性能结合起来,以期制备具有应用前景的新型功能材料.
[1]Cha Sand Jin J.A Field-dependent Organic LED Consisting of Two New High Tg Blue Light Emitting Organic Layers a Possibility of Attainment of a White Light source.J.Mater.Chem.,2003,13(3):479-484.
[2]Guan M,Bian Z,Y.Zhou F,High-performance Blue Electroluminescent Devices Based on 2- (4-BiPhenylyl) -5- (4-ebarazole-9-yl)Phenyl-1,3,4-oxdaiazole.Chem.Commun.,2003,39(21):2708-2709.
[3]Wu F,Shih P.Novel Distyrylcarbazole Derivatives as Holetransporting Blue Emitters for Electroluminescent Devices[J].J.Mater.Chem.,2005,15(44):4753-4760.
[4]朱军,金凤,卓馨.3- [4- (咪唑)苯乙烯基]-9-乙基咔唑的合成及其性质研究 [J].合成化学,2007,15(3A):288-291.
[5]尹龙,杨俊佼,陈卫强,段宣明.新型双光子引发剂9-苄基-3,6-二 [2- (吡啶-4-基) -乙烯基]咔唑的合成及其聚合特性 [J].北京化工大学学报,2007,34(6):579-583.
[6]王伟,方奇,刘志强.V形咔唑衍生物的合成及荧光性质 [J].化学学报,2005,63(14):1323-1328.
[7]张居舟.多枝双光子引发剂的合成、性质和微加工[D].安徽:安徽大学,2005.
[8]陆震,丁宝福,付慧英.苯并噻唑取代咔唑衍生物的电致发光性能 [J].复旦学报,2008,47(1A):113-116.
[9]Ying W,LiuD,Yan S.Tuned Trizolatesivler(Ⅰ)Luminescent Complex from Zero to Three Dimensionality Based on Bi- to Tetratopic Bridged Ligands[J].Inorganic Chemistry,2007,46(6):2002-2010.
[10]Arroyo M,Miguel D,Villafan F,et al.Rhenium-mediated Coupling of Acetonitrile and Pyrazoles.New molecular clefts for ani on binding[J].Inorganic Chemistry,2006(17):7018-7026.
[11]Mohamed R,Galassi F,Burini A P,et al.Gold(Ⅰ)and silver(Ⅰ)mixed metal trinuclear comp lexes:Di meric p r oductsfrom the reacti on of gold(Ⅰ)carbeniates or benzyli midazolates with silver(Ⅰ)3,52 di phenyl pyrazolate ahmed[J].Inorganic Chemistry,2006 (19):7770-7776.
[12]Gottlieb H E,K otlyar V,Nudelman A.NMR Chemical Shifts of Common Laboratory Solvents as Trace Impurties[J].J.Org.Chem.,1997,62(21):7512-7515.
