大鼠ZnT1基因重组腺病毒载体的构建及鉴定*
2012-01-08胡英明梅晰凡宋长威
胡英明,梅晰凡△,宋长威,李 谌
(辽宁医学院附属第一医院:1.骨科;2.中心实验室,辽宁锦州 121000)
锌转运体-1(zinc transporter1,ZnT1) 是锌转运蛋白家族的重要成员之一,在调解机体锌代谢以及神经活动过程中发挥着极其重要的作用[1]。研究显示,ZnT1在正常鼠脊髓有少量的分布,在脊髓损伤(spinal cord injury,SCI)后显著增加,且与脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)的表达呈正相关,提示它可能是调控内源性BDNF表达量增加,促进损伤脊髓神经元及其轴突修复的主要原因[2-4]。然而,SCI后BDNF总量的增加不足以维持损伤处神经元的存活和轴突的再生,人们采用外源性BDNF来修复SCI虽然取得了一定的疗效[5-7],但是,外源性BDNF存在着宿主排斥反应、难以通过血脑屏障以及基因治疗的长期安全性等问题。如果能寻找出调控内源性BDNF及其受体表达的有效途径,促进内源性BDNF的合成、释放及与受体结合,将在体内建立有效的保护机制,从而减轻脊髓继发性损伤。由Invitrogen公司开发的GatewayTM技术是一种基于λ噬菌体位点特异性重组系统,能够快速地、特异性地将一个或多个目的基因片断克隆到入门载体[8-9],该技术大大地简化了基因克隆的步骤,且效率高达95%或以上[10]。本研究采用GatewayTM技术构建大鼠ZnT1基因重组腺病毒载体,为下一步研究ZnT1基因在脊髓神经细胞中的表达以及与BDNF/TrkB信号调节通路的关系奠定了基础。
1 材料与方法
1.1材料 目的基因片段ZnT1/IRES/EGFP委托赛业(广州)生物科技有限公司化学合成;pDonr221载体供体、pDown入门载体、Ad/CMV/V5-DEST载体、BP ClonaseTM酶、LR ClonaseTM酶Invitrogen公司;PacⅠ、EcoRⅤ、NdeⅠ、BstBⅠNEB公司;质粒大提试剂盒、质粒小提试剂盒购自Promega公司;HEK293A细胞由本实验室保存; DNA Marker、DMEM培养基及胎牛血清购自Hyclone公司。
1.2方法
1.2.1含重组位点attB目的基因片段的获取 在GenBank中检索大鼠ZnT1cds序列,委托赛业(广州)生物科技有限公司化学合成ZnT1/RES/EGFP目的基因片段,采用PCR方法在该基因片段两侧添加attB重组特异位点,重叠延伸PCR技术扩增基因片段attB1-ZnT1/IRES/EGFP-attB2,用1%的琼脂糖凝胶进行电泳,反应产物参照QIAquick的琼脂糖凝胶电泳回收试剂盒进行回收,-20 ℃冰箱保存。
1.2.2入门克隆的构建 将2 μL目的基因片段、2 μL含有attP位点pDonor221供体载体、1 μL BP ClonaseTM酶和适量TE缓冲液混合25 ℃,BP反应3 h,加入蛋白酶K终止反应10 min,取反应终产物转化感受态大肠杆菌Stbl3,转化物涂到含有卡那霉素的LB培养基,37 ℃孵育过夜,无菌操作下挑取单个阳性克隆,小量提取质粒,并对提取质粒进行EcoRⅤ酶切筛选并送交阳性克隆进行测序,测序引物为:Forward,5′-CGG CCA GTC TTA AGC TCG GG-3′;Reverse,5′-AAT ACG ACT CAC TAT AGG GGA-3′。将正确克隆命名为pDown-ZnT1。
1.2.3表达克隆的构建 将1 μL入门克隆产物,1 μL目的载体Ad/CMV/V5-DEST,1 μL的 LR ClonaseTM酶,2 μL的TE缓冲液混合,25 ℃,LR反应16 h,使入门克隆与目的载体发生体外特异位点重组。取反应终产物转化感受态大肠埃希菌Stbl3,转化物涂到含有氨苄霉素的LB培养基,无菌操作下挑取单个阳性克隆,小量提取质粒,NdeⅠ和BstBⅠ酶切筛选送交阳性克隆测序鉴定,序引物为:Forward,5′-GAA CCC ACT GCT TAC TGG CTT-3′;Reverse,5′-AGA CCG AGG AGA GGG T-3′。将重组后质粒命名为pAd -ZnT1。
1.2.4重组腺病毒载体的包装与扩增 HEK293A细胞的准备:转染前将处于对数生长期的HEK293A细胞用0.25% 胰蛋白酶消化,含体积分数10%FBS的DMEM完全培养基调整细胞密度为30%~40%,重新接种于25 cm2的细胞培养瓶,37 ℃、体积分数5% CO2培养箱内培养,待细胞密度达60%~70%时即可用于转染。细胞状处于对数生长期及较少的传代次数对于病毒包装至关重要。
重组腺病毒颗粒的形成:用质粒大提试剂盒提取质粒,PacⅠ酶切使其线性化,暴露病毒的ITRs端(inverted terminal repeat sequence,病毒基因组复制所需的重复序列),采用酚/仿异戊醇抽提法提纯质粒DNA,在Lipofectamine 2000转染试剂的介导下转染HEK293A细胞,当有明显的细胞病态反应(CPE)现象,且有大于50%细胞脱壁时即收集细胞。于-80 ℃深低温冰柜中30 min,37 ℃恒温水浴箱中20 min反复冻融3次,室温下1 000 r/min离心3 min,获得重组腺病毒颗粒Ad-ZnT1上清液即为原代病毒液,取部分原代病毒液再次感染HEK293A细胞,获得较高滴度第2代病毒,如此获得高滴度的第3代病毒液。
重组腺病毒的滴度测定:病毒滴度测定采用终点稀释法。检测前24 h在96孔平底培养板内,每孔加入100 μL约含104个HEK293A细胞的悬液(含5% FBS的DMEM),37 ℃,5% CO2培养箱中孵育待用。取第3代腺病毒病毒液10 μL加入含有990 μL DMEM的EP管内作1∶100稀释,浓度即为原病毒液的10-2,以此浓度为起点,作病毒液的1∶10倍比稀释,即成10-3~10-10各种梯度浓度的病毒稀释液。从细胞培养箱中取出96孔板,确定每孔的细胞均生长良好,吸弃旧培养液,然后依次将10-3~10-10稀释的病毒液加入96孔板中,每一稀释度占用一行。每一行前10孔加入100 μL病毒稀释液,第11、12孔均加入100 μL不含病毒的完全培养基作为对照。培养10 d左右,观察CPE现象,并对CPE孔进行计数。计算每一行的阳性率,计算病毒滴度(Spearman-Karber Method):病毒滴度=10(X+0.8)pfu/mL。
1.2.5Western blotting分析重组腺病毒Ad-ZnT1的表达 实验组(Ad-ZnT1)、阴性对照组(Ad-EGFP)用最佳感染复数(MOI=100)感染HEK293A细胞,第3组为正常细胞。48 h后将培养液弃掉,预冷的PBS轻洗3次。收集细胞,通过反复冻融法裂解细胞获取蛋白。紫外分光光度计法测定提取的蛋白浓度。聚丙烯酰胺凝胶电泳法制备蛋白胶(体积分数5%浓缩液,10%分离胶) 电泳,将蛋白胶转移至PVDF膜上。用丽春红染液染色,经5%脱脂奶粉封闭1 h,一抗兔抗鼠ZnT1(稀释比例为1∶500)孵育1 h,TBST中洗涤3次,继续用HRP标记的二抗羊抗兔(稀释比例为1∶5 000)孵育1 h,ECL试剂盒显色,通过观察重组腺病毒目的蛋白表达情况。
2 结 果
2.1含attB位点基因片段合成的鉴定 PCR扩增attB1-ZnT1第1外显子、attB1-ZnT1第2外显子、IRES/EGFP-attB2基因片段(图1),1%琼脂糖凝胶进行电泳,泳道1、2、3分别是PCR扩增第1外显子约0.6 kb,第2外显子约0.9 kb,IRES/EGFP-attB2片段约1.3 kb,重叠延伸PCR后扩增基因片段attB1-ZnT1/IRES/EGFP-attB2 电泳,片段大小约2.8 kb,为前三者之和,证实含有attB特异位点的目的基因片段完成连接,见图2。
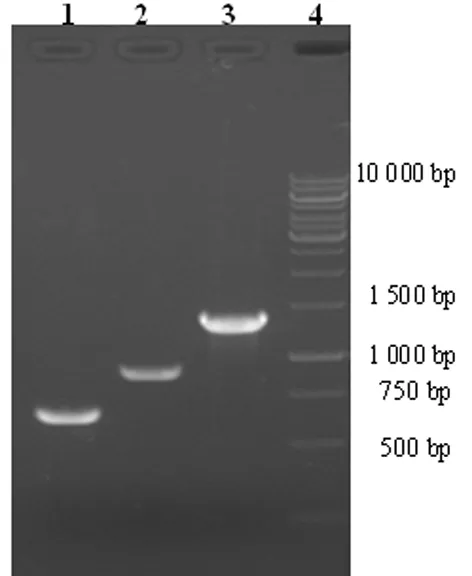
图1 含attB特异位点基因片段的PCR扩增
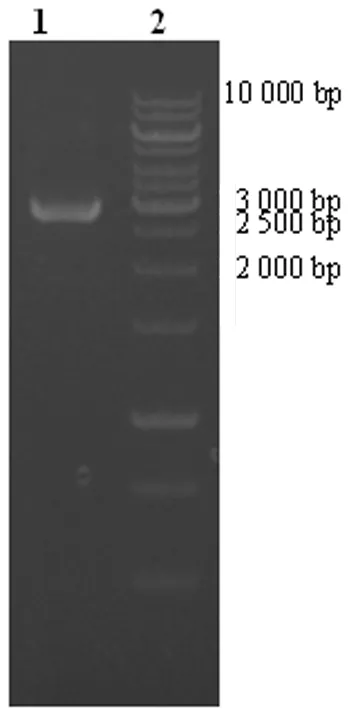
图2 含attB特异位点基因片段的PCR重叠延伸扩增
2.2入门克隆的酶切筛选和测序鉴定 以EcoRⅤ酶切筛选入门克隆pDown-ZnT1,泳道1~3分别是不同克隆后的酶切结果,1%琼脂糖凝胶电泳。泳道3可见有大小约为1.9 kb和 3.3 kb的目的片段,小片段是入门载体pDown骨架部分,这与入门载体骨架大小相符,大片段为含特异位点基因片段部分(图3)。选取泳道3克隆测序鉴定(封2图4),证实目的基因已经克隆至入门载体中。
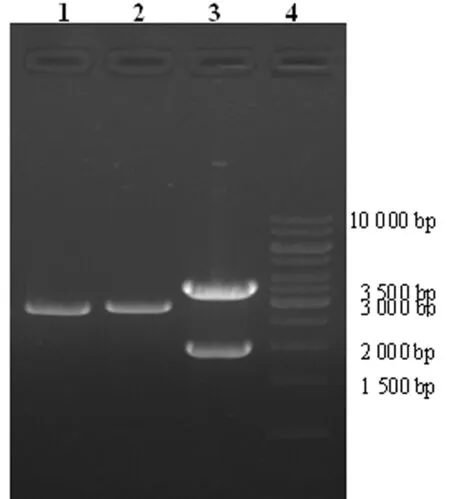
图3 EcoRⅤ酶切筛选阳性入门克隆pDown-ZnT1
2.3重组腺病毒载体的酶切筛选和测序鉴定 重组腺病毒表达载体经NdeⅠ、BstBⅠ双酶切后1%琼脂糖凝胶电泳,可见约3.3 kb处有目的条带的强表达(图5),该条带与入门载体酶切筛选结果基本符合,证实经过LR反应后含有attB特异位点的attB1-ZnT1/IRES/EGFP-attB2基因片段已克隆至表达载体中。送交阳性克隆测序鉴定(封2图6),目的基因ZnT1克隆至表达载体中。

图5 重组腺病毒表达载体经NdeⅠ和BstBⅠ双酶切
2.4重组腺病毒滴度的测定 重组腺病毒pAd-CMV-ZnT1/IRES/EGFP按上述终点稀释实验法测得各排阳性孔的比率(10-3~10-10梯度稀释度)分别为1、1、1、0.9、0.7、0.6、0.2、0,X=1+1+1+1+1+0.9+0.7+0.6+0.2+0=7.4,按照(Spearman-Karber Method)方法:毒滴度(pfu/mL)=10(X+0.8)=10(1+1+1+1+1+0.9+0.7+0.6+0.2+0.8)=1.6×108pfu/mL。同理获得阴性对照腺病毒Ad-ZnT1滴度为2.5×108pfu/mL。
2.5重组腺病毒感染HEK293A细胞的荧光表达 重组腺病毒Ad-ZnT1感染HEK293A细胞后,随着时间的延长,正常的多角形HEK293A细胞皱缩变小,细胞间隙变大,多个细胞聚集呈现葡萄串样改变,荧光显微镜下观察可见明显的荧光,见封2图7。
2.6腺病毒介导的ZnT1基因在HEK293A细胞中的表达 目的基因ZnT1表达蛋白相对分子质量为36×103,实验组(A组)、阴性对照组(B组)感染HEK293A细胞后48 h,Western blotting结果显示A组出现ZnT1特异条带(图8),阴性B组及正常细胞组均未出现特异条带。证实重组腺病毒Ad-ZnT1可高效感染293A细胞,并有目的基因ZnT1的强表达。
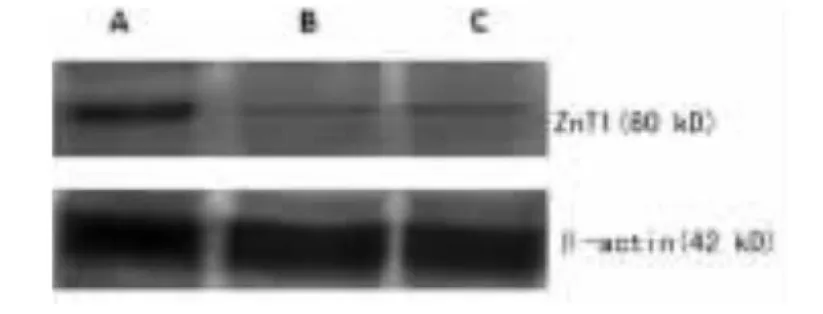
图8 Western blotting分析目的基因ZnT1蛋白的表达
3 讨 论
目前,基因治疗中常用的生物病毒载体有重组逆转录病毒载体、重组慢病毒载体及重组腺病毒载体,其中重组腺病毒载体具有宿主范围广,外源性基因插入容量大,病毒滴度高,不整合于宿主基因组,包装相对容易,能够大量扩增及构建成本低等优点,腺病毒能感染几乎所有的细胞类型,除了一些抗腺病毒感染的淋巴瘤细胞[11-12],这对于研究目的基因在神经细胞中的表达很有意义。
目前,大多采用Adeasy系统来构建重组腺病毒载体,该系统在设计引物时,添加了实验所需的酶切位点并在位点前加保护碱基,先将目的基因和穿梭载体分别进行双酶切鉴定,再由连接酶进行连接、转化、筛选穿梭载体,酶切线性化后和病毒骨架Adeasy在大肠埃希菌BJl83感受态细胞中同源重组,挑选阳性克隆,酶切及测序鉴定后在293细胞中包装,整个过程需要多次酶切,连接和转化筛选并且重组阳性率很低,耗时长、工作繁琐。
本实验采用GatewayTM技术构建ZnT1腺病毒表达载体,在此技术中起到重组作用的位点有attB、attP、attL、attR。实验中将含有attB位点的基因片段与attP位点的供体载体pDonr221在BP ClonaseⅡ高效酶催化下生成带有attL位点的入门载体pDown-ZnT1。入门载体再与带有attR位点的目的载体Ad/CMV/V5-DEST在LR ClonaseⅡ高效酶催化下生成表达载体pAd-ZnT1[13]。构建过程基于上述位点特异重组不再需要限制性内切酶和连接酶的参与,同时DNA片段的阅读框和方向保持不变,这种新的表达更便利、省时。本实验构建ZnT1不是用来直接进行基因治疗,而是通过目的基因在真核细胞中表达上调,检测BDNF及其受体TrkB的表达情况,为SCI寻找内部自身保护性因子,从而为SCI的修复及轴突再生提供理论依据。
[1]Ng P,Cummings DT,Evelegh CM,et al.The yeast yeast recombinase FLP functions effectively in human cells for construction of adenovirus vectors[J].Bio Techniques,2000,29(3):524-526,528.
[2]Wang Y,Mei X,Zhang L,et al.The correlation among the dynamic change of Zn(2+),ZnT-1,and brain-derived neurotrophic factor after acute spinal cord injury in rats[J].Biol Trace Elem Res,2011,143(1):351-358.
[3]Ramer MS,Priestley JV,Mc Mahon SB.
Functional regeneration of sensory axons into the adult spinal cord[J].Nature,2000,403(6767):312-316.
[4]Vavrek R,Girgis J,Tetzlaff W,et al.BDNF promotes connections of corticospinal neurons onto spared descending interneurons in spinal cord injured rats[J].Brain,2006,129(6):1534-1545.
[5]Sasaki M,Radtke C,Tan AM,et al.BDNF-hypersecreting human mesenchymal stem cells promote functional recovery,axonal sprouting,and protection of corticospinal neurons after spinal cord injury[J].J Neurosci,2009,29(47):14932-14941.
[6]liu C,Mei XF,Lv G,et al.Neuron-like differentiation of adult rat bone marrow stromal cells induced by transforming growth factor-beta and brain-derived neurotrophic factor[J].Neural Regeneration Res,2009,4(4):247-251.
[7]Sharma HS.Selected combination of neurotrophins potentiate neuroprotection and functional recovery following spinal cord injury in the rat[J].Acta Neurochir Suppl,2010,106:295-300.
[8]Bushman W,Thompson JF,Vargas L,et al.Control of directionality in lambda site specific recombination[J].Science,1985,230(4278):906-911.
[9]Landy A.Dynamic,structural,and regulatory aspects of lambda site-specific recombination[J].Annu Rev Biochem,1989,58:913-949.
[10]阙文忠,陈君敏.利用Gateway技术构建重组腺病毒pAd-NK4[J].中国药理学通报,2011,27(4):462-466.
[11]Metzen E.Enzyme substrate recognition in oxygen sensing:how the HIF trap snaps[J].Biochem J,2007,408(2):e5-6.
[12]Poellinger L,Johnson RS.HIF-l and hypoxic response:the plot thickens[J].Curr Opin Genet Dev,2004,14(1):81-85.
[13]蒋红梅,龙洁,汤炜,等.采用GatewayTM技术构建人骨形态发生蛋白-2基因重组腺病毒载体[J].现代生物医学进展,2008,8(2):209-212.
