TGF-β1对白血病KG-1细胞株Gli1表达的影响
2012-01-08李哲,潘静
李 哲,潘 静
(辽宁医学院附属第一医院血液科,辽宁锦州 121000)
Hedgehog(HH)信号通路在组织的损伤与修复中可以促使正常干细胞自我更新,因其过度激活可诱使正常干细胞向肿瘤干细胞转化,并最终导致肿瘤的发生[1],近年来备受关注。最近的研究认为,HH信号通路是白血病干细胞所需的功能性通路,这一通路的失活将阻碍白血病的进展[2]。
Gli是HH信号通路的最后效应阶段,一直以来 Gli 都作为 HH 通路的下游基因参与肿瘤发生。最近关于Gli非经典激活机制的研究表明,Gli 分子可能是几种信号通路所共同整合交织的平台,多种机制可以调控Gli的活性[3]。最近研究表明,在正常成纤维细胞和角质形成细胞以及多种肿瘤细胞系,Gli不仅受HH/Smo信号的调控,也受其他途径的调控,比如TGF-β信号转导通路,这种调控是独立于Ptch/Smo途径的[4]。TGF-β作为非常重要的肿瘤抑制因子,对多种恶性肿瘤细胞的增生有明显的抑制作用。James等[5]研究证实,TGF-β对白血病细胞的增生具有抑制作用,可以诱导白血病细胞分化成熟,而在急性白血病患者中TGF-β水平降低,促使肿瘤细胞过度增生,对急性白血病的发生起促进作用。
为了寻找白血病治疗的新的靶点,笔者假设在白血病中同样存在有TGF-β信号通路对Gli的调控,进行了TGF-β1对KG-1细胞Gli1表达影响的研究,现报道如下。
1 材料与方法
1.1材料 KG-1细胞由中国医学科学院血液研究所惠赠。细胞培养应用20%胎牛血清的IMDM培养基,培养环境为5% CO2、37 ℃恒温培养箱中培养。
1.2仪器与试剂 重组人细胞因子TGF-β1(Pepro Tech);SIS3(Merck Company);PCR引物合成(大连宝生物公司);RT-PCR试剂盒(杭州博日科技有限公司);Real Time RT-PCR试剂盒(TaKaRa Japan);Rotor-Gene 6000实时定量PCR仪(德国Qiagen公司);凝胶成像系统(美国Syngene公司)。
1.3方法
1.3.1Real Time PCR检测KG-1细胞Gli1 mRNA的表达 cDNA合成:所培养的KG-1细胞总RNA的提取按照Trizol Reagent说明书进行操作,按逆转录试剂盒(Promega公司)说明书进行逆转录合成cDNA。反应体系如下:5×RT缓冲液2 μL,dNTP Mixture(10 mmol)1 μL,Random Hexamer Primer 0.5 μL,RNase inhibitor(40 U/μL) 0.5 μL,AMV Reverse Transcriptase 0.5 μL,实验样品RNA 1 μL,RNase Free H2O 4.5 μL,于25 ℃静置10 min,45 ℃ 45 min,95 ℃ 5 min,4 ℃ 5 min。
Real Time PCR反应体系及反应参数:采用SYBR Prem ix Ex TaqTMKit(TaKaRa公司)进行定量PCR,反应体系如下:SYBR Primx Ex Taq12.5 μL,PCR Forward Primer(10 μmol)0.5 μL,PCR Reverse Primer(10 μmol)0.5 μL,cDNA 2 μL,dH2O 9.5 μL,总体积25 μL。反应条件如下:95 ℃ 1 min预变性1次,95 ℃ 10 s,60 ℃ 30 s,循环反应40次。待测样品每管重复3次。在Rotor-Gene 6000实时定量PCR仪(德国QIAGEN公司)上进行。PCR引物的序列,Gli1(sense 5′-CCC AAT CAC AAG TCA GGT TCC T-3′,antisense 5′-CCT ATG TGA AGC CCT ATT TGC C-3′),ABL(sense 5′-CGA GAG CCT GGC CTA CAA CAA-3′,antisense 5′-CTA GCA GCT CAT ACA CCT GGG ACA-3′)。采用Comparative Delta-delta Ct法计算Gli1的表达。
1.3.2PCR反应判定KG-1细胞是否表达Ptch和Smo 提取KG-1细胞的mRNA进行反转录,并应用Ptch和Smo的引物进行扩增,PCR引物的序列,Ptch(sense 5′-CTG TTG GCA TAG GAG TGG AGT TCA CC-3′,antisense 5′-CTG CTG GGC CTC GTA GTG CCG AAG C-3′),Smo(sense 5′-CAG AAC ATC AAG TTC AAC AGT TCA GGC-3′,antisense 5′-ATA GGT GAG GAC CAC AAA CCA AAC CAC ACC-3′),反应体系如下:10×PCR缓冲液(含Mg2+)2.5 μL,dNTP Mixture(10 mmol)0.5 μL,上游特异性引物(5 μmol)0.5 μL,下游特异性引物(5 μmol)0.5 μL,Taq mix DNA polymerase 0.5 μL,RT产物2.5 μL,ddH2O 18 μL,总体积25 μL。PCR反应条件:94 ℃ 3 min;94 ℃ 30 s,58 ℃ 30 s,72 ℃ 60 s,35循环;72 ℃ 5 min。反应结束后,取10 μL产物进行琼脂糖凝胶电泳。电泳条件:电流160 mA,电泳25 min后,并通过凝胶图像分析仪观察是否有相应的PCR产物。
1.4统计学处理 采用SPSS13.0软件进行分析,组间比较用单因素方差分析,多个样本的均数比较用LSD方法。以P<0.05为差异有统计学意义。
2 结 果
2.1TGF-β1对KG-1细胞Gli1表达的影响 0.1 ng/mL TGF-β1作用于KG-1细胞6、12、24 h后,Real Time-PCR结果显示KG-1细胞的Gli1表达与对照组相比没有明显变化;而1 ng/mL TGF-β1和10 ng/mL TGF-β1分别作用于KG-1细胞6、12、24 h后,Real Time-PCR结果显示,KG-1细胞的Gli1表达与对照组相比,明显低于对照组;而且随作用时间的延长,作用更加明显;1 ng/mL TGF-β1和10 ng/mL TGF-β1对KG-1细胞Gli1表达的影响没有明显差异,因此,后续实验应用两组间近似平均浓度5 ng/mL TGF-β1作用于KG-1细胞,见图1。
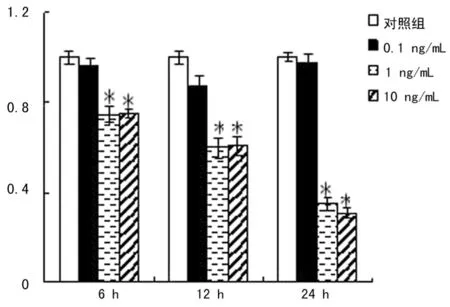
*:与对照组相比,P<0.05。
图1不同浓度TGF-β1作用于KG-1细胞后不同时间Gli1的mRNA表达变化
2.2TGF-β1、SIS3对KG-1细胞Gli1表达影响 因1~10 ng/mL TGF-β1作用于KG-1细胞后可引起Gli1的表达减少,且1 ng/mL TGF-β1组和10 ng/mL TGF-β1组之间没有明显差异,故应用其近似平均值5 ng/mL TGF-β1作用于KG-1细胞,Real Time-PCR结果显示,5 ng/mL TGF-β1作用于KG-1细胞24 h,Gli1 的mRNA及蛋白表达较对照组明显降低;Western blotting结果显示,5 ng/mL TGF-β1联合5 μmol SIS3作用于KG-1细胞24 h后,其Gli1的mRNA及蛋白表达较对照组明显增高,见图2。
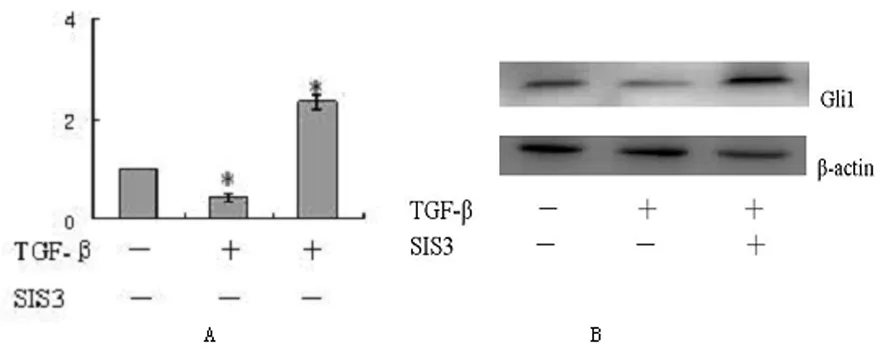
A:TGF-β1组Gli1 mRNA表达较对照组降低;TGF-β1联合SIS3组Gli1 mRNA表达较对照组明显增高。*:P<0.05,与空白对照组相比。B:TGF-β1组Gli1蛋白表达较对照组降低;TGF-β1联合SIS3组Gli1的蛋白表达较对照组增高。
图2 TGF-β1、SIS3对KG-1细胞Gli1 mRNA和蛋白表达的影响
2.3PCR反应判定KG-1细胞是否表达Ptch和Smo 见图3。

图3 KG-1细胞与对照组的白血病患者相比较,均没有Ptch和Smo基因的表达
3 讨 论
HH基因的作用涉及细胞的增生分化和组织发育。众多研究表明该通路与包括白血病在内的多种肿瘤性疾病相关,因此,抑制该通路有可能成为肿瘤预防和治疗的新靶点。HH信号分子首先作用于受体蛋白Ptch家族,并激活Smo,进而促使 Gli转变成催化剂形式,进入细胞核启动下游基因转录。Gli包括3个同源基因,Gli1、Gli2、Gli3,其中Gli1起激活作用[6]。Gli分子本身与肿瘤细胞的发生、发展并没有直接关系,但直接调控肿瘤细胞增殖、分化、转移的分子基因转录水平则受到HH信号通路调控,可能是该通路导致肿瘤的关键因素。
在造血系统中,HH的家庭成员在体外和体内的干或(祖)细胞扩增中起重要的调节作用。在一些白血病细胞系中对HH信号的成分进行检测,如Ptch和Smo可在Jurkat细胞中表达[7],Gli1可在HL-60细胞和KG-1细胞中表达,Gli2在KG-1细胞和HL-60细胞中表达[8]。类似于HH信号通路,TGF-β在炎症、组织修复、血管生成和调节细胞生长和分化等复杂过程中发挥了重要作用,其中TGF-β1生物活性最为强,在造血调控方面起重要作用[9]。
虽然有许多的研究表明,HH通路的异常活化在许多恶性肿瘤里存在,但在结肠癌细胞系的研究却发现很多HH通路的关键分子并没有检测到表达,表明在结肠癌细胞系中没有HH通路普遍激活[10]。这表明HH通路所激活的一些靶基因可能同样被其他通路所调控。最近的研究表明,TGF-β通路可以调控Gli的功能[11],也就是说存在由TGF-β通路调控的HH信号传导通路的非经典调控途径。为了证明在白血病中同样存在由TGF-β通路介导的HH通路的调控,笔者进行了目前的研究。
本研究选取的KG-1细胞株属于急性髓系白血病细胞,有研究表明在这种白血病细胞上存在HH信号转导通路中Ptch和Smo分子的缺失,而Gli则有表达[12]。对于这类细胞传统的阻断HH通路的做法将不起作用,但是因为存在Gli的表达,因此,阻断Gli的表达将可能成为治疗急性白血病的方法之一。对于阻断Gli的表达,特异性的siRNA可以起作用,但是对于白血病细胞,siRNA干扰往往比较困难。本研究应用TGF-β1成功地减少了KG-1细胞Gli1的表达。本研究结果显示,1~10 ng/mL TGF-β1作用于KG-1细胞后的24 h内,Gli1的表达较对照组明显减少,且较少程度随作用时间的延长而显著,但是1 ng/mL TGF-β1组和10 ng/mL TGF-β1组之间没有明显差异。分析TGF-β1降低KG-1细胞的Gli1表达的机制,TGF-β1下游的信号是Smad2和Smad3。对于成人,Smad3是TGF-β1最主要依赖的下游信号,而Smad2则在胚胎发育形成时发挥关键作用[13]。因此,本研究应用SIS3[14],一种特异性的Smad3的阻断剂,来阻断TGF-β1的作用并观察效果,结果表明SIS3可以有效阻断TGF-β1引起的Gli1的表达降低。因为KG-1细胞不表达Ptch和Smo[12],这一点在本研究中已经验证,所以TGF-β1降低KG-1细胞Gli1的表达,是不依赖于Ptch/Smo这一途径的,而是依赖于Smad3途径的。
综上所述,本研究应用TGF-β1可以降低KG-1细胞的Gli1的表达,其作用机制不依赖于Ptch/Smo这一途径的,而是依赖于Smad3途径的;提示可以应用TGF-β1,并通过Smad3途径调控Gli1基因,作用于其下游与细胞增殖分化有关的基因,进而对白血病起到治疗的作用。
[1]Liu H,Gu D,Xie J.Clinical implications of hedgehog signaling pathway inhibitors[J].Chin J Cancer,2011,30(1):13-26.
[2]Long B,Zhu H,Zhu C,et al.Activation of the Hedgehog pathway in chronic myelogeneous leukemia patients[J].J Exp Clin Cancer Res,2011,30:8-12.
[3]Seong KH,Akimaru H,Dai P,et al.Inhibition of the nuclear import of cubitus interruptus by roadkill in the presence of strong hedgehog signal[J].PLoS One,2010,5(12):e15365.
[4]Dennler S,André J,Alexaki I,et al.Induction of sonic hedgehog mediators by transforming growth factor-beta:Smad3-dependent activation of Gli2 and Gli1 expression in vitro and in vivo[J].Cancer Res,2007,67(14):6981-6986.
[5]Downing JR.TGF-beta signaling:Tumor suppression and acute lymphoblastic leukemia[J].N Eng J Med,2004,351(6):528-530.
[6]Stamataki D,Ulloa F,Tsoni SV,et al.A gradient of Gli activity mediates graded Sonic Hedgehog signaling in the neural tube[J].Genes Dev,2005,19(5):626-641.
[7]Detmer K,Walker AN,Jenkins TM,et al.Erythroid differentiation in vitro is blocked by cyclopamine,an inhibitor of hedgehog signaling[J].Blood Cells Mol Dis,2000,26(4):360-372.
[8]Kobune M,Takimoto R,Murase K,et al.Drug resistance is dramatically restored by hedgehog inhibitors in CD34+ leukemic cells[J].Cancer Sci,2009,100(5):948-955.
[9]Wu KF,Zhu YM,Rao Q,et al.Expression of transforming growth factor-beta,tumor necrosis factor-alpha,and leukemia inhibitory factor mRNAs in rodent and human hematopoietic cells[J].Ann N Y Acad Sci,1991,628:151-152.
[10]Chatel G,Ganeff C,Boussif N,et al.Hedgehog signaling pathway is inactive in colorectal cancer cell lines[J].Int J Cancer,2007,121(12):2622-2627.
[11]Fernández-Zapico ME.Primers on molecular pathways GLI:more than just hedgehog[J].Pancreatology,2008,8(3):227-229.
[12]Kobune M,Takimoto R,Murase K,et al.Drug resistance is dramatically restored by hedgehog inhibitors in CD34+ leukemic cells[J].Cancer Sci,2009,100(5):948-955.
[13]Massagué J,Seoane J,Wotton D.Smad transcription factors[J].Genes Dev,2005,19(23):2783-2810.
[14]Jinnin M,Ihn H,Tamaki K.Characterization of SIS3,a novel specific inhibitor of Smad3,and its effect on transforming growth factor-beta1-induced extracellular matrix expression[J].Mol Pharmacol,2006,69(2):597-607.
