谷氨酰胺对内毒素血症新生幼鼠肠道功能保护作用的研究
2012-01-08苗士建
苗士建 张 烨 黄 瑛 陈 莲
谷氨酰胺(Gln)是人体内含量最丰富的氨基酸,占总游离氨基酸的50%[1],通常情况下Gln较易合成,并且储存在骨骼肌中,同时肝脏、肺和脑也可制造较少量Gln[2]。但在器官或组织需求过度的情况下,如败血症或其他分解代谢应激等条件下,机体对Gln利用增加,血中Gln水平明显下降,不足以满足肠道、免疫系统、肝脏和肾脏等需求的增加,因此需补充外源性Gln[3]。新生儿尤其是危重症新生儿,在出生后数周内很难达到全肠道喂养,在目前常规使用的静脉营养液中也缺乏Gln。动物研究显示,在Gln丧失的情况下,可致大鼠肠黏膜明显破坏[4]。多项研究证明补充Gln可显著降低感染性疾病的发生率,改善营养状况和重要器官的功能[5~11]。
本课题组前期研究[12]发现,Gln对受到脂多糖(LPS)刺激的肠道Caco-2细胞具有显著保护作用,本研究拟从动物水平对Gln的保护作用进一步研究,建立内毒素血症新生幼鼠模型,观察Gln干预后幼鼠肠上皮细胞膜完整及流动性情况,肠上皮绒毛和微绒毛结构的改变情况,初步探讨Gln对内毒素血症幼鼠肠道功能的保护作用,为危重病患儿的营养支持提供更多理论依据。
1 方法
1.1 实验动物 清洁级SD大鼠母鼠及其新生幼鼠共4窝,进入实验每窝幼鼠(10±2)只,体重(6.20±0.17)g。复旦大学医学院实验动物中心提供。
1.2 试剂 ①蛋氨酸亚砜胺(MS)(美国Sigma公司),使用无菌注射用水配成25 g·L-1母液,4℃保存。②腹腔注射用Gln(商品名:麦滋林-S,含L-Gln 663.3 mg·670 mg-1,日本寿制药株式会社),使用无菌注射用水配成100 g·L-1母液,常温下保存。③LPS(EcoliO55∶B5,美国Sigma公司),使用无菌注射用水配成0.5 g·L-1母液,4℃保存。④ELISA试剂盒:大鼠IL-1β、大鼠趋化性细胞因子(MCP-1,Biosource公司),大鼠TNF-α(R&D公司)。⑤Gln标准品(G3202,CAS 327-57-1,美国Sigma公司)使用去离子水配成1 mmol·L-1标准品溶液,然后稀释成50、100、150、200、300、600和1 000 μmol·L-1系列溶液,4℃保存。
1.3 内毒素血症幼鼠模型的建立和干预方法 自然分娩母鼠及其幼鼠均在清洁动物实验室饲养3 d,母鼠正常饲养,幼鼠母乳喂养,每1窝为一组,随机分为:①MS+NS组:母鼠和幼鼠给予MS +幼鼠给予NS;②MS+Gln组:母鼠和幼鼠给予MS+幼鼠给予Gln;③正常喂养+Gln组:幼鼠正常母乳喂养(母鼠和幼鼠均不给予MS)+幼鼠给予Gln;④正常喂养+NS组:幼鼠正常母乳喂养(母鼠和幼鼠均不给予MS)+幼鼠给予NS。各组均在母鼠分娩第3天和幼鼠出生第3天起开始干预,均连续给予6 d。MS,Gln和NS均采用腹腔注射,注射剂量分别为MS 100 mg·kg-1·d-1,Gln 10 mL·kg-1·d-1,NS 10 mL·kg-1·d-1。各组幼鼠均于实验第7天(即生后第10天)腹腔注射LPS 10 mL·kg-1。
1.4 样本制备 腹腔注射LPS后6 h颈椎脱臼法处死幼鼠,心脏采血法采血0.3~0.5 mL。游离肠道,取距回盲部约12 cm处近端长约10 cm的完整小肠组织,冰NS灌注并清除小肠内容物后,沿系膜纵行剪开。在新鲜小肠标本上沿肠系膜缘及对侧缘纵向取长约1.5 cm、宽约0.5 cm肠壁组织,备用行光镜和电镜观察。刮取标本剩余肠黏膜50~100 mg,制成匀浆液备用,以测定细胞因子表达水平。
1.5 观察指标
1.5.1 体重增加量 采用TCS-500型电子称(武汉电子称重仪器公司)对幼鼠每天称重,计算实验第1天(干预前)和第7天处死前的体重增加量,体重精确至0.01 g。
1.5.2 血浆Gln浓度 新生幼鼠血液离心取血浆,采用安捷伦1100液相色谱仪 (美国安捷伦科技有限公司)测定Gln浓度。荧光激发波长为340 nm,发射波长为450 nm,紫外检测波长为338 nm。
1.5.3 肠上皮细胞细胞膜流动性水平[13]制备肠上皮细胞细胞膜悬液[14],加入等体积DPH 探针,采用Schimadzu RF2600型荧光分光光度计(日本岛津公司)测定荧光偏振度(Pr) 。激发波长为362 nm,发射波长为432 nm,狭缝宽度为5 nm。
1.5.4 肠黏膜组织匀浆液细胞因子水平 肠黏膜组织匀浆液在冰壶上离心,取上清于-70℃保存。按ELISA试剂盒说明书进行各组肠黏膜的MCP-1、TNF-α和IL-1β水平测定。
1.5.5 肠黏膜组织光镜和电镜观察 每只幼鼠均取新鲜肠壁组织2块,切片行苏木精-伊红染色,在复旦大学附属儿科医院病理科专业人员指导下行光镜观察肠黏膜损伤情况;同时各取2块新鲜肠壁组织分别进行透射电镜(日立S-520型)和扫描电镜(飞利浦CM-120),在复旦大学上海医学院电镜室专业人员指导下观察肠黏膜绒毛和微绒毛的完整度。
2 结果
2.1 死亡率 MS+Gln组、MS+NS组、正常喂养+Gln组和正常喂养+NS组出生幼鼠分别为11、11、10和11只,MS+Gln组和MS+NS组在实验结束前分别死亡2(18.2%)和6只(54.5%)。
2.2 体重增加量 表2显示,组间总体比较差异有统计学意义(P=0.000)。两两比较显示,除正常喂养+Gln组和正常喂养+NS组间差异无统计学意义(P=0.084),余各组间差异均有统计学意义(均P<0.05)。
2.3 血浆Gln浓度 表2显示,组间总体比较差异有统计学意义(P=0.000)。两两比较显示,除正常喂养+Gln组和正常喂养+NS组间差异无统计学意义(P=0.066),余各组间差异均有统计学意义(均P<0.05)。
2.4 肠上皮细胞细胞膜流动性 表1显示,组间荧光偏振度总体比较差异有统计学意义(P=0.014)。两两比较显示,除正常喂养+Gln组和正常喂养+NS组间差异无统计学意义外(P=0.073),余各组间差异均有统计学意义(均P<0.05)。
2.5 肠黏膜组织匀浆液细胞因子水平 表1显示,组间MCP-1、TNF-α和IL-1β总体比较差异均有统计学意义(P分别为0.015、0.011和0.003)。两两比较显示,MCP-1、TNF-α和IL-1β水平除正常喂养+Gln组和正常喂养+NS组间差异无统计学意义外(P分别为0.063、0.079和0.052),余各组间差异均有统计学意义(均P<0.05)。
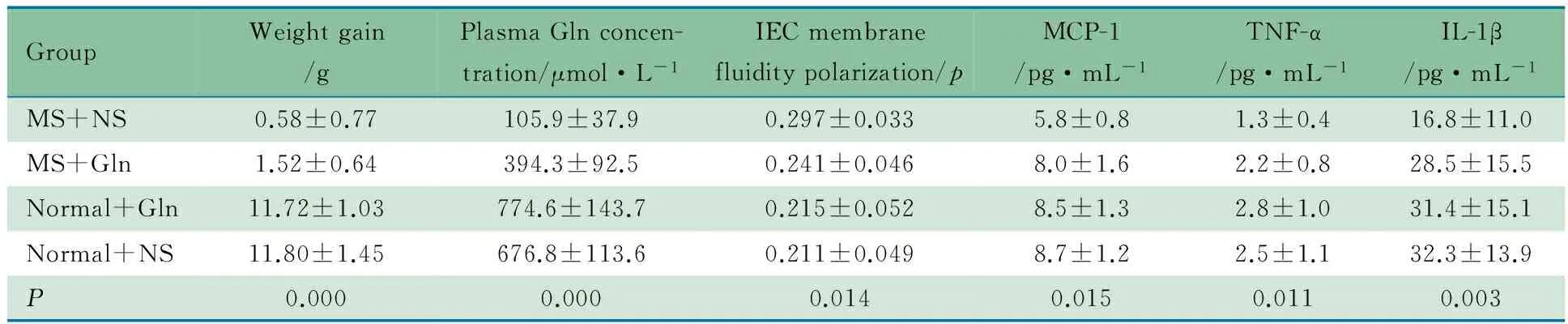
表1 各组幼鼠体重增加量、血浆Gln浓度、细胞膜流动性和细胞因子水平比较
Notes Overall, the between-group differences in weight gain, plasma Gln concentration, IEC membrane fluorescence polarization and IL-1βexpression of baby rats were significantly different (P<0.05). There was no statistical difference among normal+Gln group and normal +NS group (P>0.05); but among the other groups, there was statistical difference
2.6 肠黏膜病理学改变
2.6.1 光镜观察 MS+NS组可见绒毛变短小,排列极其紊乱,有明显的断裂脱落(图1A);MS+Gln组肠黏膜绒毛有不同程度的变短,排列杂乱,黏膜结构有不同程度破坏,但较MS+NS组损伤程度轻,亦有观察到低水平的绒毛修复(图1B);正常喂养+Gln组及正常喂养+NS组肠绒毛均有不同程度的排列紊乱和变短,但较MS+NS组损伤程度轻(图1C,D)。
2.6.2 透射电镜 MS+NS组可见肠微绒毛排列极其杂乱,长度缩短,断裂明显,且肠上皮细胞绒毛膜欠完整,细胞内线粒体肿胀和破裂明显(图2A);MS+Gln组亦可见微绒毛排列杂乱,长度缩短,部分有断裂,肠上皮细胞内线粒体明显肿胀(图2B);正常喂养+Gln组及正常喂养+NS组肠微绒毛长度、宽度正常均一,排列较整齐,少见断裂,肠上皮细胞膜相对完整,无明显线粒体肿胀(图2C,D)。
2.6.3 扫描电镜 MS+NS组可见肠黏膜表面绒毛断裂缺损,脱落明显,绒毛顶端微绒毛严重剥脱(图3A);MS+Gln组肠黏膜绒毛断裂缺损,绒毛顶端微绒毛有一定程度的剥脱(图3B);正常喂养+Gln组及正常喂养+NS组肠黏膜表面绒毛轻度断裂,无明显脱落,绒毛顶端微绒毛尚完整(图3C,D)。

图1 各组幼鼠肠黏膜光镜下观察结果(苏木精-伊红染色, ×20)
Fig 1 Findings under light microscopy(HE staining, ×20)
Notes A: MS+NS group, the intestinal structure was not intact, small intestine villi were the shortest and badly destroyed under optical microscopy; B: MS+Gln group, the intestinal structure was also not intact, small intestine villi were short and destroyed, but some of them were restored; Normal+Gln (C) and Normal+NS (D) group, small intestine villi were slightly destroyed

图2 各组幼鼠肠黏膜透射电镜观察(×10 000)
Fig 2 Findings under transmission electron microscopy(×10 000)
Notes A: MS+NS group, small intestine microvilli were the shortest, badly abrupt and disorderly arranged, the membranes were destroyed and mitochondrion were obviously ruptured; B: MS+Gln group, small intestine microvilli were shorter and disorderly arranged, the membranes were destroyed and mitochondrion were obviously swollen; Normal+Gln (C) and Normal+NS (D) group, small intestine microvilli were normally arranged and not obviously ruptured, the membranes were not destroyed

图3 各组幼鼠肠黏膜扫描电镜观察(×10 000)
Fig 3 Findings under scanning electron microscopy(×10 000)
Notes A: MS+NS group, small intestine microvilli were the shortest, badly abrupt and disorderly arranged, the membranes were destroyed and mitochondria were obviously ruptured; B: MS+Gln group, small intestine microvilli were shorter and disorderly arranged, the membranes were destroyed and mitochondria were obviously swollen; normal+Gln (C) and normal+NS (D) group, small intestine microvilli were normally arranged and not obviously ruptured, the membranes were not destroyed
3 讨论
本研究给予LPS注射后幼鼠肠黏膜组织发生明显改变,肠黏膜细胞因子水平增加,光镜下可见肠绒毛均有排列紊乱和变短变窄,同时电镜亦观察到肠上皮细胞线粒体肿胀,空泡样改变明显,微绒毛排列不整、断裂等明显损伤,证明LPS对肠黏膜的损伤和内毒素血症模型的成功建立。有研究[15,16]在Gln对内毒素血症幼鼠肠黏膜损伤的保护作用的研究中,构建的内毒素血症幼鼠肠黏膜同样表现为炎症损伤,形态结构及功能受损,与本研究一致。本课题组预实验于实验第1天给予幼鼠LPS,但各组幼鼠死亡率均较高,且同时给予MS幼鼠死亡率更高,无法完成实验。考虑到新生幼鼠出生1周内生存能力较差,结合前期研究结果,本研究于实验第7天给予LPS。
目前国外研究Gln缺乏的动物模型主要采用Li等[16]建立的“pup-in-the-cup”大鼠模型,国内研究也多采用类似管饲法建模[17~19]。该模型将新生鼠脱离母鼠喂养,胃造瘘后管饲,通过管饲低Gln或不含Gln的代乳品饮食,造成Gln浓度变化,从而观察Gln能否减轻LPS诱导的新生大鼠肠道的炎症反应。本课题组前期研究发现采用“pup-in-the-cup”模型经人工胃造瘘后管饲的方法喂养,喂养及实验操作过程较复杂,实施有一定难度,且胃造瘘对大鼠机体创伤较大,对实验数据有一定影响。故本研究给予母鼠及幼鼠腹腔内注射MS,结果显示MS+NS组血浆Gln浓度明显下降,提示MS能抑制Gln合成酶,导致体内Gln合成障碍,在给予MS抑制且不给予母乳喂养的情况下,幼鼠的内源性和外源性来源的Gln同时受到抑制,造成Gln缺乏。给予MS抑制的两组幼鼠血浆Gln浓度均显著低于正常母乳喂养的两组,提示在内源性来源受到抑制时,幼鼠主要依赖从母乳中摄取外源性Gln,虽然产后母鼠的乳汁无法直接获取以检测Gln浓度,文献中亦未检索到有关母鼠乳汁Gln浓度的研究,但根据本研究中给予母乳喂养的两组幼鼠血浆Gln浓度明显高于给予MS的两组,推测给予母鼠MS会影响乳汁中Gln浓度。本研究建立的模型为幼鼠处于自然的母鼠喂养条件下,在操作上更加方便可行,且实验结果同样验证造模成功,有利于今后在此基础上进行Gln的相关研究。
本研究采用不同的干预方法造成幼鼠不同程度的Gln缺乏,MS+NS组作为Gln完全缺乏组,幼鼠体重增加缓慢,死亡率较高,添加Gln后(MS+Gln组)则体重有明显增加,死亡率下降,而正常母乳喂养(不给予MS)的两组幼鼠无论是否给予Gln体重增加均满意,无死亡,可见Gln是多种组织细胞的能量来源之一和生命物质合成的前体,对幼鼠的正常生长发育非常必要[2,3]。国内外对Gln的研究[4,19]均显示,采用无Gln或低Gln喂养后,幼鼠出现不同程度的发育迟缓、落后,生存能力下降,死亡率上升。
荧光偏振度测定细胞膜流动性的变化,可用以判断黏膜细胞的损伤程度。MS+NS组肠上皮细胞膜流动性最差,添加Gln后(MS+Gln组)好转,考虑Gln作为谷胱苷肽前体,可通过促进其合成来减轻肠上皮细胞膜的氧自由基损害[20]。Humbert等[21]研究显示,Gln对保持上皮细胞膜稳定性极其重要。
内毒素血症情况下,肠黏膜炎症细胞因子水平可发生明显改变。本研究结果显示,MS+NS组肠黏膜炎症细胞因子水平明显低于MS+Glu组,提示Gln能够调节内源性细胞因子、炎症介质的产生[22]。在感染等炎症刺激时,由于这些细胞因子存在紊乱,肠道容易出现免疫紊乱而造成抵抗病原微生物能力降低[23]。但正常喂养+Gln组和正常喂养+MS组中肠黏膜炎症细胞因子水平相当,提示幼鼠在Gln生理需求量足够的情况下,额外补充Gln并不能增强肠道抵御感染的能力。
MS+NS组光镜及电镜下观察肠黏膜形态可见肠黏膜发生明显改变,肠道绒毛变短,排列有杂乱,微绒毛超微结构有改变;MS+Gln组较MS+NS组损伤程度轻,绒毛及微绒毛出现一定程度的修复。提示补充Gln可增强肠黏膜修复能力,减少上皮细胞的凋亡损伤[24],阻止肠黏膜萎缩,从而能一定程度上保持肠黏膜形态和肠功能的完整。Potsic等[4]在光镜和电镜下观察饮食中Gln对人工饲养幼鼠的胃肠道黏膜形态的影响,结果显示去Gln饮食可导致胃肠道功能紊乱,而Gln合成抑制物MS可加重紊乱情况,提示Gln对保持胃肠道上皮细胞完整性至关重要。李军等[15]研究显示,给予LPS幼鼠肠上皮细胞内线粒体肿胀,呈空泡样改变,微绒毛排列不整,部分紧密连接增宽,细胞核浓缩,添加Gln后显示肠上皮细胞线粒体及绒毛损伤有明显改善。
综上,Gln缺乏可造成新生幼鼠肠黏膜形态结构和功能改变,补充Gln可保护内毒素血症新生幼鼠的肠道形态结构和功能。
[1]Bulus N, Cersosimo E, Ghishan F, et al. Physiologic importance of glutamine. Metabolism, 1989, 38 (S1) : 1-5
[2]Young V, Ajami A. Glutamine: the emperor or his clothes? J Nutr, 2001, 131(9S):2449-2459
[3]Neu J, Auestad N, DeMarco VG. Glutamine metabolism in the fetus and critically ill low birth weight neonate. Adv Pediatr, 2002,49:203-226
[4]Potsic B, Holliday N, Lewis P, et al. Glutamine supplement-ation and deprivation: effect on artificially reared rat small intestinal morphology. Pediatr Res, 2002, 52(3):430-436
[5]Griffiths RD, Jones C, Palmer TE. Six-month outcome of critically ill patients given glutamine-supplemented parenteral nutrition. Nutrition 1997, 13(4): 295-302
[6]Houdijk AP, Rijnsburger ER, Jansen J, et al. Randomised trial of glutamine-enriched enteral nutrition on infectious morbidity in patients with multiple trauma. Lancet, 1998, 352(9130): 772-776
[7]Kalhan SC, Parimi PS, Gruca LL, et al. Glutamine supplement with parenteral nutrition decreases whole body proteolysis in low birth weight infants. J Pediatr,2005,146(5):642-647
[8]Poindexter BB, Ehrenkranz RA, Stoll BJ, et al. Effect of parenteral glutamine supplementation on plasma amino acid concentrations in extremely low-birthweight infants. Am J Clin Nutr, 2003,77(3):737-743
[9]van den Berg A, Van Elburg RM, Westerbeek EA, et al. Glutamine-enriched enteral nutrition in very-low-birth-weightinfants and effects on feeding tolerance and infectious morbidity: a randomized controlled trial. Am J Clin Nutr, 2005,81(6):1397-1404
[10]Novak F, Heyland DK, Avenell A, et al. Glutamine supple-mentation in serious illness: a systematic review of the evidence. Crit Care Med, 2002, 30(9): 2022-2029
[11]Wischmeyer PE, Lynch J, Liedel J, et al. Glutamine administration reduces Gram-negative bacteremia in severely burned patients: a prospective, randomized, double-blind trial versus isonitrogenous control. Crit Care Med, 2001, 29(11): 2075-2080
[12]Huang Y, Li N, Liboni K, et al. Glutamine decrease lipopolysaccharide induced IL-8 production in Caco-2 cells through a non-NF-kb p50 mechanism. Cytokine, 2003, 22(3-4):77-83
[13]Ogle CK, Mao JX, Wu JZ, et al. The 1994 Lindberg Award. The production of tumor necrosis factor, interleukin-1, interleukin-6, and prostaglandin E2 by isolated enterocytes and gut macrophages: effect of lipopolysaccharide and thermal injury. J Burn Care Rehabil, 1994,15(6):470-477
[14]Liu GQ(刘桂琴), Yue HQ, Zhang Y. Determination of the biological membranes fluidity by the fluorescence polarization. Modern Instruments(现代仪器), 2004,6(3):33-34
[15]Li J(李军), Xu LF, Sun M. Proective effects of glutamine on intestinal injury of infant rats induced by endotoxin. Chinese Journal of Birth Health and Heredity(中国优生与遗传杂志), 2006,14(3):30-32
[16]Li N, Liboni K, Fang MZ, et al.Glutamine decreases lipopolysaccharide-induced intestinal inflammation in infant rats. Am J Physiol Gastrointest Liver Physiol, 2004,286(6):914-921
[17]Zhao YJ, Wang H, Liu X, et al. Protective effects of glutamine in a rat model of endotoxemia. Mol Med Report, 2012, 6(4):739-744
[18]Pang QF(庞庆丰), Xu WL, He J, et al. The protective effect of glutamine on endotoxemic intestinal injury and expression of heme oxygenase-1 in rats. Chin Crit Care Med(中国危重病急救医学), 2011, 23(2):95-98
[19]Chang X(常晓), Wang LL, Lian SJ, et al. Effect of oral glutamine on intestinal barrier function in yaung rats with endotoxemia. Chin J Contemp Pediatr(中国当代儿科杂志), 2010, 12(10):809-811
[20]Ma X(马欣), Li YC. 谷氨酰胺与心肌缺血再灌注损伤. Chin J Arterioscler(中国动脉硬化杂志), 2007,15(11):873-875
[21]Humbert B, Nguyen P, Martin L, et al. Effect of glutamine on glutathione kinetics in vivo in dogs. J Nutr Biochem, 2007,18(1):10-16
[22]Scheibe R, Schade M, Grundling M, et al. Glutamine and alanyl-glutamine dipeptide reduce mesenteric plasma extrava-sation, leukocyte adhesion and tumor necrosis factor-α (TNF-α) release during experimental endotoxemia . J Physiol Pharmacol, 2009,60(8S):19-24
[23]Liboni KC, Li N, Scumpia PO, et al. Glutamine modulates LPS-induced IL-8 production through IkappaB /NF-kappaB in human fetal and adult intestinal epithelium. J Nutr, 2005, 135 (2): 245-251
[24]Deniel N, Marion-Letellier R, Charlione R, et al. Glutamine regulates the human epithelial intestinal HCT-8 cell proteome under apoptotic conditions.Mol Cell Proteomics,2007,6(10):1671-1679
