低分子量海带岩藻聚糖硫酸酯的制备及流感病毒神经氨酸酶抑制活性研究*
2012-01-08李八方董诗竹王景峰
李 芳,李八方,董诗竹,王景峰,赵 雪
(中国海洋大学食品科学与工程学院,山东青岛266003)
低分子量海带岩藻聚糖硫酸酯的制备及流感病毒神经氨酸酶抑制活性研究*
李 芳,李八方,董诗竹,王景峰,赵 雪**
(中国海洋大学食品科学与工程学院,山东青岛266003)
以海带岩藻聚糖硫酸酯粗多糖为原料,采用Cu2+-H2O2自由基氧化体系结合超滤技术制备低分子量岩藻聚糖硫酸酯。通过比较粗糖质量和H2O2浓度对产物的分子量和化学组成的影响,确定制备高硫酸根高岩藻糖的低分子量岩藻聚糖硫酸酯的最佳条件是:4.5%H2O2与0.026 7mol/L Cu2+降解4.5g岩藻聚糖硫酸酯,得到Fa3(Mw 7.68kDa)和Fb3(Mw 3.89kDa)2个组分,其硫酸根含量较高,为30.32%和32.48%。Fa3组分主要由岩藻糖(64.25%)和半乳糖(30.74%)组成,而Fb3的硫酸根和半乳糖含量高于Fa3,但岩藻糖含量下降。比较发现,H2O2浓度由4.5%上升为9%时,制备的低分子量岩藻聚糖硫酸酯的分子量、岩藻糖含量和硫酸根含量都下降。研究发现Fa3和Fb3对流感病毒神经氨酸酶具有较强的抑制作用,尤其是Fa3组分活性较高。说明分子量对岩藻聚糖硫酸酯的神经氨酸酶抑制活性影响要大于硫酸根含量,而且Fa3组分对流感病毒神经氨酸酶的抑制活性也可能与其单糖组成较均一有关。
低分子量岩藻聚糖硫酸酯;自由基氧化降解;神经氨酸酶
岩藻聚糖硫酸酯是褐藻中特有的一种以岩藻糖为主构成的水溶性硫酸多糖。研究发现岩藻聚糖硫酸酯具有抗凝血、抗肿瘤、抗HIV、抗血栓、提高免疫力和降血脂等生物活性,是陆地植物硫酸多糖类化合物所无法比拟的[1-3]。目前研究的高分子岩藻聚糖硫酸酯虽然具有很好的生物活性,但是因为其分子量大,化学组成复杂,溶解性和吸收性差,使用时有内出血的危险,因此在临床上应用受到了很大的限制。而且从不同海藻中采用不同方法提取的岩藻聚糖硫酸酯的化学组成存在很大的差异,无法进行生物活性的构效关系和原理的研究。因此作者研究的目标是制备化学结构明确的低分子量岩藻聚糖硫酸酯,用于流感病毒神经氨酸酶抑制活性等生物活性及构效关系研究。
目前因为缺少商业化的岩藻聚糖降解酶,低分子量的岩藻聚糖硫酸酯的制备主要采用酸水解法或氧化降解法等化学降解法。研究结果表明,采用酸水解岩藻聚糖硫酸酯得到的低聚糖产率比较低,而且得到的多糖的组成均一性差,脱硫现象比较严重,脱盐步骤繁琐[4]。欧阳建明[5]和王琪琳[6]分别研究了H2O2和琥珀酸-H2O2-VC体系降解海带岩藻聚糖硫酸酯,但是得到的低分子量组分的硫酸根和岩藻糖含量很低。法国的Nardella[7]将自由基氧化降解体系应用于降解泡叶藻岩藻聚糖硫酸酯,得到了分子量10kDa以下高硫酸根高岩藻糖的岩藻聚糖硫酸酯,糖产率高、无需脱盐。活性研究表明制备的低分子量岩藻聚糖硫酸酯仍然具有很好的抗血栓活性[8],说明自由基氧化降解是一种很好的制备高活性低分子量岩藻聚糖硫酸酯的方法。
我国是世界上海带养殖量最大的国家,海带加工业主要以褐藻胶、碘和甘露醇为主,加工后的废弃物中含有大量的岩藻聚糖硫酸酯,往往都作为废弃物丢弃,造成了很大的资源浪费,而目前岩藻聚糖硫酸酯尤其是低分子量岩藻聚糖硫酸酯的制备技术和应用方面的研究还很少。作者前期对海带硫酸多糖的降解和抗氧化活性进行了大量的研究,在此基础上,用自由基氧化降解法制备低分子量海带岩藻聚糖硫酸酯,并评价了其病毒神经氨酸酶抑制活性。
1 材料与方法
1.1 实验材料
岩藻聚糖硫酸酯(Fucoidan)粗多糖,购自日照洁晶海洋生物技术有限公司。
1-苯基-3-甲基-5-吡唑啉酮(PMP)(分析纯)、D-甘露糖和D-葡萄糖均购自上海化学试剂公司;右旋糖酐分子量标准品(180Da,2.5kDa,4.6kDa,7.1kDa,10kDa)购自中国药品生物制品检定所;D-(+)-氨基葡萄糖(GlcN)购自Fluka公司;L-鼠李糖、D-半乳糖、乳糖、D-木糖、L-岩藻糖、Chelex 100螯合树脂和MUNANA[2′-(4-甲基伞形)-α-D-乙酰神经氨酸]均购自Sigma公司;神经氨酸酶检测缓冲液(MES缓冲液),流感病毒神经氨酸酶由中国海洋大学医药学院药理研究室提供[在长满MDCK细胞(105/mL)的培养瓶中加入含有一定量的甲型或乙型流感病毒滴度的流感病毒培养液(含牛血清白蛋白112mg/mL;胰酶5μg/mL;余同细胞培养液),继续孵育,待细胞完全被病毒感染病变后取培养液,1 000r/min离心10min,取上清液,加入NP-40(终质量浓度0.1%)作为原酶液]。
中空纤维超滤膜(截留分子量10kDa和6kDa)购自天津膜天膜工程技术有限公司;超滤膜(2.5kDa)和纳滤膜(300Da)为美国GE公司产品。
1.2 实验方法
1.2.1 自由基氧化降解法制备低分子量的岩藻聚糖硫酸酯[7]取一定量的岩藻聚糖硫酸酯溶于水,配制100mg/mL溶液,然后加入Cu(AC)2·H2O至Cu2+浓度为0.026 7mol/L,用2mol/L的NaOH溶液调pH至7.5左右。于水浴加热至溶液温度为60℃,保持恒温,然后以12mL/h的速度加入一定浓度的H2O2溶液,5h后停止加入H2O2,加入Chelex100螯合树脂除去残留的Cu2+。反应液分别用截留分子量为10kDa、6kDa、2.5kDa和300Da的超滤膜进行超滤,得到4个组分Fa(6~10kDa)、Fb(2.5~6kDa)、Fc(300Da~2.5 kDa)和Fd(小于300Da),然后分别浓缩冻干。
1.2.2 总糖和分子量测定 总糖测定采用苯酚—硫酸法[9],分子量测定采用高效液相色谱法[10]。采用Agilent 1100高效液相色谱仪,选用TSK-gel G2500 PWxl色谱柱(Tosoh Bioscience),用0.2mol/L的NaCl作为流动相,洗脱速度为0.5mL/min,保持柱温40℃,采用示差检测器(G1362A)检测,以Mw为142.6Da、180Da、2.5kDa、4.6kDa、7.1kDa和10 kDa的右旋糖酐标准品作多糖分子量对数与保留时间的标准曲线。采用Agillent GPC软件计算各洗脱峰的重均分子量(Mw)和数均分子量(Mn),多分散系数D=Mw/Mn。
1.2.3 红外光谱分析 将干燥的各待测样品与KBr压制成片,使用Nicolet-Nexus 470傅立叶变换红外光谱仪,扫描600~4000cm-1波长范围内的光谱吸收值。1.2.4硫酸根含量测定 采用离子色谱法[11],选用ICS-2000Ion Chromatography System(Dionex,USA)。
K2SO4标准曲线制作:以Ionpac AS11-HC(4mm×250mm)为分离柱,Dionex Ionpac AG11-HC(4mm×50mm)为保护柱,30mmol/L KOH为淋洗液,ASRS ULTRAⅡ为抑制器,抑制电流为238mA,进样体积为25μL,控制流速为1.0mL/min。将无水硫酸钾加压干燥至恒重,以去离子水配制浓度为5,10,20,30,40和50μg/mL的标准液,取其中各个样品溶液过0.45μm水膜进样测定,建立硫酸根洗脱峰面积和硫酸根浓度的标准曲线。
样品测定:将待测的组分取适量于放有五氧化二磷的干燥器中减压干燥1h,准确称取2~5mg干燥后的多糖样品,加入1mL三氟乙酸(2mol/L)溶液溶解,然后充氮气封管,于110℃水解8h。水解后氮气吹干除去三氟乙酸,用2和0.3mol/L NaOH缓慢调至中性,定容至25mL。取25μL进样分析确定待测组分的洗脱峰面积,然后根据标准曲线计算硫酸根含量。
1.2.5 单糖组成测定 采用柱前衍生高效液相色谱法[12-13],将Man、Rha、GlcN、Gal、Glc、Xyl和Fuc 7种单糖标准品和内标物Lac配制成约2mmol/L,分别吸取50μL加入试管中,然后加入400μL PMP衍生试剂和等体积的0.3mol/L NaOH溶液,70℃水浴反应30min,取出,冷却,用400μL 0.3mol/L HCl中和,加入1mL氯仿萃取,充分震荡,小心吸弃下层,重复3次。将上层水相过膜,取10μL液相色谱分析单糖标准品的洗脱时间和峰面积。
采用Agilent 1100高效液相色谱仪,ZORBAX E-clipse色谱柱XDB-C18分离柱(4.6mm×250mm,5μm),245nm紫外检测器(DAD),控制流速为1.0 mL/min,保持柱温为25℃,采用流动相A:10%(V/V)乙腈+0.1mol/L乙酸铵-乙酸缓冲液(pH=5.5)和流动相B:25%(V/V)乙腈+0.1mol/L乙酸铵-乙酸缓冲液(pH 5.5),时间梯度:0→40min,浓度梯度:40%→100%,流动相B。
岩藻聚糖硫酸酯各组分单糖衍生物的制备[14]:称取各组分样品约2.0mg于安瓿瓶中,加入1mL三氟乙酸(2mol/L)于110℃水解8h。然后用氮气吹干三氟乙酸,用2和0.3mol/L NaOH溶液缓慢调至中性,定容至1mL。取350μL水解液加入50μL内标物,然后进行PMP衍生化。PMP、NaOH和HCl的用量均为400μL,衍生后的溶液取10μL进行液相色谱分析,根据单糖标准品实验结果确定待测组分中单糖种类和含量,每个样品做6个平行。
1.2.6 流感病毒神经氨酸酶活性的测定[15]在96孔荧光酶标板内加入70μL神经氨酸酶检测缓冲液(MES)、10μL神经氨酸酶,然后加入受试样品Fa3和Fb3各10μL,空白和阳性对照组分别加10μL超纯水和药物扎那米韦(10mg/mL),加超纯水使每孔总体积为90μL。振动摇匀1min,37℃温孵箱中孵育2min后,每孔再加入10μL神经氨酸酶荧光底物MUNANA,振动摇匀1min,37℃孵育20min后进行荧光测定。激发波长为360nm,发射波长为440nm。每组作5个平行。抑制率=(A0-A)/A0(A0为不加受试样品的440nm下的荧光强度,A为添加受试样品后440 nm下的荧光强度)。
2 结果与分析
2.1 不同降解条件下制备的低分子量岩藻聚糖硫酸酯的分子量的比较
根据右旋糖酐标准品溶液进样结果计算,得分子量计算公式:lg Mw=-0.2646 tR+7.0746,tR为保留时间,相关系数r2=0.986,并根据GPC软件得到各组分的重均分子量(Mw)、数均分子量(Mn)和多分散系数(D)。比较发现,4.5%H2O2降解2g岩藻聚糖硫酸酯粗糖,主要得到3个组分,Mw分别为7.82、3.31和1.53kDa,3个组分的多分散系数分别为1.010、1.040和1.008。洗脱时间为17.35~19.42min之间的组分为降解下来的单糖片段,含量都比较低(见图1曲线a)。当H2O2浓度上升为9%时,只得到了2个低分子量组分,Mw分别是4.05和1.55kDa,而且洗脱时间为17.35~19.42min之间的单糖片段含量明显高于4.5%H2O2降解产物。说明H2O2浓度升高到9%,分子量为7.82kDa左右的组分被进一步降解了,产物的分子量下降,降解产物中单糖含量上升(见图1曲线b)。

图1 4.5%H2O2和9%H2O2降解2g fucoidan得到的小于10kDa部分的高效液相色谱分析Fig.1 HPLC analysis of the fractions with Mw<10kDa from 2g fucoidan degraded by 4.5%H2O2and 9%H2O2respectively
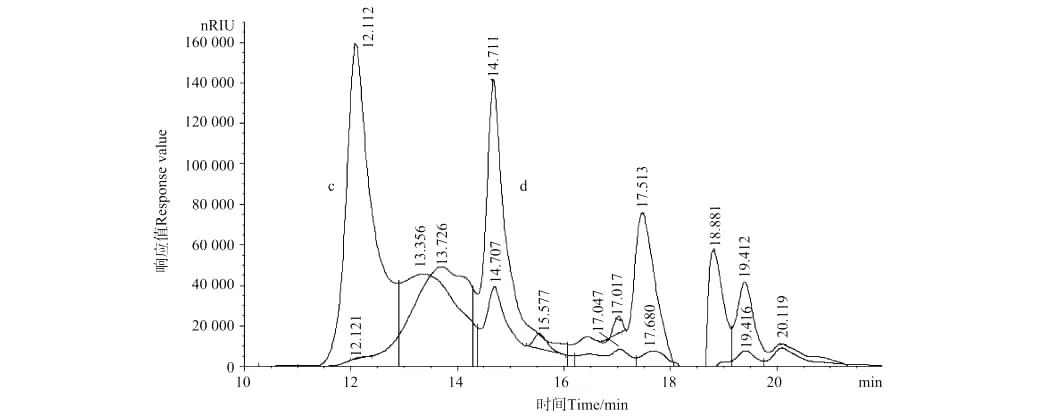
图2 4.5%H2O2和9%H2O2降解4.5g fucoidan得到的小于10kDa部分的高效液相色谱分析Fig.2 HPLC analysis of the fraction with Mw<10kDa from 4.5g fucoidan degraded by 4.5%H2O2and 9%H2O2
比较发现,采用4.5%和9%的H2O2降解4.5g岩藻聚糖硫酸酯,得到产物分子量与降解2g岩藻聚糖硫酸酯非常相似(见图2曲线c和d),但是各组分的含量有很大的差别。采用4.5%H2O2降解4.5g岩藻聚糖硫酸酯,产物中的分子量为7.74kDa组分的含量明显高于2g的降解产物。说明即使反应体系中的H2O2和Cu2+浓度相同,一次降解不同量的岩藻聚糖硫酸酯,得到的低分子量的岩藻聚糖硫酸酯产物的分子量分布也不同。
2.2 不同降解条件下制备的低分子量岩藻聚糖硫酸酯的硫酸根含量的比较
根据高效液相色谱分析结果,可以确定自由基氧化降解条件下得到的分子量主要是7、4和1.5kDa左右的3个部分,因此选用截留分子量为10、6、2.5和300kDa的超滤膜和纳滤膜将降解产物进行分离,可以快速地将产物分离成分子量为6~10kDa、2.5~6kDa和小于2.5kDa的3个部分,然后采用高效液相色谱分析各组分的分子量。超滤和纳滤具有分离速度快,处理量大,带负电荷的硫酸多糖损失少的优点,而且选用300Da的纳滤膜可以将低分子量组分快速脱盐。
自由基氧化降解条件下得到的分子量为6~10kDa和2.5~6kDa的组分的硫酸根含量均高于分子量为1.55kDa左右的组分和粗多糖。而且4.5%H2O2降解岩藻聚糖硫酸酯得到的低分子量组分的硫酸根含量均高于用9%H2O2降解的产物。尤其是4.5%H2O2降解4.5g岩藻聚糖硫酸酯得到的Fa3(Mw 7.68kDa)和Fb3(Mw 3.89kDa)2个组分的硫酸根含量达到30.32%和32.48%,明显高于粗多糖,而且2个高硫酸根组分Fa3和Fb3的产率都高于9%H2O2的降解产物(见表1),因此认为采用4.5%H2O2降解4.5g岩藻聚糖硫酸酯是得到高硫酸根含量的低分子量岩藻聚糖硫酸酯的最佳条件。而Colliec-Jouault S[16]和Nardella A[17]采用9%H2O2降解4.5g泡叶藻的岩藻聚糖硫酸酯,主要得到分子量为6.4kDa的硫酸根和岩藻糖含量很高的组分。分析原因可能是泡叶藻岩藻聚糖硫酸酯粗多糖中的岩藻糖含量大约在80%左右,明显高于海带粗多糖(46.2%),而作者前期对硫酸多糖与自由基反应机理研究表明,氧化降解主要作用于糖醛酸和硫酸根含量低的中性糖,而对主链上结合有硫酸根较多的岩藻糖降解作用小,因此降解泡叶藻的岩藻聚糖硫酸酯所需要的H2O2浓度高于海带粗多糖。

表1 自由基氧化降解岩藻聚糖硫酸酯得到的低分子量组分的分子量、硫酸根含量和得率的比较Table 1 The comparison of molecular weight,sulfated ester content and yield of low molecular weight fucoidan obtained by radical process degradation
图3为Fa3和Fb3 2个组分的红外光谱分析。结果表明,2个组分的红外光谱分析结果非常相似,2个组分在1 257.2和1 257.9cm-1处均显示了很强的S=O对称吸收峰,这与离子色谱测定的硫酸根含量高达30.32%和32.48%也是吻合的。Fa3和Fb3在845.19和844.63cm-1处均有较强的C-O-S的伸缩振动峰,为C-4位硫酸基取代的岩藻糖和C-4位硫酸基取代的半乳糖[18]。
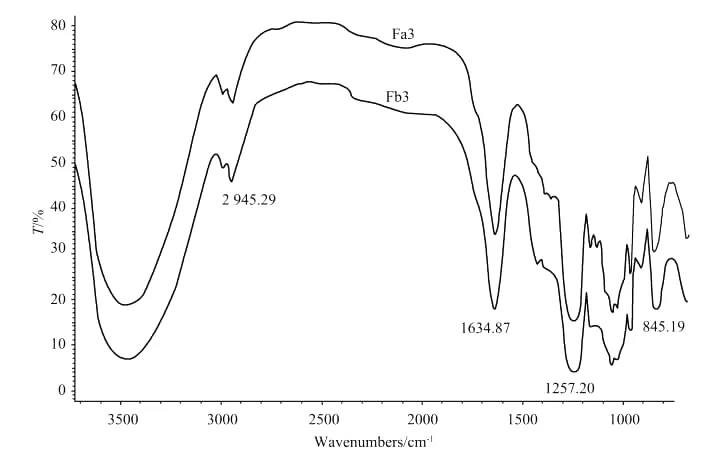
图3 组分Fa3和Fb3的红外光谱分析Fig.3 IR spectrum of fraction Fa3and Fb3
2.3 不同降解条件下制备的低分子量岩藻聚糖硫酸酯的单糖组成的比较
经比较发现,4.5%H2O2降解4.5g岩藻聚糖硫酸酯粗多糖,得到的重均分子量为7.68kDa的组分主要由岩藻糖组成,达到64.25%,高于岩藻聚糖硫酸酯粗多糖(46.2%),其次是半乳糖含量上升到30.74%,岩藻糖和半乳糖占总单糖组成的94.99%,而甘露糖、鼠李糖和葡萄糖含量很低。此结果与Colliec-Jouault S[16]的结果一致,说明自由基氧化降解可以得到岩藻糖含量很高的低分子量组分。而本文采用超滤分离首次获得了重均分子量为3.89kDa的高硫酸根含量的低分子量组分,分析发现其主要由岩藻糖(46.94%)和半乳糖(37.35%)组成,岩藻糖含量明显低于7.68kDa组分。而分子量为1.55kDa组分的糖组成比较复杂,主要由岩藻糖和半乳糖组成,还含有一定量的D-氨基葡萄糖、甘露糖、鼠李糖、葡萄糖和木糖(见表2)。比较发现,当H2O2浓度由4.5%上升到9%时,得到的6~10kDa和2.5~6kDa的组分不仅硫酸根含量下降,单糖中岩藻糖和半乳糖含量也明显下降,而且都含有较高含量的葡萄糖和甘露糖。H2O2降解2g岩藻聚糖硫酸酯与降解4.5g得到的低分子量岩藻聚糖硫酸酯的单糖组成规律相似(结果未给出)。说明4.5%H2O2是制备高岩藻糖含量的低分子量岩藻聚糖硫酸酯的最佳浓度。
2.4 低分子量岩藻聚糖硫酸酯对流感病毒神经氨酸酶的抑制作用
目前大量研究表明,岩藻聚糖硫酸酯具有抗单纯性疱疹病毒、呼吸道合胞体病毒和艾滋病病毒活性,其分子量、硫酸根含量和单糖组成对抗病毒活性都有很大影响[19-21]。但是对流感病毒的作用很少有报道,尤其是低分子量岩藻聚糖硫酸酯对流感病毒神经氨酸酶的作用未见报道。神经氨酸酶在甲、乙型流感病毒的复制、感染和致病过程中起重要作用,研究表明流感病毒的神经氨酸酶抑制剂可有效地控制甲、乙型流感病毒感染引起的流感症状和疾病的传播[22-23]。本文选择硫酸根含量较高的2个组分Fa3、Fb3和低硫酸根组分Fc3,比较了低分子量岩藻聚糖硫酸酯对流感病毒神经氨酸酶的抑制作用(见表3)。结果表明,低分子量岩藻聚糖硫酸酯对流感病毒神经氨酸酶有显著的抑制活性,尤其是Fa3组分(Mw 7.68kDa)的抑制率最高,25mg/mL Fa3对流感病毒神经氨酸酶抑制率达到45.99%,显著高于Fb3(Mw 3.89kDa)和Fc3(Mw 1.55kDa),而Fc3表现出很低的流感病毒神经氨酸酶抑制活性。虽然Fa3的硫酸根含量低于Fb3,但是对病毒神经氨酸酶抑制活性明显高于Fb3。说明分子量对岩藻聚糖硫酸酯的神经氨酸酶抑制活性影响要大于硫酸根含量。根据报道,硫酸化度是硫酸多糖抗病毒活性的一个重要决定因素。一般地,硫酸根含量在每个糖残基平均含1.5~2.0为最佳。大分子量硫酸多糖因为吸收效果差,应用受到限制。而肝素和硫酸葡聚糖均在分子量5~6kDa时抗HIV效果最好[24],可容易地通过胃粘膜屏障进入血液中[25]。硫酸多糖用作抗病毒药物突出的例子是抗HIV药物Hoe/Bay 946(1987年联邦德国Bayer与Hoechst公司联合研制)的分子量为6kDa的木聚糖硫酸酯[26]。
另外组分Fa3的流感病毒神经氨酸酶抑制活性可能与其单糖组成较单一有关,Fa3组分主要是岩藻糖和半乳糖组成,而Fb3和Fc3中的岩藻糖含量下降,其他的单糖都要比Fa3复杂。这与McCulure[27]和Mizumoto K[28]的研究结果一致,认为硫酸化的匀多糖的抗病毒活性大于硫酸杂多糖。因此认为低分子量岩藻聚糖硫酸酯在抗流感病毒方面有很好的应用潜力,为下一步研究岩藻聚糖硫酸酯抗流感病毒活性及其机理提供依据。
3 结论
(1)本文选用自由基氧化法结合超滤技术可以快速大量地制备低分子量的海带岩藻聚糖硫酸酯。实验表明,通过控制氧化降解反应条件,可以获得不同分子量、硫酸根含量以及单糖组成不同的低分子量组分。比较发现,采用4.5%H2O2是制备高硫酸根含量和高岩藻糖含量的岩藻聚糖硫酸酯的最佳浓度,并且首次获得了重均分子量为3.89kDa的高硫酸根含量的低分子量组分;
(2)本文首次发现低分子量的岩藻聚糖硫酸酯对流感病毒神经氨酸酶有较强的抑制作用。比较分子量小于10 kDa的3个岩藻聚糖硫酸酯组分时发现,岩藻糖含量和分子量较高的Fa3组分活性最高,为进一步研究海带岩藻聚糖硫酸酯的抗流感病毒活性提供理论依据。
[1] 林洪,江洁,薛长湖,等.褐藻岩藻聚糖结构和活性研究进展[J].中国海洋药物,2002,6:42-47.
[2] Pomin V H,Paulo A S M.Structure,biology,evolution and medical importance of sulfated fucans and galactans[J].Glycobiology,2008,18(12):1016-1027.
[3] Berteau O,Mulloy B.Sulfated fucans,fresh perspectives:structures,functions and biological properties of sulfated fucans and an overview of enzymes active toward this class of polysaccharide[J].Glycobiology,2003,13(6):29-40.
[4] Colliec S,Fischer A M,Tapon-Berlaudiere J,et al.Anticoagulant properties of a fucoidan fraction[J].Thromb Res,1991,64(2):143-154.
[5] 欧阳健明.海带硫酸多糖的降解方法:中国,CN101168570A[P],2008-04-30.
[6] 王琪琳,曲爱琴,王海仁.海带硫酸多糖的降解、分离纯化及理化性质分析[J].药物生物技术,2004,11(5):316-320.
[7] Nardella A,Chaubet F,Boisson-Vidal C,et al.Anticoagulant low molecular weight fucans produced by radical process and ion exchange chromatography of high molecular weight fucans extracted from the brown seaweed Ascophyllum nodosum[J].Carbohydr Res,1996,289:201-208.
[8] Durand E,Helley D,Al Hai Zen A,et al.Effect of low molecular weight fucoidan and low molecular weight heparin in a rabbit model of arterial thrombosis[J].J Vasc Res,2008,45(6):529-537.
[9] 张惟杰.糖复合物生化研究技术[M].第2版.浙江:浙江大学出版社,1999:56-78.
[10] 魏远安,方积年.高效凝胶渗透法测定多糖纯度和分子量[J].药学学报,1989,24:532.
[11] 尹利昂,陈士国,薛长湖,等.四种海参中含岩藻糖支链的硫酸软骨素化学组成差异的分析[J].中国海洋大学学报:自然科学版,2009,39(9):63-68.
[12] Fu D,O Neill R A.Monosaccharide composition analysis of oligosaccharides and glycoproteins by high-performance liquid chromatography[J].Anal Biochem,1995,227(2):377-384.
[13] Strydom D J.Chromatographic separation of 1-phenyl-3-methyl-5-pyrazolone-derivatized neutral,acidic and basic aldoses[J].J Chromatogr A,1994,678(11):17-23.
[14] Yutaka K,Shugo W,Mamoru K,et al.Structure of fucose branches in the glycosaminogly can from the body wall of the sea cucumber Stichopus japonicus[J].Carbohydrate Res,1997,297(39):273-279.
[15] 曹鸿鹏,陶佩珍,杜冠华.流感病毒神经氨酸酶抑制剂筛选模型的建立和应用[J].药学学报,2002,37(12):930-933.
[16] Nardella A,Chaubet F,Sinpuin C,et al.Method for obtaining sulphated polysaccharides:United States,6028191[P],2000-02-22.
[17] Colliec-Jouault S,Durand P,Fischer A M,et al.Low molecular weight sulphated polysaccharide to obtain a medicine with antithrombotic activity:United States,US6828307B1[P],2004-12-07.
[18] Mori H,Nisizawa K.Sugar constituents of sulfated polysaccharides from the fronds of Sargassum ringgoldianum[J].Bull.Jpn.Soc.Fish,1982,48:981-986.
[19] 张颖,岑颖洲,黄日明,等.南海七种海藻多糖的抗病毒活性初步研究[J].病毒学报,2006,22(4):282-285.
[20] Baba M,Snoeck R,Pauwels R,et al.Sulfated polysaccharides are potent and selective inhibitors of various enveloped viruses,including herpes simplex virus,cytomegalovirus,vesicular stomatitis virus,and human immunodeficiency virus[J].Antimicrob Agents Chemother,1988,32:1742 1745.
[21] B ress A,Wassermann O,Bruhn T,et al.A new procedure for the isolation of anti-HIV compounds(polysaccharides and polyphenols)from the marine algaFucus vesiculosus[J].J Nat.Pros,1993,56:478 488.
[22] 龚晓明,徐激扬,丁玉林.抗流感病毒新药-神经氨酸酶抑制剂[J].药学进展,2002,26(5):266-270.
[23] Khare M D,Sharland M.Influenza[J].Exp Opin Pharmacother 2000,1(3):367-375.
[24] 方积年.硫酸化多糖的研究进展[J].中国药学杂志,1993,28(7):393-396.
[25] Larsen A K,Lund D P,Langer R,et al.Oral heparin results in the appearance of heparin fragments in the plasma of rats[J].Proc Natl Acad Sci U S A,1986,83(9):2964-2968.
[26] 周靓,蒙义文.多糖及其衍生物抗病毒作用研究进展[J].应用与环境生物学报,1997,3(1):82-90.
[27] McCulure M O,Whitby D,Patience C,et al.Dextran sulfate and fucoidan are potent inhibitors of HIV infection in vitro[J].Antiviral Chem Chemother,1991,2:19-26.
[28] Mizumoto K,Sugawara I Ito W,Kodama T,et al.Sulfated homopolysaccharides with immunomodulating activities are more potent anti-HTLV-III agents than sulfated heteropolysaccharides[J].J Exp Med,1988,58(3):145-151.
Preparation and Inhibitory Activity on Influenza Virus Neuraminidase of Low Molecular Weight Fucoidan from Laminaria japonica
LI Fang,LI Ba-Fang,DONG Shi-Zhu,WANG Jing-Feng,ZHAO Xue
(College of Food Science and Engineering,Ocean University of China,Qingdao 266003,China)
Low molecular weight fucoidan was prepared by free radical oxygen degradation and ultrafiltration technology from high molecular weight fucoidan extracted fromLaminaria japonica.The molecular weight and chemical composition of low molecular weight fucoidan fractions obtained by different degradation conditions were compared and the optimum degradation condition to yield highly sulfated low molecular weight fucoidan was 4.5%H2O2and 0.0267mol/L Cu2+from 4.5g crude fucoidan.Two highly sulfated fractions Fa3(Mw 7.68kDa)and Fb3(Mw 3.89kDa)were obtained with the sulfated ester content of 30.32%and 32.48%respectively.Low molecular weight fraction Fa3was mainly made up of fucose(64.25%)and galactose(30.74%),while the fucose content of fraction Fb3decreased to 46.94%,though it had a higher content of sulfated ester.When the concentration of H2O2increased to 9%,the molecular weight and content of sulfated ester and fucose of low molecular weight fucoidan fractions decreased significantly.The antiviral effect on influenza virus of low molecular weight fucoidan was assessed by fluorometric assay of influenza virus neuraminidase in vitro.Low molecular weight fucoidan exhibited significantly inhibitory effect on the activity of neuraminidase in vitro,especially fraction Fa3with Mw 7.68kDa had better inhibitory activity than Fb3and Fc3.The results revealed that molecular weight played a more important role on determining the inhibitory activity of low molecular weight fucoidan on neuraminidase in vitro than sulfated ester content.The homogeneous neutral sugar composition may also contribute to the inhibitory activity on influenza virus neuraminidase of Fa3.
low molecular weight fucoidan;radical process degradation;neuraminidase
TS201.2
A
1672-5174(2012)1-2-106-07
国家自然科学基金项目(30800858);山东省自然科学基金项目(ZR2010CQ020)资助
2011-02-23;
2011-04-22
李 芳(1986-),女,硕士生,主要从事海洋生物活性物质的研究。E-mail:lifang8626616@126.com
**通讯作者:E-mail:zhaoxue@ouc.edu.cn
责任编辑 朱宝象
