类泛素蛋白FAT10共价结合底物蛋白质的活性分析
2012-01-06王英明吴燕华金成学乔守怡
于 欣 王英明 吴燕华 金成学 穆 颖 乔守怡△
(1复旦大学生命科学学院遗传工程国家重点实验室 上海 200433;2金日成大学平壤医学院基础医学部 平壤)
泛素最先由Goldstein等[1]在1975年从胸腺中分离出来,是一条由76个氨基酸残基组成的高度保守的多肽链,在真核细胞内广谱表达[1]。泛素由5个β片层围绕1个α螺旋组成,这个特征结构又被称为泛素折叠(ubiquitin fold)[2]。在泛素激活酶E1、E2及E3的作用下,泛素选择性地修饰蛋白质底物,被泛素标记的蛋白质分子随后经过26S蛋白酶体途径进行降解[3]。其中,在泛素48位赖氨酸残基上形成含有至少4个泛素单体聚合而成的多泛素链,可以介导蛋白质底物进入26S蛋白酶体降解[4],在泛素63位赖氨酸残基形成的多泛素链与DNA修复及信号传导等细胞内生命活动有关[5],而泛素以单体形式共价结合底物蛋白质则与细胞内吞及转录调控有关[6]。受泛素调控的底物蛋白质包括细胞周期蛋白、核转录因子、信号转导因子等。泛素-蛋白酶体系统与蛋白质质量控制、细胞周期调控、DNA修复、基因表达及免疫应激等事件密切相关,还参与了多种疾病的发生发展[7]。
类泛 素 蛋 白 质 家 族 (ubiquitin like protein,UBL)是近几年新发现的一类小分子蛋白质,含有与泛素高度同源的结构域,在细胞生长调控中发挥多种重要作用[8]。UBLs又可分为两个亚家族:类泛素结构域蛋白家族(ubiquitin domain protein,UDP)和类泛素修饰蛋白家族(ubiquitin like modifier,ULM)[9]。UDP可以与泛素以及泛素修饰蛋白质发生非共价结合,代表成员有Elongin B[10]、RAD23[11]、Dsk2[12]、Bag1[13]等。研 究 发 现,Elongin B参与调控基因表达过程中mRNA链的延伸[10],而RAD23与DNA受紫外线损伤后的修复有关[11]。ULM具有与泛素单体或二聚体同源的结构域,可以在E1、E2、E3的催化下通过C末端的双甘氨酸基团与底物蛋白质共价结合,代表成员有ISG15、FUB1、NEDD8、SUMO、Urm1、UBL5、Ufm1等。其中,ISG15可以被干扰素诱导表达,参与调控细胞生长和分化[13];FUB1调控淋巴细胞活化 和 增 殖[14];NEDD8 参 与 细 胞 周 期 调 控[15];SUMO参与细胞周期调控、核运输、DNA转录与修复[16];Urm1 与 氧 化 应 激 反 应 有 关[17];UBL5 参 与mRNA 前 体 剪 接[18];Ufm1 参 与 内 质 网 应 激反应[19]。
FAT10基因位于人类6号染色体上I型主要组织相容性复合物(major histocompatibility complex,MHC)编码区域的末端[20]。FAT10是新近发现的ULM成员,N末端和C末端各含有1个与泛素高度同源的结构域,又被称为双泛素。人FAT10主要表达在胎盘、胸腺、脾、淋巴结、胚胎及成熟的 B 细胞和树 突 细 胞 (dendritic cell,DC)内[21]。已有的研究工作提示FAT10具有共价结合底物蛋白质、调节蛋白质降解的生物学活性,在细胞周期、细胞凋亡、肿瘤发生中发挥重要作用[22-24]。FAT10在肝癌和胃肠癌组织中高表达[25-26]。联用干扰素和肿瘤坏死因子可以诱导FAT10的表达[27]。此外,研究还表明FAT10与p53密切相关,一方面p53可以直接结合FAT10的启动子,下调FAT10的表达[28];另一方面,FAT10又可以共价修饰p53并提高p53的转录活性[29]。Nagashima等[30]发现FAT10可以共价修饰多聚谷氨酸蛋白质并调控其溶解性。但是,FAT10调节蛋白质降解的作用机制尚不清楚。本文通过对比FAT10突变体与野生型FAT10在HEK293T细胞中共价结合蛋白质底物的活性,发现FAT10的双泛素结构域及C末端的双甘氨酸基团都是FAT10与蛋白质底物结合所必需的。
材料和方法
抗体抗人FAT10多克隆抗体、抗人β-actin单克隆抗体、抗HA tag单克隆抗体、鼠IgG(美国Sigma公司),HRP耦联二抗(美国Upstate公司)。
细胞培养HEK293T细胞(ATCC)。DMEM高糖培养基中加入10%胎牛血清、丙酮酸钠(终浓度1mmol/L),于37℃、5%CO2条件下进行培养。
FAT10基因的克隆依照NCBI GenBank数据库中FAT10(Accession number NM_006398)的cDNA序列设计引物:正向引物5′-GGGGATTTCCAACTCAACT-3′,反 向 引 物 5′-GGTCACCCTCCAATACAAT-3′。以人的胸腺cDNA文库为模板,PCR扩增反应条件:94℃变性5min,94℃、30 s,58℃、30s,72℃、45s,30个循环反应,72℃延伸7 min。产物回收后连接至pMD18-T载体,转化大肠埃希菌DH5α感受态细菌后挑取阳性克隆测序鉴定。
FAT10野生型及突变体真核表达载体的构建
以测序正确的pMD18-T-FAT10为模板,以正向引物5′-CCCGAATTCCCATGGCTCCCAATGCTTCCTGCCTCT-3′和反向引物5′-CCCGGTACCCTACTACCCTCCAATACAATAAGATGCCAGG-3′扩增,将FAT-10全长基因构建到哺乳动物表达载体pCMV-HA中。以 正 向 引 物 5′-CCCGAATTCCCATGGCCCCAATGCTTCCTGCCTCT-3′和 反 向 引 物 5′-CCCGGTACCCTACTACAAGGGCAGCTCCTCATCACTGGGC-3′扩增FAT10的N端泛素结构域,构建pCMVHA-FAT10-N。以 正 向 引 物 5′-CCCGAATTCGGTTTCTTGTGGAGTCAGGTGATGAGG-3′和 反 向引 物 5′-CGTAAGCTTCTTTCCCAGACGCTGTTCACAG-3′扩增FAT10的C端泛素结构域,构建pCMV-HA-FAT10-C。按照Strategene方法进行点突变实验,构建FAT10末端双甘氨酸基团GG突变为AV 的pCMV-HA-FAT10ΔGG。
哺乳动物细胞的质粒转染将HEK293T以3.0×105/孔的密度接种于12孔培养板中,24h后按照Lipofectin 2000TM(Invitrogen)操作说明,分别将1.6μg野生型及突变体FAT10重组质粒与脂质体混合后加入到HEK293T细胞中,6h后更换完全培养基终止转染,继续培养48h后裂解细胞。MG132处理组:转染后6h更换含有 MG132(20 μmol/L)的完全培养基,对照组加入相同体积的DMSO,继续培养48h后裂解细胞。
蛋白质裂解与Western blot检测PBS清洗细胞后,加入RIPA缓冲液4℃裂解细胞60min。4℃下12 000r/min离心10min,取上清,加入5×SDS上样缓冲液,沸水浴3min,获得全细胞蛋白抽提液。经12%SDS-PAGE电泳分离后转移至PVDF膜,5%脱脂牛奶室温封闭60min后,4℃下一抗孵育过夜,TBST洗涤4遍后加入HRP耦联二抗,室温孵育45min,TBST洗涤4遍后加入ECL底物,获取荧光照片。
结 果
FAT10基因克隆及其突变体的构建我们利用人胸腺组织的cDNA文库为模板,成功扩增了FAT10基因的开放阅读框(图1,泳道1),并将其构建到哺乳动物表达载体pCMV-HA中获得pCMV-HAFAT10重组质粒。以全长FAT10为模板,分别扩增其 N端(1-90aa)和C端(91-165aa)的泛素结构域(图1,泳道2、3)并构建到pCMV-HA中获得pCMV-HAFAT10-N,pCMV-HA-FAT10-C。酶切和测序结果表明插入片段的大小、方向和序列均正确。以全长FAT10为模板,利用定点突变法将C末端GG突变为AV,获得pCMV-HA-FAT10ΔGG,测序结果正确。野生型FAT10及其突变体的蛋白质结构域示意图如图2所示。

图1 FAT10、FAT10-N和FAT10-C的PCR扩增结果Fig 1 PCR amplification of FAT10,FAT10-N and FAT10-C
野生型FAT10具有共价结合底物蛋白质的活性接种HEK293T细胞,转染不同剂量的pCMVHA-FAT10,48h后收获全细胞裂解液,用HA抗体检测细胞内FAT10基因表达情况。随着pCMVHA-FAT10质粒浓度的递增,HA-FAT10(相对分子质量21 000)的表达水平也梯度增加(图3)。同时,在HA-FAT10条带的上方还出现了梯度增强的杂交信号,而转染空载体的对照组中未出现非特异性抗体结合信号。结果说明,外源表达的HAFAT10可以共价结合内源的一些蛋白质底物,形成相对分子质量较大的复合物。
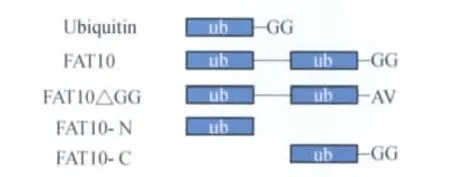
图2 FAT10、FAT10ΔGG、FAT10-N和FAT10-C的结构示意图Fig 2 Schematic representation of the architecture of FAT10,FAT10ΔGG,FAT10-N and FAT10-C

图3 野生型FAT10共价结合底物蛋白质Fig 3 Wild-type FAT10can covalently conjugate to unidentified protein substrates
FAT10通过C末端双甘氨酸基团及双泛素结构域共价结合底物蛋白质为了分析FAT10共价结合底物蛋白质的活性结构域,分别在HEK293T细胞中过表达FAT10的C末端双甘氨酸基团缺失突变体及N端、C端泛素结构域截断突变体,比较其与野生型FAT10共价结合底物蛋白质的活性水平。质粒转染和Western blot分析方法同前。图4显示 了 瞬 时 转 染 pCMV-HA-FAT10 与 pCMVHA-FAT10ΔGG 突 变 体 后 HEK293T 细 胞 中FAT10蛋白表达及其共价结合蛋白质的情况:与野生型FAT10相比,FAT10ΔGG的蛋白质表达水平基本相同,但共价结合底物蛋白质的信号仅在长时间曝光后才能少量显现,说明C末端的双甘氨酸对于FAT10结合底物蛋白质是必需的。此外,对比分析野生型FAT10和FAT10ΔGG共价结合的蛋白质的带型分布,发现末端双甘氨酸突变后,FAT10结合的主要蛋白质底物的类型也出现了变化:FAT10-底物蛋白质复合物在相对分子质量(Mr)35 000的主带在FAT10ΔGG中消失,新的主带出现在Mr50 000~60 000区域。

图4 FAT10通过C末端的双甘氨酸共价结合底物蛋白质Fig 4 The C-terminal diglycine motif of FAT10is required for its interaction with unidentified protein substrates
接下来,进一步对比分析含有单个泛素结构域的FAT10截断突变体结合底物蛋白质的活性。HA-FAT10-N与 HA-FAT10-C的条带均位于Mr10 000的条带附近,符合分子量大小特征。对比全长FAT10,截断突变体仍具有一定的底物结合活性,但结合能力显著降低(图5),表明FAT10的单泛素结构域不足以实现野生型FAT10的全部底物结合活性。此外,截断突变体结合底物的种类也有变化,几乎丧失了与大分子量蛋白结合的能力。

图5 FAT10通过双泛素结构域共价结合底物蛋白质Fig 5 Both UBL domains of FAT10are required for itsbinding to unidentified protein substrates
FAT10参与26S蛋白酶体介导的蛋白质降解途径为了证明FAT10及其截断突变体结合底物蛋白质后是否参与了26S蛋白酶体介导的蛋白质降解途径,我们利用26S蛋白酶体特异性抑制剂MG132处理细胞后再次分析了FAT10及其突变体共价结合蛋白质的活性变化。经MG132处理后,FAT10、FAT10-N 与 FAT10-C自身的表达水平及其共价结合的蛋白质信号均有显著提高,表明不仅FAT10自身及其共价结合的底物蛋白质能够通过26S蛋白酶体途径进行降解,FAT10-N和FAT10-C突变体尽管底物结合活性较弱,但同样能够介导底物蛋白质通过26S蛋白酶体进行降解(图6)。

图6 FAT10及其截断突变体参与26S蛋白酶体依赖的蛋白质降解途径Fig 6 FAT10and its both UBL domains promote26Sproteasome-dependent protein degradationLane 1:Vector;Lane 2:FAT10-N;Lane 3:FAT10;Lane 4:FAT10-C.
讨 论
蛋白质翻译后在氨基酸链上可以共价结合多种基团,如糖基、磷酸基、甲基、乙酰基等,这些修饰机制极大地扩展了生命体内蛋白质功能的多样性。而泛素分子通过共价结合底物蛋白质影响蛋白质的命运,是生物体内重要的蛋白质翻译后修饰途径。ULM家族与泛素有高度序列同源性,并且具有泛素折叠空间结构[31]。ULM家族的作用途径与泛素相似,在特异性E1、E2、E3酶的作用下,通过末端的甘氨酸基团共价修饰底物蛋白质,影响底物蛋白质的定位、半衰期、与其他蛋白质的相互作用等,进而对细胞生命活动进行调控[9]。但是目前关于ULM的生物学作用与分子机制尚缺乏深入认识。
FAT10在N端和C端各具有一个类泛素结构域,C末端具有一个保守的双甘氨酸基序,是近年来新发现的ULM成员。已有研究提示FAT10可以通过末端双甘氨酸基团共价结合蛋白质底物,但具体的机制以及底物蛋白质的种类仍在探索中。本研究中,我们首先在HEK293T细胞过表达FAT10后利用Western blot证明FAT10确实能够结合内源蛋白质底物,而末端双甘氨酸突变后,FAT10结合底物蛋白质的能力显著下降,这两组实验结果说明FAT10末端双甘氨酸基团对FAT10条带上方出现杂交信号是必需的。由于并无实验报道显示泛素识别和结合位点与目标蛋白质C末端双甘氨酸基团有关,因此我们推测这些特异性出现的杂交并不是FAT10自身泛素化修饰所致,而是FAT10以类似泛素的方式(即通过自身末端的双甘氨酸基团),与多种底物蛋白质共价结合,这一发现与Raasi等[22]在HeLa细胞系及Chiu等[32]在HEK293细胞系中获得的结果一致。我们的研究还发现FAT10单独的N末端泛素结构域与C末端泛素结构域具有部分结合底物蛋白质的活性,而且单独的泛素结构域所结合的底物蛋白质条带种类不同,表明FAT10的N末端和C末端泛素各自识别并标记不同的底物蛋白质。Chang等[33]在研究另一个双泛素分子ISG15的泛素结构域的过程中发现,ISG15单独的C末端泛素结构域可以将ISG15运送至E1分子UBE1L和E2分子UbcH8上,而其N端泛素结构域则对E3分子的识别和招募起到重要作用。因此,我们推测FAT10的N端和C端泛素结构域结合底物蛋白质的差异可能与FAT10与E1、E2、E3分子的作用机制有关。
26S蛋白酶体由1个20S亚基和2个19S亚基组成,可以将被泛素标记的底物蛋白质分解为较小的多肽、氨基酸以及可以继续重复利用的泛素分子[7]。Kamitani 等[34]发 现 NEDD8 互 作 蛋 白(NEDD8ultimate buster-1,NUB1)可 以 介 导NEDD8及其共价修饰蛋白质底物在26S蛋白酶体内降解。FAT10是目前发现的第2个具有标记并介导蛋白质通过蛋白酶体降解功能的类泛素分子[24]:Schmidtke 等[35]研 究 发 现,FAT10 与NUB1L的非共价结合可促进FAT10与蛋白酶体相互作用,进而介导底物蛋白质降解。我们研究发现,经蛋白酶体抑制剂处理后,FAT10及其共价结合底物蛋白质的信号均显著增强,与已知的研究结果一致。我们还发现蛋白酶体抑制剂还能增强FAT10两个截断突变体本身及其共价结合底物蛋白质的信号,表明FAT10的2个泛素结构域也都能通过标记底物蛋白质介导蛋白质进入26S蛋白酶体降解。
[1] Goldstein G,Scheid M,Hammerling U,etal.Isolation of a polypeptide that has lymphocyte-differentiating properties and is probably represented universally in living cells[J].ProcNatlAcadSciUSA,1975,72(1):11-15.
[2] Vijay-Kumar S,Bugg CE,Cook WJ.Structure of ubiquitin refined at 1.8Aresolution[J].JMolBiol,1987,194(3):531-544.
[3] Hershko A,Ciechanover A.The ubiquitin system[J].AnnuRevBiochem,1998,67(1):425-479.
[4] Thrower JS,Hoffman L,Rechsteiner M,etal.Recognition of the polyubiquitin proteolytic signal[J].EMBOJ,2000,19(1):94-102.
[5] Chan NL,Hill CP.Defining polyubiquitin chain topology[J].NatStructBiol,2001,8(8):650-652.
[6] Haglund K,Di Fiore PP,Dikic I.Distinct monoubiquitin signals in receptor endocytosis[J].TrendsBiochemSci.2003,28(11):598-603.
[7] Ciechanover A.The ubiquitin-proteasome pathway:on protein death and cell life[J].EMBOJ,1998,17(24):7151-7160.
[8] Hochstrasser M.Evolution and function of ubiquitin-like protein-conjugation systems[J].NatCellBiol,2000,2(8):E153-E157.
[9] Herrmann J,Lerman LO,Lerman A.Ubiquitin and ubiquitin-like proteins in protein regulation[J].CircRes,2007,100(9):1276-1291.
[10] Garrett KP,Aso T,Bradsher JN,etal.Positive regulation of general transcription factor SIII by a tailed ubiquitin homolog[J].ProcNatlAcadSciUSA,1995,92(16):7172-7176.
[11] Watkins JF,Sung P,Prakash L,etal.The Saccharomyces cerevisiae DNA repair gene RAD23encodes a nuclear protein containing a ubiquitin-like domain required for biological function[J].MolCellBiol,1993,13(12):7757-7765.
[12] Biggins S,Ivanovska I,Rose MD.Yeast ubiquitin-like genes are involved in duplication of the microtubule organizing center[J].JCellBiol,1996,133(6):1331-1346.
[13] Haas AL,Ahrens P,Bright PM,etal.Interferon induces a 15-kilodalton protein exhibiting marked homology to ubiquitin[J].JBiolChem,1987,262(23):11315-11323.
[14] Nakamura M,Yamaguchi S.The ubiquitin-like protein MNSFbeta regulates ERK-MAPK cascade[J].JBiol Chem,2006,281(25):16861-16869.
[15] Tateishi K,Omata M,Tanaka K,etal.The NEDD8 system is essential for cell cycle progression and morphogenetic pathway in mice[J].JCellBiol,2001,155(4):571-579.
[16] Johnson ES.Protein modification by sumo[J].AnnuRev Biochem,2004,73(1):355-382.
[17] Xu J,Zhang J,Wang L,etal.Solution structure of Urm1 and its implications for the origin of protein modifiers[J].ProcNatlAcadSciUSA,2006,103(31):11625-11630.
[18] Wilkinson CR,Dittmar GA,Ohi MD,etal.Ubiquitin-like protein Hub1is required for pre-mRNA splicing and localization of an essential splicing factor in fission yeast[J].CurrBiol,2004,14(24):2283-2288.
[19] Azfer A,Niu J,Rogers LM,etal.Activation of endoplasmic reticulum stress response during the development of ischemic heart disease[J].AmJPhysiol HeartCircPhysiol,2006,291(3):H1411-H1420.
[20] Fan W,Cai W,Parimoo S,etal.Identification of seven new human MHC class I region genes around the HLA-F locus[J].Immunogenetics,1996,44(2):97-103.
[21] Bates EE,Ravel O,Dieu MC,etal.Identification and analysis of a novel member of the ubiquitin family expressed in dendritic cells and mature B cells[J].EurJ Immunol,1997,27(10):2471-2477.
[22] Raasi S,Schmidtke G,Groettrup M.The ubiquitin-like protein FAT10forms covalent conjugates and induces apoptosis[J].JBiolChem,2001,276(38):35334-35343.
[23] Lim CB,Zhang D,Lee CG.FAT10,agene up-regulated in various cancers,is cell-cycle regulated[J].CellDiv,2006,1:20.
[24] Hipp MS,Kalveram B,Raasi S,etal.FAT10,a ubiquitinindependent signal for proteasomal degradation[J].Mol CellBiol,2005,25(9):3483-3491.
[25] Lee CG,Ren J,Cheong IS,etal.Expression of the FAT10 gene is highly upregulated in hepatocellular carcinoma and other gastrointestinal and gynecological cancers[J].Oncogene,2003,22(17):2592-2603.
[26] Qing X,French BA,Oliva J,etal.Increased expression of FAT10in colon benign,premalignant and malignant epithelial neoplasms[J].ExpMolPathol,2011,90(1):51-54.
[27] Raasi S,Schmidtke G,de Giuli R,etal.A ubiquitin-like protein which is synergistically inducible by interferongamma and tumor necrosis factor-alpha [J].EurJ Immunol,1999,29(12):4030-4036.
[28] Zhang DW,Jeang KT,Lee CG.p53negatively regulates the expression of FAT10,agene upregulated in various cancers[J].Oncogene,2006,25(16):2318-2327.
[29] Li T,Santockyte R,Yu S,etal.FAT10modifies p53and upregulates its transcriptional activity[J].ArchBiochem Biophys,2011,509(2):164-169.
[30] Nagashima Y,Kowa H,Tsuji S,etal.FAT10protein binds to polyglutamine proteins and modulates their solubility[J].JBiolChem,2011,286(34):29594-29600.
[31] Hochstrasser M.Evolution and function of ubiquitin-like protein-conjugation systems[J].NatCellBiol,2000,2(8):E153-E157.
[32] Chiu YH,Sun Q,Chen ZJ.E1-L2activates both ubiquitin and FAT10[J].MolCell,2007,27(6):1014-1023.
[33] Chang YG,Yan XZ,Xie YY,etal.Different roles for two ubiquitin-like domains of ISG15in protein modification[J].JBiolChem,2008,283(19):13370-13377.
[34] Kamitani T,Kito K,Fukuda-Kamitani T,etal.Targeting of NEDD8and its conjugates for proteasomal degradation by NUB1[J].JBiolChem,2001,276(49):46655-46660.
[35] Schmidtke G,Kalveram B,Weber E,etal.The UBA domains of NUB1Lare required for binding but not for accelerated degradation of the ubiquitin-like modifier FAT10[J].JBiolChem,2006,281(29):20045-20054.
