EPO对大鼠脑缺血-再灌注后炎症损伤的保护作用
2012-01-06宁显忠赵德福
宁显忠,赵德福
(辽宁医学院附属第三医院神经内科,辽宁锦州 121000)
近年来,促红细胞生成素(erythropoietin,EPO)的神经保护作用得到越来越多的学者的认可,但对EPO发挥神经保护功能的具体机制和途径目前尚知之甚少。众所周知,以白细胞侵入为主要标志的炎症反应是造成脑缺血-再灌注损伤的特征性改变。其中炎症细胞因子诱发的黏附分子表达上调和由后者介导的白细胞与内皮细胞的相互作用,是炎症反应的关键因素[1]。黏附分子当中比较重要的是细胞间黏附分子-1(intercellular adhesion molecules1,ICAM-1)及血管细胞间黏附分子-1(vascular cell adhesion molecule1,VCAM-1)的。脑缺血后多种炎性细胞因子诱导脑微血管内皮细胞表达ICAM-1和VCAM-1,二者通过与白细胞上的相应受体结合,导致白细胞与内皮细胞黏附、游出,进而浸润到血管外脑实质,造成脑损伤。本研究通过验证EPO对诱发炎症反应的ICAM-1和VCAM-1是否发挥抑制作用为切入点,着重探讨EPO对脑缺血-再灌注损伤的保护作用。
1 材料与方法
1.1实验动物 健康雄性SD大鼠216只,体质量250~300 g,由辽宁医学院动物中心提供。
1.2药品与试剂 注射用重组人EPO(批号A20101001)为成都地奥九泓制药厂产品,ICAM-1、VCAM-1抗体(货号分别为sc-1511和sc-8304)为美国Santa Cruz公司产品。
1.3方法
1.3.1分组与给药 将实验大鼠随机分为以下3组:(1)EPO干预组72只,缺血2 h后EPO腹腔注射,参照文献[2]选择EPO的有效剂量为3 000 U/kg,用生理盐水溶解,浓度为200 U/mL,给药后分别于再灌注3、6、12、24、48和72 h后取海马组织;(2)模型组72只,按模型标准制成大鼠脑缺血-再灌注模型,分别于缺血2 h后腹腔注射等量生理盐水,于再灌注3、6、12、24、48和72 h后取海马组织;(3)假手术组72只,只进行手术操作,不进行缺血-再灌注处理,于假手术2 h后腹腔注射等量生理盐水,分别于上述各时间点断头取海马组织。每个时间点为一个亚组,每亚组12只大鼠。

表1 各组大鼠不同时间点VCAM-1蛋白的表达量
△:P<0.05,△△:P<0.01,与假手术组比较;▲▲:P<0.01,与模型组比较。

表2 各组大鼠不同时间点ICAM-1蛋白的表达量
△△:P<0.01,与假手术组比较;▲:P<0.05,▲▲:P<0.01,与模型组比较。
1.3.2模型的制备 采用线栓法制作大鼠大脑中动脉阻塞模型。水合氯醛麻醉(3 mL/kg)大鼠,分离左侧颈总动脉,结扎其近心端,然后在颈总动脉上剪一个小口(约为动脉直径的1/2),将充满肝素的动脉插管插入小口,用手术线结扎固定插管后,将长6 cm的渔线插入动脉插管直至大脑中动脉,脑缺血开始后将动脉插管拔出,把渔线和颈总动脉结扎在一起;2 h后拔出鱼线,缺血-再灌注开始,以大鼠出现左侧霍纳氏征、右前肢伸展受限、活动时向右侧旋转为缺血-再灌注模型制备成功标志。模型组和EPO干预组中的6个亚组分别再灌注3、6、12、24、48和72 h,假手术组6个亚组不进行缺血-再灌注处理。
1.4标本制取与检测方法
1.4.1免疫组化法检测海马区ICAM-1和VCAM-1蛋白的表达 每个亚组取大鼠6只,乌拉坦麻醉(5 mL/kg),灌流固定脑组织,断头取海马组织,将标本置于4%多聚甲醛液中固定,制成厚度为5 μm的病理切片。取上述切片常规脱蜡,蒸馏水洗涤,3%过氧化氢溶液处理30 min,以去除内源性过氧化物酶,0.01 mol/L PBS洗涤3次(每次5 min);分别滴加适当稀释的兔抗大鼠ICAM-1一抗或兔抗大鼠VCAM-1-抗,4 ℃孵育过夜,0.01 mol/L PBS洗涤3次(每次5 min);滴加辣根酶标记羊抗兔多聚体(PV6001),37 ℃孵育30 min,0.01 mol/L PBS洗涤3次(每次5 min);二氨基联苯胺(DAB)显色,苏木素复染,脱水,透明,中性树胶封片,镜下观察海马组织中ICAM-1和VCAM-1蛋白的表达情况。二者均主要于内皮细胞膜表面表达,呈棕黄色颗粒状。
1.4.2Western blot分析海马组织ICAM-1和VCAM-1蛋白的表达 取每组剩余6只大鼠,麻醉方法同上,取其海马组织迅速置于―80 ℃冰箱中冻存备用。Western blot 检测分为以下6步:(1)制备蛋白样品;(2)测定上清液蛋白含量;(3) 十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳;(4)采用正电荷尼龙膜(PVDF)转移;(5)杂交;(6)显色分析,用Gene Genius凝胶图像系统分析各蛋白目的条带吸光度,用目的条带与β-actin条带吸光度的比值表示目的蛋白的含量。
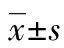
2 结 果
2.1免疫组化染色结果 观察区域主要选择在大鼠海马组织的CA1区,黏附分子的表达部位主要集中在血管内皮细胞表面。结果显示,假手术组血管内皮细胞表面有极少量VCAM-1和ICAM-1蛋白表达的阳性细胞;与假手术组比较,模型组ICAM-1和VCAM-1蛋白表达的阳性细胞于再灌注6 h开始逐渐增多,再灌注后12~48 h明显增多,以后有所减少;与模型组各时间点相比较,EPO干预组VCAM-1的表达量从12 h开始减少,24~72 h明显减少,而ICAM-1从6 h即开始减少,12~72 h明显减少。
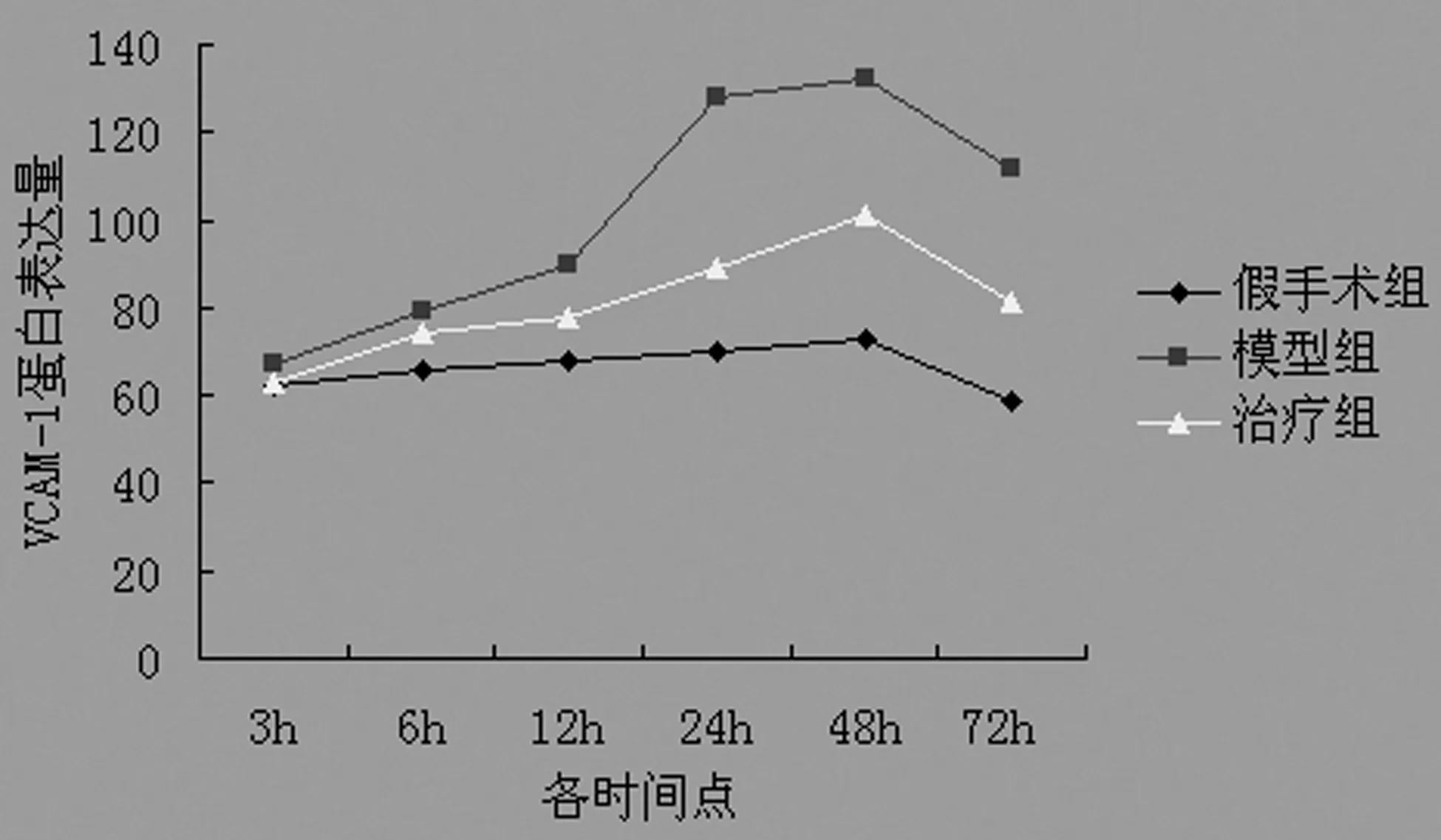
图1 各组大鼠不同时间点VCAM-1蛋白的
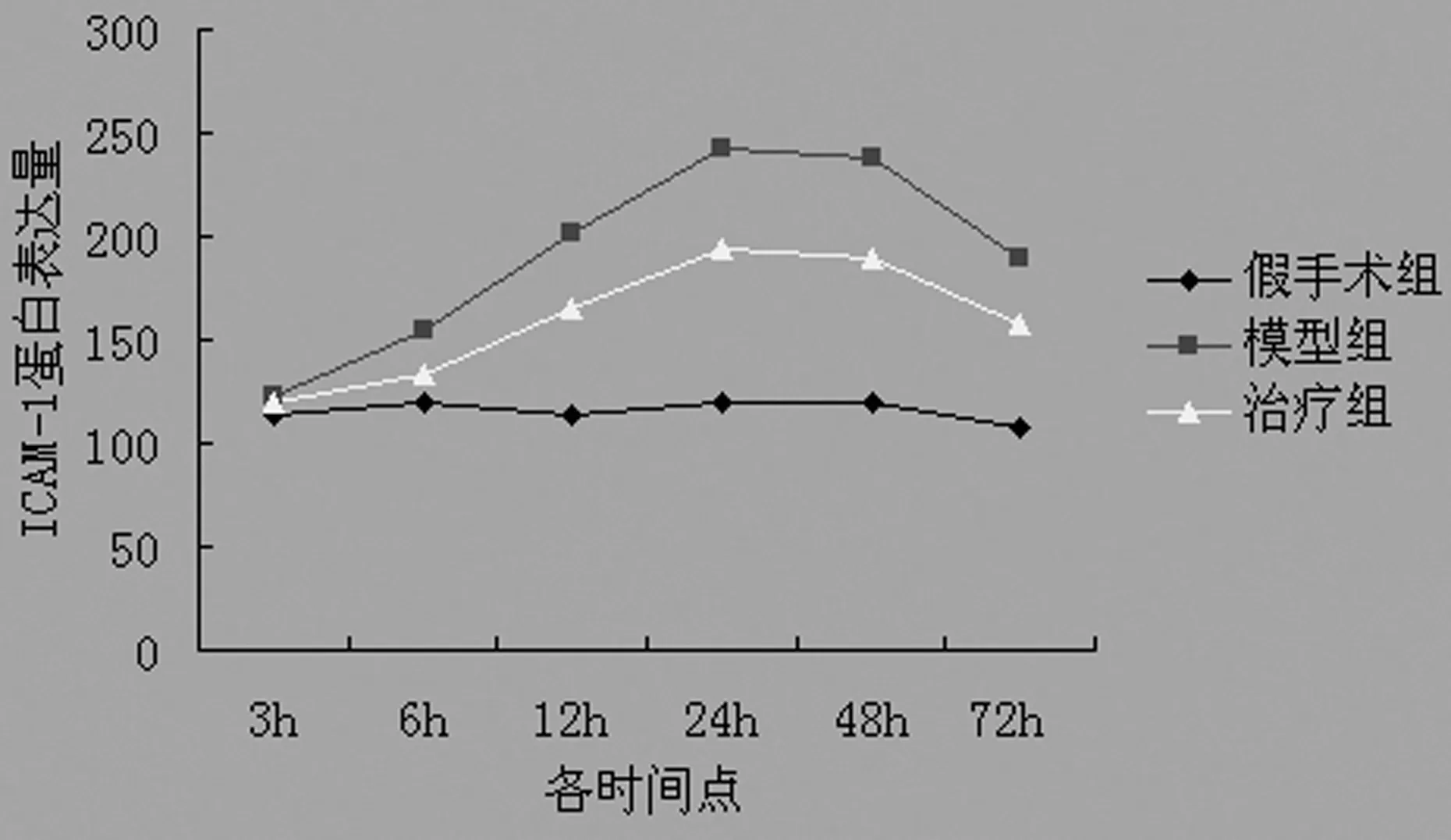
图2 各组大鼠不同时间点ICAM-1蛋白的
2.2Western blot检测结果 假手术组有极少量VCAM-1和ICAM-1蛋白的表达。与假手术组比较,模型组再灌注6 h VCAM-1和ICAM-1蛋白可见有少量表达,以后表达量逐渐增多,VCAM-1的表达高峰出现在再灌注24~48 h;而ICAM-1则在再灌注12~48 h一直持续较高,以后表达量逐渐减少。与模型组各时间点相比较,EPO干预组VCAM-1的表达量从12 h开始减少,24~72 h明显减少,而ICAM-1从6 h即开始减少,12~72 h明显减少。见表1、2,图1、2。
3 讨 论
近年来,对于EPO的神经保护作用的关注越来越多。但关于EPO对脑缺血-再灌注后炎症损伤的抑制作用,尤其是对于诱导炎症反应的关键物质黏附分子的抑制作用,国内外鲜有报道。
本实验通过线栓法制作成年大鼠局灶性脑缺血-再灌注模型,观察VCAM-1和ICAM-1蛋白在脑缺血-再灌注损伤中的作用,以及EPO对此过程的抑制作用。研究结果显示,在大鼠局灶性脑缺血-再灌注6 h,即有VCAM-1和ICAM-1蛋白的少量表达,不论是阳性细胞数还是表达量都较假手术组有所增加,之后表达量逐渐增多,VCAM-1的表达高峰出现在再灌注24~48 h,而ICAM-1的表达则在再灌注12~48 h一直持续较高,以后表达量有所减少。需要指出的是,内皮细胞无论在未被激活还是被激活后表达的ICAM-1均高于VCAM-1,并且ICAM-1在脑损伤后的上调表达要早于VCAM-1,而其下降又稍晚于VCAM-1。可见ICAM-1相对于VCAM-1容易表达且较稳定,也说明前者在脑损伤发生中起主要作用。
EPO是由肾脏和胚胎肝脏产生的一种能促进红细胞生成的细胞因子,主要用于治疗多种原因所致的贫血。但近年的研究发现,在许多非造血细胞系如肾、心肌、平滑肌和神经原细胞中也存在EPO及其受体(erythropoietin receptor,EPOR)基因表达[3]。动物实验和体外细胞培养已证实,EPO对脑缺血具有神经保护作用[4]。本实验于大鼠缺血后2 h给予EPO腹腔注射,研究结果显示,与模型组相比较,应用EPO后,EPO干预组VCAM-1和ICAM-1蛋白的阳性细胞数和蛋白表达量均有所下降。而且需要指出的是,ICAM-1于用药后6 h即开始下降,而 VCAM-1于用药后12 h才开始下降,表明在诱导炎症作用时作用相对较大的ICAM-1对EPO的反应也相对较VCAM-1敏感。由此可见,EPO可以通过抑制ICAM-1和VCAM-1蛋白表达的上调(主要是ICAM-1),实现对脑缺血-再灌注损伤后炎症损伤的抑制作用。
近几年来,关于EPO的神经保护作用研究方兴未艾,其机制除了抗炎作用以外,目前正在研究中的还有抗谷氨酸兴奋毒性[5]、调节一氧化氮(NO)的合成[6]、抗氧化作用、抗神经元凋亡[7-8]、促进血管生成[9]、促进神经元再生和神经营养作用等。其对脑血管的保护作用正逐渐成为临床和科研的新热点[10]。尤其是近来的研究发现,脑缺血动物脑内可见EPO和EPOR表达[11],外源性EPO可通过血脑屏障进入脑内[12],为EPO的临床应用垫定了理论基础。因此,EPO在脑缺血-再灌注损伤的应用方面有广阔的临床应用前景。
[1]O′Sullivan JB,Ryan KM,Harkin A,et al.Noradrenaline reuptake inhibitors inhibit expression of chemokines IP-10 and RANTES and cell adhesion molecules VCAM-1 and ICAM-1 in the CNS following a systemic inflammatory challenge[J].J Neuroimmunol,2010,220(1/2):34-42.
[2]Li Y,Lu ZY,Keogh CL,et al.Erythropoietin-induced neurovascular protection,angiogenesis,and cerebral blood flow restoration after focal ischemia in mice[J].J Cereb Blood Flow Metab,2007,27(5):1043-1054.
[3]Rabie T,Marti HH.Brain protection by erythropoietin:A manifold task[J].Physiology,2008,23:263-274.
[4]Liu R,Suzuki A,Guo Z,et al.Intrinsic and extrinsic erythropoietin enhances neuroprotection against ischemia and reperfusion in jury in vitro[J].J Neurochem,2006,96(4):1101-1110.
[5]侯红梅,董文斌.促红细胞生成素与脑保护[J].国外医学.神经病学神经外科学分册,2004,31(5):494-497.
[6]Ghezzi P,Brines M.Erythropoietin as an antiapoptotic,tissue-protective cytokine[J].Cell Death Differ,2004,11 Suppl 1:37-44.
[7]Wiese L,Hempel C,Penkowa M,et al.Recombinant human erythropoietin increases survival and reduces neuronal apoptosis in a murine model of cerebral malaria [J].Malar J,2008,7(2):3-11.
[8]Liao ZB,Jiang GY,Tang ZH,et al.Erythropoietin can promote survival of cerebral cells by downregulating Bax gene after traumatic brain injury in rats[J].Neurol India,2009,57(6):722-728.
[9]Kato S,Amano H,Ito Y,et al.Effect of erythropoietin on angiogenesis with the increased adhesion of platelets to the microvessels in the hind-limb ischemia model in mice[J].J Pharmacol Sci,2010,112(2):167-175.
[10]Sharples EJ,Christoph T,Yaqoob MM.Novel applications of recombinant erythropoietin[J].Curr Opin Pharmacol,2006,6(2):184-189.
[11]Kilic E,Kilic U,Soliz J,et al.Brain-derived erythropoietin protects from focal cerebral ischemia by dual activation of ERK-1/-2 and Akt pathways[J].FASEB J,2005,19(14):2026-2028.
[12]Eid T,Brines M.Recombinant human erythropoietin for neuroprotection:what is the evidence [J].Clin Breast Cancer,2002,3 Suppl 3:S109-115.
