锦鲤组织细胞体外培养的初步研究*
2012-01-05付思思吴志新
付思思,吴志新,王 敏,汤 蓉
(华中农业大学水产学院,湖北武汉430070)
锦鲤组织细胞体外培养的初步研究*
付思思,吴志新,王 敏,汤 蓉**
(华中农业大学水产学院,湖北武汉430070)
为建立来源于锦鲤的细胞系,本文采用组织块法,对来源于锦鲤(Cyprinus carpio)鳍条、吻端、肌肉、心脏、鳔、肠道、卵巢等组织的细胞进行原代培养和传代培养。在25℃下,添加20%胎牛血清、0.2μg/m L表皮生长因子(EGF)和25 ng/mL成纤维生长因子(FGF)的L-15培养基中进行培养。结果显示,鳍条、心脏、鳔、吻端、肌肉、肠道、卵巢分别在原代培养第3、6、12、13、15、3、3天,有细胞从组织块迁出;对长至单层的鳍条、心脏、肌肉细胞进行传代培养,鳍条细胞已传至第39代,心脏和肌肉细胞分别传到第2代和第4代;鳍条、心脏和肌肉细胞分别呈现上皮细胞样、上皮细胞样和上皮细胞样与成纤维状混合型。第6代锦鲤鳍细胞的染色体计数,结果显示,细胞染色体数目分布范围为55~154条,2n=100。病毒敏感性实验,发现锦鲤鳍条细胞对草鱼出血病病毒(GCRV)和鲤春病毒血症病毒(SVCV)都敏感,且在24h内出现细胞病变(CPE);但对斑点叉尾鮰病毒(CCV)不敏感。锦鲤鳍条细胞系的建立为后期建立更多的锦鲤细胞系和鱼类病毒研究奠定了基础。
锦鲤;原代培养;传代培养
锦鲤(Cyprinus carpio)又称“绯鲤”、“日本锦鲤”,是大型观赏鱼之一,是鲤鱼的变种,属鲤科,鲤属,根据色彩、斑纹等分布情况,锦鲤又分为红白、大正三色、昭和三色等13个品系。锦鲤因其体型好,颜色鲜艳,养殖规模越来越大。但随着养殖环境越来越恶劣,锦鲤的各种传染性疾病尤其是锦鲤疱疹病毒病开始广泛传播。锦鲤疱疹病毒病1998年首次爆发在以色列,但在1999年才确认其真正病原是锦鲤疱疹病毒(Koi Herpesvirus,KHV),此后在英国、欧洲大陆、美国、日本也都有暴发。2002年广东省某养殖场进口的锦鲤出现了暴发性疾病,死亡率高达80%以上,刘荭等[1]用nested-PCR证实了本次流行的主要病原可能是KHV,同时伴有副溶血弧菌和嗜水气单胞菌的继发感染。细胞培养分离技术是锦鲤疱疹病毒病最准确的诊疗方法,但研究表明KHV只能在源自原始宿主细胞中生长,因此,建立来源于锦鲤的细胞系,是进行锦鲤疱疹病毒的分离与鉴定,研究其致病机理,疫苗制备和免疫预防技术的重要基础[2]。本文对来源于锦鲤的各组织进行细胞培养,初步确定了锦鲤组织细胞的培养条件,并检测了细胞对鲤春病毒血症病毒(SVCV)、草鱼出血病病毒(GCRV)和斑点叉尾鮰病毒(CCV)的敏感性,为后期建立锦鲤细胞系和研究KHV奠定了基础。
1 材料与方法
1.1 材料
1.1.1 实验鱼 健康的锦鲤,体质量为50~70 g,实验前于实验室暂养1周。
1.1.2 试剂 MEM和L-15培养基、两性霉素B、庆大霉素、青-链霉素、表皮生长因子(EGF)、成纤维生长因子(FGF)、Dulbecco's磷酸盐缓冲液(DPBS)均购自Sigma公司;0.25%EDTA-胰蛋白酶、胎牛血清(FBS)购自Gibco公司;新生牛血清(NCS)购自杭州四季青公司;4-羟乙基哌嗪乙磺酸(HEPES)购自Amrseco公司。
1.2 实验方法
1.2.1 原代培养 按照Lu等[3]的方法进行锦鲤组织细胞的原代培养,并按照弗雷谢尼[4]的技术作原代培养日常维护。
实验前在25 cm2培养瓶(Greiner)中添加NCS(2~3 m L/个),于生化培养箱(SHP-150)中孵化过夜,第2天吸出培养瓶中的NCS,并将培养瓶置于25℃培养箱中干燥,利于后续实验中组织块贴壁。
实验时,用75%酒精浸泡鱼体数分钟进行消毒,然后将鱼体置于洁净托盘中于超洁净工作台中进行解剖,取鳍条、吻端、肌肉、心脏、鳔、肠道、卵巢等组织置于AIM培养基(Antibiotic-incubation medium,含有500 U/m L青霉素、500μg/m L链霉素、12.5μg/m L两性霉素B和250μg/m L庆大霉素的2×MEM培养基)中浸泡2 h,期间每半小时换1次AIM培养液。用灭菌消毒后的眼科剪将组织块剪成1 mm3左右的小块,将这些组织小块移到25 cm2培养瓶中,使其分散均匀,然后置于25℃生化培养箱中贴附2~3 h后,吸出残余的培养液后,向其中添加4 m L的L-15生长培养基(含有20%FBS、200 U/m L青霉素、200μg/m L链霉素、5μg/m L两性霉素B、100μg/m L庆大霉素以及0.2μg/m L EGF和25 ng/m L FGF),于25℃生化培养箱中进行原代培养,每日于倒置显微镜(Leica DMIL)下观察组织块贴壁及细胞从组织块中迁出与生长情况,拍照记录观察结果。培养3 d后吸出培养瓶中的旧培养基在3 000 r/min下离心5 min,保留上层2 m L培养基,再向瓶中添加2 m L新鲜培养基继续培养,此后每2 d更换1次培养基。
1.2.2 传代培养 按照Lu等[3]的方法进行传代培养,并按照弗雷谢尼[4]的技术作传代培养日常维护。
当细胞铺满瓶底时,弃去旧培养基,吸取2 m LEDTA,清洗细胞单层,在倒置显微镜下观察细胞确认没有掉下,倒掉EDTA,然后加入2 m L的0.25%EDTA-胰蛋白酶,在倒置显微镜下观察,待80%细胞收缩变圆时加入2~3 m L含有血清的L-15培养基终止消化,并用移液管(Costar)吹吸几次,使瓶底所有的细胞都脱落,然后将此细胞悬液吸到15 m L离心管(Greiner)中,1 000 r/min离心7 min,收集细胞沉淀,加入8 m L L-15生长培养基,将细胞混合均匀,装入2个细胞培养瓶中,在瓶上记录下细胞名称,代数以及日期以后,放入25℃生化培养箱中培养。
首次传代在细胞铺满瓶底70%左右(大约1周)时进行,收集细胞沉淀,加入4 m L L-15生长培养基,将细胞混合均匀,装入1个细胞培养瓶中。
1.2.3 染色体核型分析 按Earley[5]方法进行染色体核型分析,实验重复3次。
细胞接种于75 cm2培养瓶(Greiner)中生长约24 h,形成70%~80%融合的单层细胞,弃去旧培养基,加入10 m L新鲜生长培养基和0.2 m L秋水仙碱溶液(1μg/m L,DPBS配制),25℃下继续培养12~15 h后,用EDTA-胰蛋白酶消化收集细胞,经新鲜配制的固定液(冰醋酸∶甲醇=1∶3)固定25 min后,滴片,吉姆萨染色15 min,于显微镜(Motic BA400)下进行染色体计数并分析细胞染色体组型。
1.2.4 病毒敏感性测定 参考Zhao等[6]的操作流程进行病毒敏感性检测,实验重复3次。
将细胞接种于25 cm2培养瓶中,细胞单层达到80%时,用无血清L-15培养基清洗细胞2次,加入0.2 mL病毒(SVCV,CCV,GCRV,MOI=0.1)悬液(25 cm2细胞培养瓶)静置吸附2 h,每20 min轻轻晃动1次,吸弃病毒悬液,用无血清的培养基清洗细胞表面2次,加入含5%FBS的培养基,每日在倒置显微镜下观察细胞变化,并拍照记录。当CPE(Cytopathogenic effect,细胞致病作用)出现作为病毒敏感性指标,表明细胞对该病毒敏感。
2 结果与分析
2.1 原代培养
每日观察原代组织块,发现在鳍条、肠道、卵巢组织块贴壁的第3天即有细胞从组织边缘迁出,细胞呈现出上皮样和成纤维样(见图1B、F、G);心脏组织块贴壁的第6天细胞从组织块迁出,细胞呈现出上皮样(见图1A);鳔、吻端、肌肉分别是组织块贴壁以后第12、13、15天细胞从组织块中迁出(见图1C、D、E)。
鳍条和心脏组织块边缘长出界限清楚的细胞,并呈放射状生长,形成生长晕,在生长晕上,细胞排列疏密不一大小不等。经过1周的培养,鳍条组织块周围迁出的细胞单层达70%,同时发现离组织块近的区域的细胞比离组织块远的区域的细胞长得密,细胞生长发生接触抑制,部分细胞死亡。
2.2 传代培养
分别对鳍条、肌肉、心脏细胞进行传代培养,细胞在经过EDTA-胰酶消化传代后,经过4~6 h后即可贴壁生长,均匀的分布于瓶底。第2代鳍条细胞呈上皮细胞样与成纤维状混合型(见图1H),心脏细胞呈上皮细胞样,肌肉细胞呈现上皮样和成纤维样,相比较心脏细胞和肌肉细胞,传代培养的鳍条细胞增殖活跃,形态也均匀相似,5~6 d便可继续传代,目前鳍条细胞已传至第39代。
鳍细胞在经过多次传代以后,细胞状态稳定,细胞形态也逐渐由成纤维样和上皮样的混合形态转变为上皮细胞样(见图1I),而肌肉细胞传至第4代,心脏细胞在第2代时,由于细胞数量少,并且细胞不能快速增殖,使得传代不能继续。
2.3 染色体核型分析
对100个第6代锦鲤鳍条细胞染色体的计数结果显示,细胞染色体数目分布范围为55~154条,主要分布在97~102条之间(约70%),峰值为100条(见图2A)。每种生物染色体数是相对固定的,对于具有非众数染色体细胞,很可能是由于低渗过度或制片操作中导致少数染色体丢失所致,因此确定锦鲤细胞的染色体数目为2n=100(见图2B)。
2.4 病毒敏感性测定
检测第6代锦鲤鳍细胞对CCV、SVCV和GCRV的敏感性,结果显示该细胞对SVCV和GCRV这2种病毒都敏感,并在24 h内出现CPE,而对CCV不敏感,7 d内都不能出现CPE(见图3)。
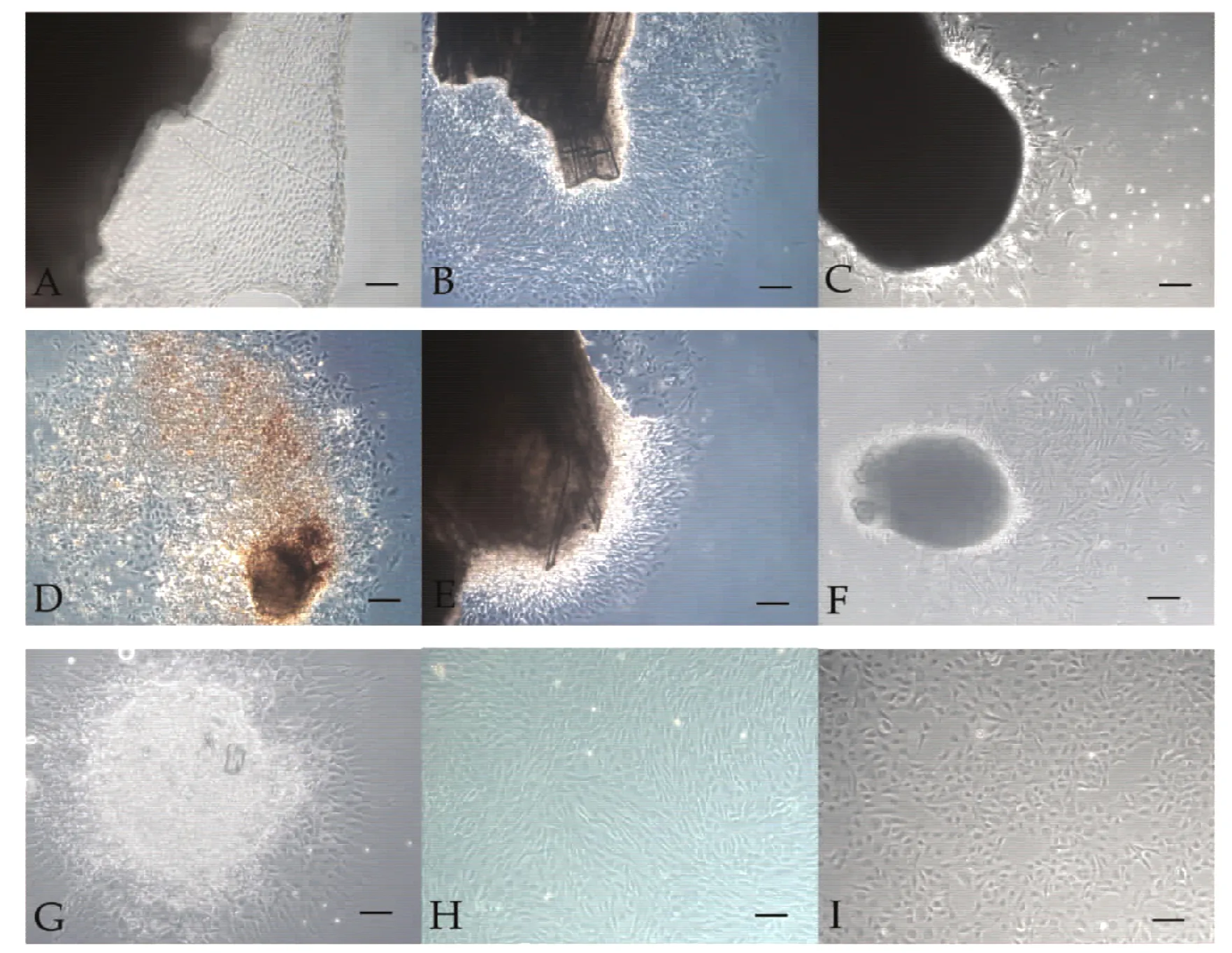
图1 不同组织迁出的原代细胞Fig.1 Primary cells of different tissues

图2 第6代锦鲤鳍条细胞的染色体分布(A)及细胞染色体照片(B)Fig.2 Frequency distribution of chromosomes of fin cells(A)and phase-contrast photomicrograph of fin cells(B)cellular chromosomes arrested in metaphase at passage 6

图3 感染不同病毒的锦鲤鳍条细胞Fig.3 Photomicrographs of fin cells infected by different fish viruses
3 讨论
鱼类细胞培养的系统研究和建立细胞系的实践大约开始于1960年代初,Wolf在1962建立了第1个公认的真骨鱼类永久性细胞系——虹鳟性腺细胞系(RTG-2),随后各种鱼类的细胞系也相继建立。据Fryer和Lannan统计,到1994年为止,至少已建立了159株鱼类细胞系,其中,淡水鱼类和溯河洄游性鱼类占多数,一共有125株,分别来源于21科的52种鱼类的不同组织;而海水鱼类细胞系的研究工作发展相对缓慢,仅有34株,分别来源于13个科的22种海水鱼类的不同组织[7]。我国鱼类的组织培养是1980年代初由于病毒性鱼病研究的展开而开始的。1981年,张念慈和杨广智成功的建立了草鱼吻端组织细胞株ZC-7901及其上皮样细胞亚株ZC-7901S1[8]。1986年,左文功成功建立了草鱼肾脏组织细胞系CIK[9]。到1995年,我国建立的细胞系已有29个,涉及到11种鱼类的吻端,肾脏,卵巢,尾鳍,鳔,性腺,肝脏,胚胎,囊胚,原肠腔和鳍条等[10]。本文采用组织块法进行锦鲤鳍条、吻端、肌肉、心脏、鳔、卵巢和肠道的原代培养,以期建立相应的细胞系。
组织块法是动物细胞培养中常用方法之一,适用于各种组织的原代培养,具有快速、简单、高效等优点,与消化法相比较,从组织块迁出的细胞贴壁稳定、生长迅速,可生成稳定的单层细胞。实验发现,在原代培养过程中,离组织块近的细胞比离组织块远的区域长得密,细胞还没有铺满瓶底时,组织块邻近的细胞发生接触抑制,部分细胞死亡,因此当细胞铺满瓶底70%左右(大约1周)时进行第1次传代,且由于细胞量少,同时早期传代细胞对消化酶较敏感,极易消化过度而出现大量死亡,故第1次传代,不采用分瓶扩大培养方法,仅接种于1个培养瓶中。
孟彦等[11]建立的施氏鲟(Amur sturgeon,Acipenser schrencki Brandt)不同组织来源的细胞系,2~3 d即发现有细胞从组织块周围迁出;曾令兵等[12]建立斑点叉尾鮰(Ictalurus punctatus Rafinesque)肾脏组织细胞系,在组织块贴壁以后36~48 h细胞从组织块中迁出,3~4 d便长成单层;樊廷俊等[13]建立大菱鲆(Scophthalus maximus)鳍细胞系,组织块在不同的培养条件下启动原代培养,细胞从组织块中迁出的时间不一,但是也都长达40 d;谭凤霞等[14]建立稀有鮈鲫(Gobiocypris rarus)细胞系,组织块贴壁第2天就有细胞从组织块中迁出。本实验中,鳍条、心脏、鳔、吻端、肌肉、肠道、卵巢分别在原代培养第3、6、12、13、15、3、3天时有细胞从组织块中迁出。细胞从组织块中迁出的快慢除了与不同鱼类、不同个体、不同组织细胞的生理特异性有关外,还与组织细胞培养中的不同环境有关。
本文是对来源于锦鲤组织的细胞系建立的初步研究,结果表明在25℃时,采用添加20%胎牛血清、表皮生长因子和成纤维生长因子的L-15培养基启动原代培养是可行的。鱼类是变温动物,对于冷水性鱼类来讲,其细胞培养的温度是4~24℃,温水性鱼类则是15~37℃,锦鲤为温水性鱼类,采用的是其他多数温水性鱼类细胞培养温度,为25℃。
相比较肌肉细胞和心脏细胞,其中鳍条细胞生长快速,第1次传代后约6 d左右可以长满瓶底,说明鳍条细胞比心脏细胞和肌肉细胞更适应L-15培养基,这与其他学者的研究相一致[11,13-14],但也有相关学者的研究表明鱼类的鳍细胞的最适培养基不是L-15培养基[15-18],这可能是由于实验鱼的种系不同所致。MEM培养基成分简单,仅含有12种必须氨基酸、谷氨酰胺和8种维生素;DMEM(高糖型)适用于以糖代谢为主的细胞和分裂活动较为旺盛的细胞培养;L-15是1种设计独特的培养基,以平衡盐溶液做基础,通过高浓度的氨基酸来提高缓冲能力,在正常大气环境下提供精确p H,以半乳糖代替葡萄糖作为碳源,有效防止代谢过程中产生对细胞有毒性的乳酸。基于L-15培养基的种种优点,L-15培养基在鱼类细胞培养中应用较多,尤其是鱼类鳍条细胞[19]。细胞接种密度的大小主要影响细胞生长成汇合单层的时间以及持续培养细胞单层的稳定性,在传代培养过程中,肌肉细胞和心脏细胞的生长速度没有鳍条细胞快,这可能是由于从原代组织块获得的肌肉细胞和心脏细胞量太少。肌肉细胞和心脏细胞在传了几代以后就不能继续传代,这可能是由于传代过程中细胞被胰蛋白酶过度消化而死亡,或者是细胞本身就不能耐受胰蛋白酶的消化。
整倍体染色体组型在描述1个细胞系的特征上是1个重要的参数。染色体组型分析表明,锦鲤鳍细胞的染色体数目70%以上为2n=100,这与正常的锦鲤染色体数是相一致的[20-21]。这个二倍体染色体数的比率与其他报道的鱼类细胞系相似或略低[22-23]。
本文检测锦鲤鳍条细胞对GCRV和SVCV的敏感性时,均出现了CPE,而对CCV不敏感,这可能与宿主细胞的种类有关。锦鲤鳍条细胞的建立可为进一步研究草鱼出血病病毒和鲤春病毒血症病毒提供参考依据。研究表明KHV只能在源自原始宿主细胞中生长,建立来源于锦鲤的细胞系,是KHV的分离与鉴定、致病机理研究及疫苗制备的重要基础。
综上所述,通过对来源于锦鲤的鳍条、吻端、肌肉、心脏、鳔、肠道、卵巢等组织的细胞进行原代培养和传代培养,成功的建立了锦鲤鳍条细胞系,初步对其进行了鉴定,并研究了锦鲤鳍细胞对几种鱼类病毒的敏感性,为后期建立更多的锦鲤细胞系和锦鲤疱疹病毒的研究奠定了基础,对病毒疫苗制备和细胞毒理学研究也具有实际应用价值。
[1] 刘荭,史秀杰,高隆英,等.进口锦鲤暴发病病原的nest-PCR鉴定[J].华中农业大学学报,2002,21(5):414-418。
[2] 周永灿,袁军法,任武泽,等.锦鲤疱疹病毒的检测与人工感染试验[J].武汉大学学报:理学版,2005,51(S2):249-252.
[3] Lu Y A,Aguirre A A,Hamm C,et al.Establishment,cryopreservation,and growth of 11 cell lines prepared from a juvenile Hawaiian monk seal,Monachus schauinslandi[J].Methods in Cell Science,2000,22:115-124.
[4] R.I.弗雷谢尼.动物细胞培养——基本技术指南[M].第四版.北京:科学出版社,2004.
[5] Earley E M.Chromosome preparations from monolayer cell cultures[J].TCA Manual,1975,1:31-35.
[6] Zhao Z S,Brock D M,Lee C S,et al.Establishment,characterization and viral susceptibility of 3 new cell lines from snakehead,Channa striatus(Blooch)[J].Methods in Cell Science,2003,25:155-166.
[7] Fryer J L,Lannan C N.Three decades of fish cell culture:A current listing of cell lines derived from fishes[J].Tissue Culture Methods,1994,16:87-94.
[8] 张念慈,杨广智.草鱼吻端组织细胞株ZC-7901及其亚株ZC-7901S1的建立和特性观察[J].水产学报,1981,5(2):111-119.
[9] 左文功,钱华鑫,许映芳,等.草鱼肾组织细胞系CIK的建立及其生物学特性[J].水产学报,1986,10(1):11-17.
[10] 钱华鑫,曾勇,王凯,等.淡水鱼类细胞库的构建[J].中国水产科学,1995,2(5):119-123.
[11] 孟彦,张燕,张林,等.施氏鲟不同组织来源细胞离体培养的初步研究[J].细胞生物学杂志,2007,29:718-722.
[12] 曾令兵,李晓莉,张林,等.斑点叉尾鮰肾脏组织细胞系的建立及其生物学特性[J].中国水产科学,2009,16(1):75-81.
[13] 樊廷俊,耿晓芬,丛日山,等.大菱鲆鳍细胞系的建立[J].中国海洋大学学报:自然科学版,2007,37(5):759-766.
[14] 谭凤霞,杨方星,王卫民,等.稀有鮈鲫细胞系的建立及其作为测定重金属毒性模型的探讨[J].水生生物学报,2009,33(4):234-238.
[15] 樊廷俊,孙爱,杨秀霞,等.大黄鱼鳍细胞系的建立及久效磷对其毒性作用的研究[J].中国海洋大学学报:自然科学版,2010,40(12):64-70.
[16] 樊廷俊,郭雪阳,姜国建,等.圆斑星鲽连续性鳃细胞系的建立[J].中国海洋大学学报:自然科学版,2010,40(9):69-74.
[17] Wei Y B,Fan T G,Jiang G J,et al.Establishment of a novel fin cell line from Brown-marbled grouper,Epinephelus fuscoguttatus(Forsskal),and evaluation of its viral susceptibility[J].Aquaculture Research,2009,40:1523-1531.
[18] Wei Y B,Fan T G,Jiang G J,et al.A novel Heart Cell Line from Brown-marbled Grouper,Epinephelus fuscoguttatus(Forsskal),and Its Viral Susceptibility to Iridovirus[J].Journal of Fish Biology,2010,76(5):1149-1158.
[19] 王文君.大泷六线鱼肝脏和脾脏细胞学观察及其原代培养的研究[D].青岛:中国海洋大学,2008.
[20] 梁拥军,孙向军,李文通,等.红白锦鲤的染色体核型分析[J].安徽农业科学,2010,38(14):7717-7719.
[21] 尹洪滨.四种鲤鱼染色体核型比较研究[J].水产学杂志,2001,14(1):7-10.
[22] Chen S L,Ren G C,Sha Z X,et al.Development and character-ization of a continuus embryonic cell line from turbot(Scophthalmus maximus)[J].Aquaculture,2005,249:63-68.
[23] Ku C C,Teng Y C,Wang C S,et al.Establishment and characterization of three cell line derived from the rockfish grouper Epinephelus quoyanus:Use for transgenic studies and cytotoxicity testing[J].Aquaculture,2009,294:147-151.
Study on the in vitro Primary Culture of Tissue Cells from Ornamental Carp,Cyprinus carpio
FU Si-Si,WU Zhi-Xin,WANG Min,TANG Rong
(College of Fisheries,Huazhong Agricultural University,Wuhan 430070,China)
To establish cell lines from ornamental carp(Cyprinus carpio),primary cultures of fin,snout,muscle,heart,swim bladder,intestine and ovary of ornamental carp were initiated at 25℃in L-15 medium supplemented with 20%fetal bovine serum,0.2μg/m L epidermal growth factor(EGF)and 25 ng/m L fibroblast growth factor(FGF)by using the tissue explants technique.The cells of fin,heart,swim bladder,snout,muscle intestine and ovary tissue migrated out around the tissues at day 3,6,12,13,15,3 and 3 respectively.The confluent monolayers of cells were rinsed twice with 0.25%trypsin-EDTA solution.The second generation of heart cells,the third generation of muscle cells and the thirtyninth generation of fin cells were obtained.The morphologies of heart cells and fin cells were both epithelioid,muscle cells were both epithelioid and fibroblast-like.Karyotype analysis showed the number of chromosome ranged from 55 to 154 in the fin cells at passage 6 with a distinct peak at 100 diploid chromosomes.The fin cells were sensitive to Grass Carp reovirus(GCRV)and Spring viremia of carp virus(SVCV),and visible cytopathic effect(CPE)appeared in 24 hours.But the fin cells were not sensitive to Channel Catfish virus(CCV).The fin cell line could lay a foundation for the establishment of more cell lines from ornamental carp and the research of fish virology.
ornamental carp(Cyprinus carpio);primary culture;subculture
S965.116
A
1672-5174(2012)03-044-06
农业部引进国际发进农业科学技术计划项目(2005Z37);华中农业大学青年教师科技创新专项(52204-10026)资助
2011-05-19;
2011-06-21
付思思(1986-)女,硕士,研究方向:水产动物疾病学。E-mail:fsssyp1-45@webmail.hzau.edu.cn
**通讯作者:E-mail:tangrong@mail.hzau.edu.cn
责任编辑 王 莉
