基于金纳米棒/多壁碳纳米管-壳聚糖复合膜电极的肌红蛋白直接电化学和电催化研究
2012-01-04黄富英李艳彩冯树清李元军
黄富英,李艳彩,冯树清,王 飞,李元军
(漳州师范学院 化学与环境科学系,福建 漳州 363000)
研究蛋白质(酶)的直接电化学和电催化,对于认识生命体内的电子传递机理和酶的催化机理以及重要生命物质在生命体内的代谢过程具有重要意义[1].纳米材料由于具有优异的物理化学性能近年来备受关注,常用的纳米材料有金属纳米材料[2-3]、金属氧化物纳米材料[4-5]、碳纳米管[6]和半导体材料[7-8]等.随着纳米材料研究的深入,蛋白质分子在纳米材料上固定的研究受到广泛关注[9-11].肌红蛋白(Mb)参与的涉及电子传递的代谢过程及生理功能,是研究血红素类蛋白质(酶)的直接电化学、电催化和生物传感的理想模型.
碳纳米管(CNT) 独特的结构能大大促进蛋白质(酶)的直接电子转移和有效的保持其生物活性.近年来,已有不少文献报道将碳纳米管修饰到电极表面,用于化学以及生物传感器的构建[12-13].经研究发现,碳纳米管独特的结构使其具有很高的电子传递效率及良好的生物相容性等特性,这些特性使其成为电化学传感领域的研究焦点[14-15].近来,将碳纳米管和某些活性材料如聚合体,氧金属纳米粒子、化还原电子媒介等进行复合的研究也引起了研究者的广泛关注[16-17].然而,碳纳米管具有很强的范德华力,一般很容易集结成束,从而不易溶解,限制了其在电化学中的应用.壳聚糖是自然界唯一的碱性多糖,是甲壳素(chitin) 的脱乙酰基产物[18],是一种线型聚合物,在其重复的单元上具有羟基、氨基.壳聚糖具有良好生物相容性,分子中的氨基(-NH2)能通过离子吸附的形式有效地应用于固定蛋白质(酶),从而成为生物传感器的理想成膜材料.而且,由于壳聚糖(chit)在特定的条件下,能发生各种化学反应,成膜后具有很好的稳定性、吸附性和生物相容性,加上其含有活泼的氨基和羧基使它被广泛运用于修饰电极的制备和生物分子的固定.因此,本文将多壁碳纳米管(MWCNTs)溶解在壳聚糖溶液中,得到具有良好粘性和成膜性的多壁碳纳米管-壳聚糖(MWCNTs-Chit)溶液.
本文探讨了AuNRs促进Mb在MWCNTs-Chit 复合物膜电极上的直接电子转移和电催化行为.通过滴涂法将AuNRs、Mb 和MWCNTs-Chit混合分散液依次修饰到玻碳电极表面,用循环伏安法表征修饰电极,得到了相应的动力学参数.Chit在其中起到成膜的作用,MWCNTs充当电子转移的通道,AuNRs起到了电子导线的作用.修饰电极实现了Mb 的直接电化学并对H2O2的还原具有良好的电催化效应,可用作检测H2O2的电化学生物传感器.
1 实验部分
1.1 试剂
马心肌红蛋白(美国Sigma公司);AgNO3,HAuCl4·3H2O,NaBH4,十六烷基三甲基溴化铵(CTAB) 均购于国药集团化学试剂有限公司;多壁碳纳米管(MWCNTs,纯度超过95 %)购自深圳纳米港;H2O2(30wt. %)购于汕头西陇化学试剂有限公司.壳聚糖(chit)购于厦门星隆达化学试剂有限公司;0.1 mol/L磷酸盐缓冲溶液(PBS);0.025 g壳聚糖溶解于5 mL 1%的乙酸溶液中得到壳聚糖溶液(0.5 wt.%).其他所用到的化学试剂均为分析纯试剂;所用溶液均用二次蒸馏水来配制.
1.2 仪器及分析方法
紫外可见光谱仪(GBC Cintra 10e);电化学工作站(CHI 650C,上海辰华);电化学实验采用三电极系统:工作电极为玻碳电极(3 mm直径),参比电极为Ag/AgCl电极(3.0 mol/LKCl),辅助电极为铂丝电极.在电化学实验前对溶液进行通氮气除氧.
1.3 金纳米棒的制备
参照文献[19],采用十六烷基三甲基溴化铵(CTAB)为模板的银离子辅助种子生长法来合成金纳米棒.合成过程如下,将100 μL 0.02 M HAuCl4加入到1.5 mL 0.1 mol/L CTAB溶液中并不断搅拌.再加入100 μL 0.01 M的NaBH4溶液,最后混合溶液变为棕黄色.将溶液剧烈搅拌2 min后,保存于25℃水浴中.合成后将种子液放置2 h再使用.金纳米棒生长液的合成方法为:将1.5 mL 0.02 M HAuCl4溶液和1.0 mL 0.01 M AgNO3溶液分别加入到30 mL 0.1 M的CTAB溶液中,然后再加入0.8 mL 0.08 M的抗坏血酸溶液.两种溶液都制备好以后,在生长液中加入70 μL种子液,温度为25℃.在开始的15 min内,溶液的颜色会渐渐变化最后稳定.
1.4 MWCNTs-Chit/Mb/AuNRs复合膜电极的制备
试验中所用到的玻碳电极依次用1.0 μm,0.3 μm和0.05 μm的Al2O3进行抛光,并分别使用乙醇和蒸馏水超声清洗3次,用循环伏安法检测电极的可逆性,最后用氮气吹干.首先将10 μL的AuNRs溶液滴加到处理干净的电极上,自然晾干.然后再滴加10 μL 3.0 mg/mL的Mb溶液(pH=6.5磷酸缓冲溶液)到电极表面,在冰箱内放置12 h,最后滴加0.5%(w/v)的MWCNTs-Chit复合物到电极表面,置于冰箱5 h后,得到MWCNTs-Chit/Mb/ AuNRs复合膜电极.
2 结果与讨论
2.1 AuNRs的表征
采用十六烷基三甲基溴化铵(CTAB)为模板的银离子辅助种子生长法合成的AuNRs的透射电镜图如图1A所示.

图1 AuNRs的TEM图(A)和AuNRs的紫外-可见吸收光谱图(B)
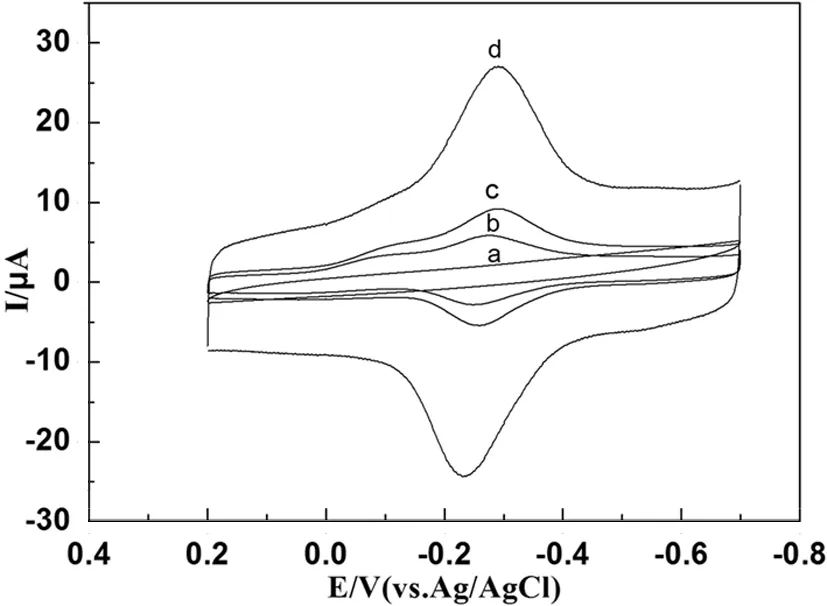
图2 0.1M pH=7.0的磷酸缓冲溶液中(a)裸玻碳电极(b)MWCNTs-Chit/Mb/GCE (c) AuNRs/Mb/GCE (d)MWCNTs-Chit/Mb/AuNRs/GCE循环伏安图,扫速为100 mV·s-1

图3 MWCNTs-Chit/Mb/AuNRs/GCE在不同扫速下在0.1 mol·L-1 pH=7.0磷酸缓冲溶液中循环伏安曲线(由内→外:10,25,50,75,100,150,200,250,300,350,400,450,500 mV·s-1)

图4 阴极峰电流、阳极峰电流与扫速的关系曲线
从电镜图中可以看到AuNRs的形貌为棒状,棒长为40~50 nm,棒宽为15~20 nm.图1B为AuNRs的紫外-可见吸收光谱.从紫外图中可以看出在520 nm与660 nm各有一处吸收峰,其分别是AuNRs的宽度与长度的表面等离子体共振波长.
2.2 MWCNTs-Chit/Mb/AuNRs复合膜电极的直接电化学
图2是不同电极在0.1 M pH=7.0的磷酸缓冲溶液中测得的循环伏安图.由图2a可以看出,在裸玻碳电极上除了具有较小的背景电流外,没有出现氧化还原峰.而AuNRs/Mb/GCE(图2c)表现出一对可逆的氧化还原峰,但是电流响应远小于MWCNTs-Chit/Mb/AuNRs修饰的电极(图2d),说明在AuNRs和MWCNTs-Chit的复合膜电极上实现了Mb的直接电子转移.在MWCNTs-Chit/Mb/AuNRs/GCE(图2d)上可以观察到一对可逆的氧化还原峰,阴极峰电位(Ep,c)和阳极峰电位(Ep,a)分别为-0.291和-0.235 V,式电位[Eθ’=(Ep,c+Ep,a)/2]为-0.263 V,电流响应信号来自膜内Mb的电活性中心血红素的氧化还原[MbFe(Ⅲ)/MbFe(Ⅱ)],这表明Mb与电极之间较好的实现了直接电子转移,并保持了其自身的生物活性.另外,AuNRs/Mb/GCE(2c)修饰的电极电流响应大于MWCNTs-Chit/Mb/GCE(2b)修饰的电极,这主要源于AuNRs具有较好的生物相容性和导电性能够有效地促进蛋白与电极表面间电子转移.
图3是在pH为7.0磷酸缓冲溶液中MWCNTs-Chit/Mb/AuNRs复合膜电极在不同扫速下的循环伏安图.从图中可以看出在扫速在10~500 mV/s范围内循环伏安曲线基本上是对称的,氧化峰电流与还原峰电流随扫速的增大而增大,而电位变化很小.由图4可知,氧化峰电流、还原峰电流分别与扫速呈线性关系:
Ipc=-0.115 6+0.030 7 v(V·s-1), R=0.999 2; Ipa=-0.636 5-0.043 3 v(V·s-1), R=0.998 5),
这说明固定在MWCNTs-Chit/Mb/AuNRs复合膜电极中的Mb是典型的表面控制电化学过程[20].峰电位在10~500 mV·s-1范围内随着扫速的改变而发生改变,还原峰电位随着扫速的增加而负移,氧化峰电位随着扫速的增加而正移,然而式电位没有改变,这说明电极上进行的反应主要受吸附控制.
2.3 pH值对电极电位的影响
在多数情况下,蛋白的电化学行为受溶液的pH值影响很大.一般情况下,溶液的pH值决定了氧化还原的式电位,这表明了在蛋白的氧化还原过程中质子参与了反应.图5给出了MWCNTs-Chit/Mb/AuNRs复合膜电极在不同的pH值缓冲溶液中且扫速为100 mV·s-1下测得的循环伏安图.通过实验得到一对峰形良好并且稳定的氧化还原峰,缓冲溶液pH值的增大会导致Mb的氧化还原峰的峰电位向负移,这充分说明了在Mb的电极反应过程中有质子参与[21].图6给出了[Mb Fe(Ⅲ)]/[Mb Fe(Ⅱ)]电对的式电位(Eθ′)与pH值之间的关系.从图中可以看出,在pH从5到11之间,[Mb Fe(Ⅲ)]/[Mb Fe(Ⅱ)]电对的式电位与pH呈线性关系,计算得斜率为-51.05 mV/pH,这一数值比理论值58 mV/pH小得多, 一方面可能是由于亚铁血红素中的铁和亚铁血红素周围氨基酸反式配体的质子化作用的影响,另一方面也可能是由于中心铁受到水分子质子化的影响.因此,在电子传递反应过程中,电极与Mb之间可以用下式简单表示:
Mb heme Fe(Ⅲ)+H++e-↔Mb heme Fe(Ⅱ)

图5 MWCNTs-Chit/Mb/AuNRs/GCE在不同pH值(5, 7, 9, 11)磷酸缓冲溶液中的循环伏安曲线 图6 MWCNTs-Chit/Mb/AuNRs/GCE中[Mb Fe(Ⅲ)]/[Mb Fe(Ⅱ)]电对的式电位与pH的关系曲线

图7 MWCNTs-Chit/Mb/AuNRs/GCE在含H2O2浓度分别为:(a)0 mM;(b)3 mM;(c)6 mM;(d)9 mM;(e)12 mM;(f)15 mM;(g)20 mM的pH=7.0磷酸缓冲溶液中的循环伏曲线,扫速为50 mV·s-1 内插图:催化峰电流与H2O2浓度关系曲线
2.4 MWCNTs-Chit/Mb/ AuNRs复合膜电极对H2O2的电催化还原
通过循环伏安法来研究MWCNTs-Chit/Mb/AuNRs复合膜电极对H2O2的电催化性能.图7给出了在-0.23 V附近随着H2O2浓度的逐渐增大(a→g)还原峰电流迅速增大,与此同时伴随着氧化峰电流的逐渐变小.这表明Mb对H2O2进行的催化反应过程是一个典型的电催化还原反应过程.该反应的原因是肌红蛋白中的[Mb/Fe(Ⅱ)]具有还原性,能将H2O2还原而自身被氧化成[Mb/Fe(Ⅲ)],最后又重新被还原回[Mb/Fe(Ⅱ)],这一反应过程体现了Mb与电极之间的直接电子转移.其中内插图给出了MWCNTs-Chit/Mb/AuNRs修饰电极上Mb峰电流与H2O2浓度之间的线性关系曲线.
2.5 MWCNTs-Chit/Mb/AuNRs/GCE对H2O2的电流-时间响应
图8是工作电位为-0.25 V时,传感器在0.1M(pH=7.0)磷酸缓冲溶液中测得的电流-时间响应曲线.传感器对加入的H2O2表现出快速而灵敏的响应.当加入少量的H2O2(20μL)到底液中时,还原电流迅速增大直至稳定.由图8可以看出,随着加入H2O2浓度的增加,响应电流逐渐增大.图8中内插图给出了稳态电流与H2O2浓度的关系曲线,在浓度范围在5.0×10-5到5.0×10-3M之间,电流与H2O2浓度存在较好的线性关系.其中线性回归方程为:I(μA)=4.648+9.041×10-6C(μM),相关系数为0.986 7(n=10).由曲线的斜率可知,当信噪比为3时,其检测限为3.2×10-6M.传感器的快速响应可归因于AuNRs与MWCNTs之间的协同作用,具有较大比表面的AuNRs和MWCNTs都可以有效地促进Mb与电极之间的电子转移.此外,传感器的电流在不到5 s时间内达到稳定,表明这是一个较快的反应过程.
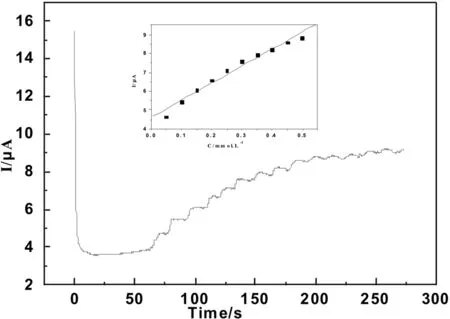
图8 向5 mL 0.1 M的磷酸缓冲溶液中依次加入20 μL 10 mM的H2O2 时的电流-时间曲线,工作电位为-0.25 V;内插图:电流与H2O2浓度关系曲线


2.6 MWCNTs-Chit/Mb/AuNRs复合膜电极的稳定性、重现性
为了观察电极的重现性,制备6根相同的电极来检测电极对10 mM H2O2的电流响应.最后得到的相对标准偏差(RSD)为3.5%.为了研究电极的稳定性,将制备的电极保存在冰箱中来检测电流的大小变化.当将修饰电极在4℃下保存7 d后,没有表现出明显的电流减小;而保存20 d以后仍然保持原有的电流响应的90%.传感器具有良好的稳定性和重现性说明了Chit与AuNRs具有良好的生物相容性以及适于固载蛋白质在电极上,由此可见,AuNRs比较温和,导电性好,能很好的固载Mb实现其电子转移,并且保持其生物活性.
3 小结
通过用MWCNTs-Chit/Mb/AuNRs复合膜将Mb固载到玻碳电极上来制备传感器.实验结果表明修饰电极上涉及到的[Mb-Fe(III)/Fe(II)]氧化还原电对之间的电子转移速率与裸电极上的Mb的电子转移速率相比要快得多.说明MWCNTs与AuNRs具有良好的导电性和生物相容性,为Mb提供了一种类似于本体的微环境,有利于Mb的直接电子转移.此外,该传感器对H2O2具有较好的电催化还原作用,所以该复合膜为基于酶的直接电化学制备第三代生物传感器方面提供了一种新思路.
[1] Ozaki S,Matsui T,Roach M P,et al.Rational molecular design of a catalytic site: engineering of catalytic functions to the myoglobin active site framework [J].Coor Chem Rev, 2000, 198(1): 39 -59.
[2] Wang L,Wang E K.Direct electron transfer between cytochromec and gold nanoparticles modified electrode [J]. Electrochem Commun, 2004, 6 (1): 49-54.
[3] Gan X,Liu T,Zhong J,et al.Effect of Silver Nanoparticles on the Electron Transfer Reactivity and the Catalytic Activity of Myoglobin[J].Chem biochem, 2004, 5(12): 1686-1691.
[4] Li Y M, Zhang Q,Li J H.Direct electrochemistry of hemoglobin immobilized in CuO nanowire bundles[J].Talanta, 2010, 83(1): 162-166.
[5] Jia N Q, Wen Y L,Yang G F,et al.Direct electrochemistry and enzymatic activity of hemoglobin immobilized in ordered mesoporous titanium oxide matrix [J].Electrochem Commun, 2008, 10(5): 774-777.
[6] Zou Y J, Xiang C L, Sun L X,et al.Amperometric glucose biosensor prepared with biocompatible material and carbon nanotube by layer-by-layer self-assembly technique[J].Electrochim Acta, 2008, 53(12): 4089-4095.
[7] Huang Y X,Zhang W J,Xian H,et al.An electrochemical investigation of glucose oxidase at a CdS nanoparticles modified electrode [J]. Biosens Bioelectron,2005,21(5):817-821.
[8] Wang L Y,Kan X W,Zangh M C,et al.Fluorescence for the determination of protein with functionalized nano-ZnS[J].Analyst,2002,127(11):1531-1534.
[9] Zhao J,Henkens R W,Stonehuerner J,et al.Direct electron transfer at horseradish peroxidase—colloidal gold modified electrodes[J].Electroanal Chem,1992,327(1/2):109-119.
[10] Ye J N,Baldwin R P.Catalytic reduction of myoglobin and hemoglobin at chemically modified electrodes containing methylene blue [J].Anal. Biochem,1988,60(20):2263-2268.
[11] Shipway A N,Lahav M,Willner I.Nanostructured gold colloid electrodes[J].Adv Mater,2000,12(13):993-998.
[12] Wang J X,Li M X,Shi Z J,et al.Direct Electrochemistry of Cytochrome c at a Glassy Carbon Electrode Modified with Single-Wall Carbon Nanotubes[J].Anal Chem,2002,74(9):1993-1997.
[13] Luo H X, Shi Z J, Li N Q,et al.Investigation of the Electrochemical and Electrocatalytic Behavior of Single-Wall Carbon Nanotube Film on a Glassy Carbon Electrode [J].Anal Chem, 2001, 73 (5):915-920.
[14] Ozoemena K I,Nkosi D,Pillay J.Influence of solution pH on the electron transport of the self-assembled nanoarrays of single-walled carbon nanotube-cobalt tetra-aminophthalocyanine on gold electrodes: Electrocatalytic detection of epinephrine [J].Electrochim Acta,2008,53(6):2844-2851.
[15] 张旭志,焦奎.单壁碳纳米管和室温离子液体胶修饰电极[J].物理化学报,2008,8:1439.
[16] Gan Z H,Zhao Q,Gu Z N,et al.Electrochemical studies of single-wall carbon nanotubes as nanometer-sized activators in enzyme-catalyzed reaction [J]. Anal Chim, Acta, 2004, 511 (2):239-247.
[17] Quinn B M, Dekker C,Lemay S G.Electrodeposition of Noble Metal Nanoparticles on Carbon Nanotubes [J].J Am Chem Soc,2005,127(17):6146-6147.
[18] Ma N, Wang Q, Sun S L,et al.Progress in Chemical Modif ication of Chitin and Chitosan [J]. Progress in Chemistry,2004,16 (4):643-653.
[19] Huang H W, He C C,Zeng Y L,et al.Preparation and optical properties of worm-like gold nanorods[J].J Colloid Interface Sci,2008,322(1):136-142.
[20] Chi Z H,Asher S A.UV Resonance Raman Determination of Protein Acid Denaturation: Selective Unfolding of Helical Segments of Horse Myoglobin[J]. Biochemistry,1998,37(9):2865 -2872
[21] Gu HY, Tu A M, Chen HY. Direct electron transfer and characterization of hemoglobin immobilized on a Au colloid-cysteamine-modified gold electrode[J].J Electroanal Chem,2001, 516 (1/2):119-126.
[22] Kamin R A,Willson G S.Rotating ring-disk enzyme electrode for biocatalysis kinetic studies and characterization of the immobilized enzyme layer [J].Anal Chem,1980,52(8):1198-1205.
