尿素对抗坏血酸和谷胱甘肽美拉德反应形成香味化合物的影响
2012-01-04钟存贵余爱农
钟存贵,余爱农
(湖北民族学院 化学与环境工程学院,湖北 恩施 445000)
美拉德反应是指氨基化合物(如胺、氨基酸、低级肽、蛋白质等)与羰基化合物(如还原糖、脂质以及由此而来的醛、酮、多酚、抗坏血酸、胆固醇等)之间经缩合、聚合而生成类黑精的反应.它使食品颜色加深并赋予食品一定的风味[1],所以在工业上常用于人造香精,尤其是肉香味.长期以来,美拉德热反应香精的研究多集中在糖类和氨基酸(尤其是半胱氨酸)上,基于更高一级的肽类美拉德反应研究较少.
谷胱甘肽是由谷氨酸、半胱氨酸和甘氨酸结合而成的三肽,半胱氨酸上的巯基为其活性基团.还原型谷胱甘肽(GSH)广泛存在于自然界中,动物肝脏、酵母和植物胚芽中都有丰富的GSH.在食品加工工业中GSH也有着广泛的应用.发达国家如日本等国不仅将谷胱甘肽作为生物活性添加剂,而且积极开发其为保健食品.而抗坏血酸(ASA)普遍存在于植物性食品如蔬菜、水果中以及动物性食品如牛乳和肝中.研究GSH和ASA的美拉德反应有助于对实际食品体系生产中美拉德反应进行合理的控制和利用, 为优化加工工艺提供理论参考和技术支持.再加上ASA普遍存在及价格低廉,以及人们对热反应香料香精安全性的认可,以ASA与GSH作为前体物来制备肉味香料香精在当前越来越具有现实意义.
尿素(Urea)广泛存在于各类动物的肌肉组织中,作为精氨酸降解的中间产物或者通过酵母和细菌脱氢的产物,它也微量存在于多种发酵食品和饮料中,它在食品中的存在会严重降低食品品质.Pastoriza等人[2]在对食品进行热处理的过程中,通过消减肉品中尿素的含量从而显著地改善了食品的香气特征.可见在食品加工过程中,尿素对香味化合物的形成是有影响的.在菜品烹制过程中, 尤其是将富含 ASA 的食材与肉品共同烹制时,肉品中较高浓度的尿素也很可能对所烹制菜品的香味产生影响.因此,本文基于ASA与GSH的模式反应,研究了尿素对模式反应形成香味化合物的影响,为研制新型高象真性香料香精积累相关数据,并为深入研究抗坏血酸在Maillard反应中的作用机理提供参考.

图1 ASA与GSH在pH8和(141±2)℃反应2 h生成香味化合物的总离子图
1 实验部分
1.1 材料
L-GSH(>98%,上海源聚生物科技有限公司);ASA(分析纯,上海国药集团化学试剂有限公司);尿素(AR,上海国药集团化学试剂有限公司);C5-C22正构烷烃标准物质购自Pure Chemical Analysis Co .Ltd.;十二水合磷酸氢二钠(分析纯,上海国药集团化学试剂有限公司);NaOH(分析纯,天津福晨化学试剂厂).
1.2 实验方法
准确称取0.307 3 g(1.0 mmol)GSH、0.176 1 g(1.0 mmol)ASA分别溶于10 mL(0.2 mol·L-1)Na2HPO4溶液,在PHSJ-4A型pH计(上海金鹏分析仪器有限公司,中国)监控下用固体NaOH调溶液pH值为8.00,加入1.0 mmol的尿素,倒入P170005厚壁耐压反应瓶(北京欣维尔玻璃仪器有限公司,中国)中密封,在(141±2) ℃油浴中加热搅拌反应2 h,然后用冷水冲淋快速冷却反应瓶,置于4℃ 冰箱中保存.同时制备不添加尿素的空白样品.所有制备样平行制备2份.
取7 mL反应液置于15 mL专用萃取瓶,放入SPME装置中,在40℃下平衡15 min,然后采用CAR/PDMS(75 μm thickness)萃取头,顶空固相微萃取50 min,随之进行GC-MS分析.C5-C22正构烷烃在相同条件下被分析,以计算被检测化合物的线性保留指数(LRI).未知化合物经计算机检索同时与最新标准谱图库NIST08谱库和Wiley275谱库相匹配,对正反匹配度均大于800(最大值为1 000)的结果进一步采用线性保留指数(LRI)定性.被分离组分的TIC-Peak峰面积使用Agilent GC-MS工作站在设定积分阈值为17.0时积分获得[3].每个样品均设定两次重复,相对标准偏差<25%则视为有效.
1.3 实验条件
1.3.1 色谱条件 色谱柱:DB-5 毛细柱(30 m×0.25 mm×0.25 μm);升温程序:40℃等温保持5 min,然后5℃/min升至260℃,再15℃/min升至280℃,保持1 min;载气(He)流速0.9 mL/min;进样口温度250℃;分流模式进样,分流比5∶1.
1.3.2 质谱条件 电子轰击(EI)离子源;电子能量70 eV;接口温度280℃;离子源温度230℃;四级杆温度150℃;电子倍增电压1 753 V;质量扫描范围m/z 30~400.
2 结果与讨论
ASA与GSH反应生成香味化合物的总离子图如图1和图2所示.
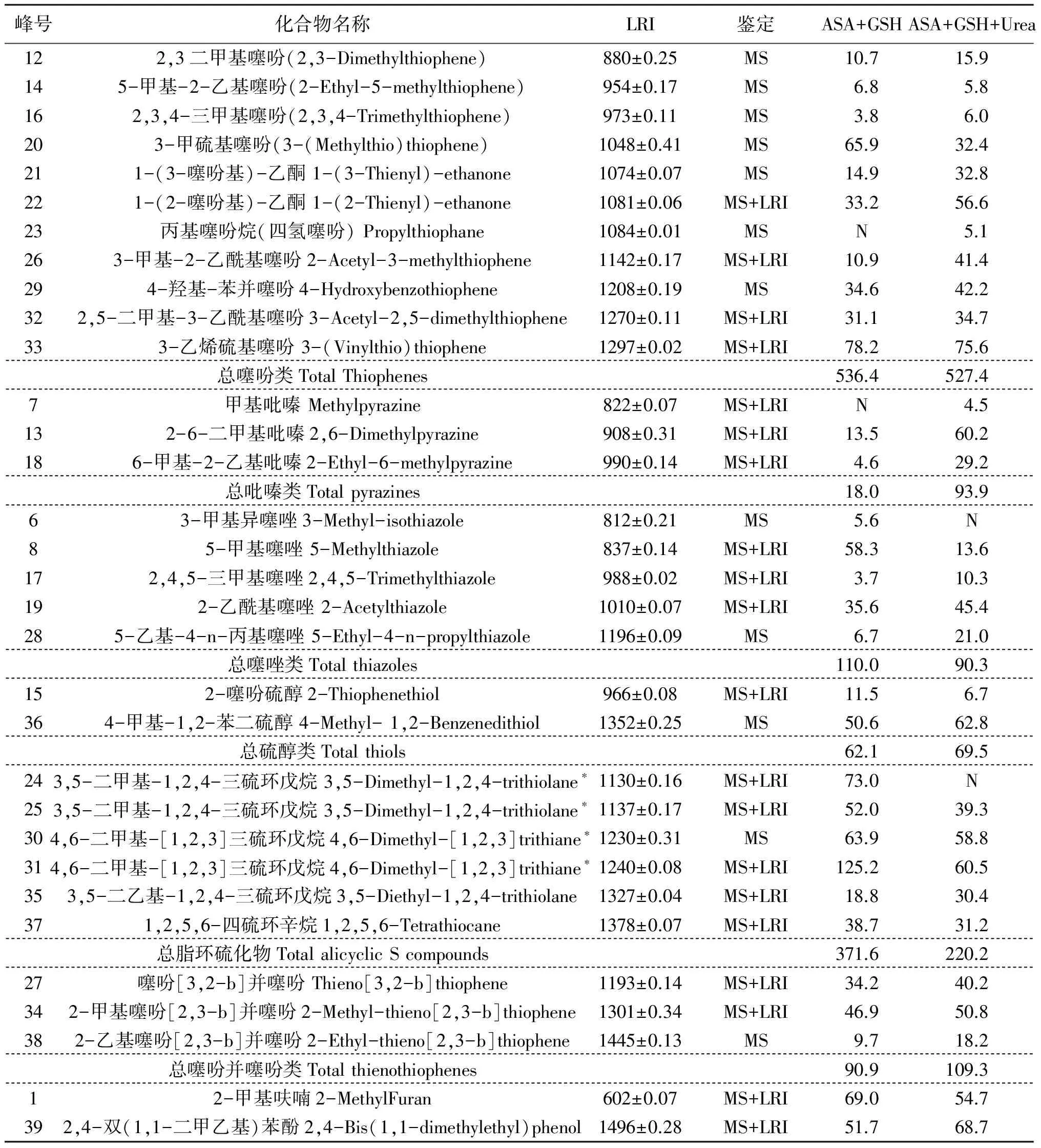
反应液具有肉香和硫磺样气味,通过对实验挥发性成分的分析鉴定,共发现了39种香味化合物,如表1所示.可分为含氧杂环呋喃类、含氮杂环的吡嗪类、含硫芳香化合物等类别.
呋喃类只有一种为2-甲基呋喃(1).含量较少,占总香味化合物量的比例不到5%.它是抗坏血酸热降解产生的[6].它在添加尿素后有所下降,但降幅不大,从6.90×107峰面积计数降到5.47×107峰面积计数.

图2 ASA、GSH与Urea在pH8和(141±2)℃反应2 h生成香味化合物的总离子图
吡嗪类共三种化合物,包括甲基吡嗪(7)、2-6-二甲基吡嗪(13)、6-甲基-2-乙基吡嗪(18).吡嗪类占总香味化合物的量不到3%,含量很少.其中甲基吡嗪被视为产生肉香的主要成分.吡嗪类添加尿素后增幅最大,从1.80×107峰面积计数到9.39×107峰面积计数.这说明尿素的加入对吡嗪类香味化合物的产量有显著的影响.
含硫芳香化合物种类较多包括噻吩类、噻唑类、硫醇类、噻吩并噻吩类和脂环多硫化物.它们是此模式反应的主要香味成分.Lu[4]用谷胱甘肽与葡萄糖在160℃下反应1 h,主要挥发性产物是含硫挥发物,如噻吩,噻唑类和脂环硫化物等.这与本实验基本一致.含硫芳香化合物拥有低嗅觉阈值,特征气味,对不同食物的肉香味有显著贡献.
模式反应噻吩类种类最多达到18种.大多数噻吩都具有特定的香味,如3-甲基-2-乙酰基噻吩(26)通常具有蜂蜜般的甜香[5],它们通常是由糠醛与H2S作用形成,或者由巯基乙醛与不饱和醛缩聚而成[6].2,5-二甲基-3-乙酰基噻吩(32)的香味能改善烟草制品的气味[5].噻吩的总量变化不大,由未添加尿素时的5.364×108峰面积计数减少至添加尿素后的5.274×108峰面积计数.
脂环硫化物是重要的产生肉香风味的一类香味分子[7],模式反应共生成了6种脂环硫化物,包括3,5-二甲基-1,2,4-三硫环戊烷(24,25)、4,6-二甲基-[1,2,3]三硫环戊烷(30,31)、3,5-二乙基-1,2,4-三硫环戊烷(35)和1,2,5,6-四硫环辛烷(37).其中的顺反3,5-二甲基-1,2,4-三硫环戊烷是典型的肉香化合物.它具有肉的特征香味,在低浓度时具有清炖牛肉的香味,高浓度时具有洋葱和硫磺样气味.一般认为,脂环硫化物主要由乙醛、 巯基乙醛和H2S缩聚而成[8].在添加尿素后几乎所有脂环硫化物的产量都显著降低,总量由未添加尿素时的3.716×108峰面积计数减少至添加尿素后的2.202×108峰面积计数.
噻唑也是重要的香味化合物,有研究表明[9],噻唑可能是由一个二羰基化合物或羟基酮、H2S、NH3和一个醛反应形成,它们对反应产物肉香味的形成也有较大贡献.噻唑类总量稍有下降由未添加尿素时的1.10×108峰面积计数减少至添加尿素后的 0.903×108峰面积计数.
模式反应中形成了两种硫醇:2-噻吩硫醇(15)和4-甲基-1,2-苯二硫醇(36),这可能是由于硫化氢和二羰基或呋喃酮相互作用形成[10].它们的总量在加入尿素后变化不大.
此外产物中还发现了三种噻吩并噻吩化合物:噻吩[3,2-b]并噻吩(27)、2-甲基噻吩[2,3-b]并噻吩(34)和2-乙基噻吩[2,3-b]并噻吩(38),其中前两种生成量较大.噻吩[3,2-b]并噻吩(29)在其他美拉德反应中也有发现[11],并已有人工合成.它们的总量在加入尿素后稍有提高,由未添加尿素时的0.909×108峰面积计数增加至添加尿素后的 1.093×108峰面积计数.

表1 抗坏血酸和谷胱甘肽美拉德反应形成的香味化合物
续表1
N: not detected*表示化合物的顺反异构体cis or trans isomer LRI:线性保留指数
综上所述,尿素的加入影响明显的是吡嗪和脂环硫化物的生成量.一般认为,吡嗪的形成产量与NH3的大量存在联系紧密[12].根据文献[13],单独的尿素( 0.10 mol/L) 在140℃密闭条件下热分解实验表明,在高温密闭体系中,尿素能够分解产生NH3.而GSH加热分解产生H2S,而H2S在加热时对生成不同含硫挥发物起了重要作用[14].Zheng等[15]报道了H2S在加热反应中参与了生成含硫芳香化合物,它是不同肉味芳香物如硫醇、噻吩、噻唑和多硫化合物的前体物.硫化氢与抗坏血酸降解产物经过一系列中间反应得到各种噻吩类、吡嗪类、硫醇类、噻吩并噻吩类.
因而,在模式体系中加入尿素将会导致反应体系中NH3的增加,NH3和H2S与ASA降解中间体发生竞争反应,结果较大地降低了脂环硫化物的产量,促进了吡嗪的生成,使模式反应终产物的总体香味特征由肉香味向兼有烤香、坚果香味的肉香转变.这说明,通过改变模式体系中尿素的浓度,可以实现对ASA-GSH模式反应产物总体香味特征的调节.
3 结论
尿素的加入较大的影响了ASA和GSH的美拉德反应产物中吡嗪和脂环硫化物的产量.GSH加热分解产生H2S,尿素分解产生NH3.NH3和H2S 与ASA降解中间体发生竞争反应,结果较大地降低了脂环硫化物的产量,促进了吡嗪的生成.通过改变模式体系中尿素的浓度,可以实现对ASA-GSH模式反应产物总体香味特征的调节.
[1] Benjakul S,Lertittikul W,Bauer F.Antioxidant activity of Maillard reaction products from a porcine plasma protein-sugar model system[J].Food Chemistry,2005,93:189-196.
[2] Pastoriza L,Sampedro G. Loss of urea from the flesh of ray (Raja radiata) during the canning process[J].J Food Sci Technol,1991,26:211-213.
[3] Yu A N.Volatiles from the Maillard Reaction of L-Ascorbic Acid and L-Alanine at Different pHs[J]. Food Sci Biotechnol,2009,18(6):1495-1499.
[4] Lu C Y.Peptide as flavor precursors in maillard reaction[D].The State University of New Jersey,2006.
[5] Yaylayan V.Flavor chemistry[M]//Francis F J.Wiley encyclopedia of food science and technology.2nd edition.New York: Wiley,2000:834-844.
[6] Baek H H,Kim C J,Ahn B H,et al.Aroma extract dilution analysis of a beeflike process flavor from extruded enzyme-hydrolyzed soybean protein[J].Agric Food Chem,2001,49: 790-793.
[7] Ohloff G, Flament I. Heterocyclic constituents of meat aroma[J]. Heterocycles,1978,11:663-695.
[8] Chen Y,Ho C- T.Effects of carnosine on volatile generation from Maillard reaction of ribose and cysteine[J].Agric Food Chem,2002,50:2372-2376.
[9] Elmore J S,Mottram D S,Enser M,et al.Novel thiazoles and 3-thiazolines in cooked beef aroma[J].Agric Food Chem,1997,45:3603-3607.
[10] El-massry K, Farouk A, El-Ghorab A.Volatile constituents of glutathione-ribose model system and its antioxidant activity[J].Amino Acids,2003,24:171-177.
[11] Chen Y,Ho C-T.Effects of carnosine on volatile generation from Maillard reaction of ribose and cysteine[J].J Agric Food Chem,2002,50:2372-2376.
[12] Wang P S,Odell G V.Formation of pyrazines from thermal treatment of some amino-hydroxy compounds[J]. Agric Food Chem,1973,21:868-870.
[13] 刘应煊,余爱农.尿素对抗坏血酸-半胱氨酸模式反应形成香味化合物的影响[J].精细化工,2011,28(8):780-785.
[14] 王延平,赵谋明, 彭志英,等.美拉德反应产物抗氧化性能研究进展[J].食品与发酵工业,1997,24(1):70-73.
[15] Zheng Y,Brown S, Walter O L,et al.Formation of sulfur-containing compounds from reactions of furaneol and cysteine, glutathione, hydrogen sulfide, and alanine/hydrogen sulfide[J].Agric Food Chem,1997,45:894-896.
