RNA干扰抑制端粒酶反转录酶对晶状体上皮细胞增殖的影响△
2012-01-04蒋永祥吴新华卢奕
蒋永祥 吴新华 卢奕
白内障术后后囊膜混浊(posterior capsule opacification,PCO)的发生机制是术后由于炎性反应和血-房水屏障破坏,在大量分泌的细胞外基质及各种细胞因子的参与下,残余晶状体上皮细胞(lens epithelial cell,LEC)在后囊膜上增殖、迁移及上皮-间质转化[1-2]。因此,抑制LEC增殖是预防PCO发生的重要环节。白内障LEC中的端粒酶活性和端粒长度明显大于正常组,而晶状体摘除术后PCO模型中,赤道部囊膜组织、后囊膜LEC中均可检测到端粒酶活性[3-4]。抑制端粒酶活性可达到抑制细胞增殖及诱导细胞凋亡的目的。RNA干扰(RNA interference,RNAi)通过人为引入与内源靶基因具有相同序列的小双链RNA,诱导内源性靶基因降解,达到阻止基因表达的目的,是一项快速、高效、便于操作的使靶基因失活技术[5]。本研究通过端粒酶反转录酶(telomerase reverse transcriptase,TERT)RNAi技术抑制LEC TERT,达到抑制LEC增殖的目的,以期为进一步抑制白内障术后PCO提供实验依据。
1 材料与方法
1.1 材料 人LEC株(SRA 01/04)购自美国ATCC公司。视网膜色素上皮细胞(retinal pigment epithelial cell,RPEC)由本实验室制备。TERT小分子干扰RNA(small interfering RNA,siRNA)、阴性对照siRNA及转染试剂盒为美国Ambion公司产品。
1.2 方法
1.2.1 TERT siRNA的设计和合成 根据基因库中TERT mRNA序列(NM003219),设计和合成针对TERT显性失活突变体区的siRNA。序列如下,正义链:5′-CAAGGUGGAUGUGACGGGCTT-3′,反义链: 3′-TTGUUCCACCUACACUGCCCG-5′。经基因库检索,与TERT以外的基因序列无同源性。
1.2.2 LEC和RPEC TERT mRNA表达的检测 将LEC 和RPEC放入含15%胎牛血清、2 mmol/L谷氨酰胺、80万U/L青霉素及1 g/L链霉素的达尔伯克改良伊格尔培养液(Dulbecco’s modified Eagle’s medium,DMEM)中,置于37 ℃、5%CO2培养箱中培养。细胞生长汇合后按1∶2传代,将对数生长期的细胞以4×105细胞/孔的浓度接种于六孔板内,采用半定量反转录聚合酶链反应(reverse transcriptional polymerase chain reaction,RT-PCR)法,提取每处理孔细胞总RNA。TERT引物:5′-GCCAGAACGTTCCGCAGAGAAAA-3′,5′-AATCATCCACCAAACGCAGGAGC-3′。反应条件为94 ℃ 20 s、48 ℃ 30 s 、72 ℃ 30 s,30个循环。设立空白阴性对照组,甘油醛-3-磷酸脱氢酶(GAPDH)作为内参照。取PCR产物于1%琼脂糖凝胶中电泳,紫外线照相并扫描分析。
1.2.3 TERT siRNA对LEC内源性TERT表达的影响 取培养的LEC,以4×105细胞/孔的浓度接种于六孔板内,加入不含抗生素的DMEM(含15%胎牛血清)2 mL进行培养,以便转染时细胞达到90%~95%汇合。按LipofectamineTM2000脂质体转染试剂盒说明调整TERT siRNA至终浓度为50 nmol/L,加入细胞;继续培养48 h后收获细胞,抽提细胞总RNA,反转录,实时PCR检测TERT基因表达的变化。
1.2.4 TERT siRNA对转染LEC和RPEC增殖抑制作用的观察 取培养的LEC和RPEC,以4×105细胞/孔的浓度接种于六孔板内,加入不含抗生素的DMEM(含15%胎牛血清)2 mL进行培养;调整TERT siRNA至终浓度为50 nmol/L,加入细胞;48 h后,消化细胞1/3传代;60 h,再次使用TERT siRNA(终浓度为50 nmol/L)转染细胞;96 h,细胞计数试剂盒8(cell counting kit-8,CCK-8)检测细胞增殖能力的变化;按杨晋等[6]介绍的方法检测LEC和RPEC的细胞活性,每组细胞做4组平行样。
1.3 统计学处理 采用SPSS 13.0统计学软件进行数据分析,数据以均值±标准差表示。采用成组设计t检验,P<0.05为差异有统计学意义。
2 结果
半定量RT-PCR检测LEC和RPEC内源性TERT mRNA的表达,结果显示RPEC中检测不到TERT的表达,LEC中可检测到低水平的TERT表达(图1)。
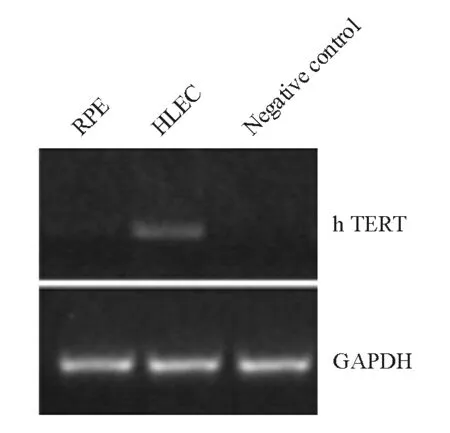
图1. LEC和RPE中内源性TERT mRNA的表达
TERT siRNA处理LEC 48 h后,实时PCR检测TERT基因表达的变化:LEC对照组TERT mRNA相对表达水平为1.00±0.03,LEC siRNA组TERT mRNA相对表达水平为0.20±0.01,两组相比差异有统计学意义(t=-38.40,P<0.05)。
TERT siRNA处理LEC、RPEC 96 h后,CCK-8检测2种细胞的增殖抑制情况显示:LEC对照组活性为0.79±0.02,LEC siRNA组为0.55±0.04,两组差异有统计学意义(t=7.18,P<0.05);RPEC对照组活性为1.16±0.01,RPEC siRNA组为1.13±0.04,两组差异无统计学意义(t=0.81,P>0.05)。
3 讨论
染色体端粒DNA的长度是由端粒增长(端粒酶合成)和缩短(细胞分裂时DNA复制)的平衡来维持的,其中端粒酶活性对维持端粒长度及细胞长期生存有重要意义。端粒酶的激活使端粒长度不断延长,细胞获得无限增殖能力,可成为永生化细胞。因此,端粒酶的激活与恶性肿瘤的发生、发展或增殖活跃的组织细胞密切相关。端粒酶由端粒酶RNA成分、端粒酶相关蛋白1和TERT三部分组成。端粒酶RNA成分、端粒酶相关蛋白1在许多缺乏端粒酶活性的正常组织中表达,与端粒酶表达无相关性。TERT是端粒酶的催化亚单位,是决定端粒酶活性的限速决定因子,与端粒酶表达呈一致性[7]。TERT mRNA只在恶性肿瘤组织或肿瘤细胞株以及某些有高度再生潜力的自我更新组织中表达。
在既往我们的实验中,建立兔PCO模型,取赤道部囊膜组织、混浊后囊膜,检测两者LEC端粒酶活性,发现兔晶状体赤道部囊膜组织、后囊膜均可检测到端粒酶活性,兔PCO模型LEC中端粒酶活性较赤道部囊膜LEC低[4]。
RNAi技术主要是通过siRNA来执行其阻断体内特定基因表达的功能,siRNA在细胞内与靶基因特异性结合并使之降解。目前合成siRNA分子有化学合成、体外转录等体外合成法以及以质粒或病毒类载体介导的体内表达法。
LEC中可检测到低水平的TERT表达,本实验通过体外合成TERT siRNA干扰TERT基因,抑制人LEC端粒酶活性。结果显示:转染TERT siRNA的LEC,其TERT mRNA相对表达水平明显下降,提示TERT siRNA抑制了其端粒酶活性。同时,细胞增殖实验结果表明,TERT siRNA处理96 h后的LEC,CCK-8检测其增殖活性明显抑制。可见,TERT siRNA在抑制端粒酶活性的同时也抑制了细胞增殖。
在正常体细胞中,除生殖细胞和造血干细胞等极少数细胞外,均检测不到端粒酶活性。已有研究[8]证明,眼内晶状体纤维细胞、角膜上皮细胞、内皮细胞和睫状体无色素细胞中未发现端粒酶表达。我们的实验也证实RPEC中未检测到TERT表达。转染TERT siRNA 96 h后,RPEC的增殖活性也未受到影响。
因此,抑制LEC端粒酶活性,可有效抑制LEC的增殖,对眼内其他组织细胞影响较小,这可能是抑制白内障术后后囊膜混浊一个较有前途的治疗方法。
[1]Nishi O.Posterior capsule opacification.Part 1: experimental investigations[J].J Cataract Refract Surg,1999,25(1): 106-117.
[2]黎晓新.眼科学新进展[M].北京:中华医学电子音像出版社,2009:123-127.
[3]黄文丽,蒋永祥,吕志刚.兔晶状体超声乳化后囊膜混浊模型的建立与观察[J] .中国眼耳鼻喉科杂志,2011,1(1):13-14.
[4]吕志刚,黄文丽,蒋永祥,等.端粒酶活性在兔后囊膜混浊晶状体上皮细胞中的表达及意义[J].中华眼科杂志,2008,44(10):902-905.
[5]Hannon GJ. RNA interference[J].Nature,2002,418(6894):250-255.
[6]杨晋,卢奕,郭礼和,等.慢病毒介导的单纯疱疹病毒胸苷激酶基因/丙氧鸟苷体系抑制人晶状体上皮细胞的研究[J].中华眼科杂志,2007,43(9):810-816.
[7]Morin GB.The human telomere terminal transferase enzyme is a ribonucleoprotein that synthesizes TTAGGG repeats[J].Cell,1989,59(3):521-529.
[8]Colitz CM,Davidson MG,McGAHAN MC.Telomerase activity in lens epithelial cells of normal and catamctous lenses[J].Exe Eye Res,1999,69(6):641-649.
