微生物谷氨酰胺转胺酶的乳糖诱导表达与纯化
2012-01-04何冬兰邵坤彦尚敏邦
何冬兰,邵坤彦,叶 程,黄 俊,尚敏邦
(中南民族大学生命科学院生物工程实验室,武汉 430074)
谷氨酰胺转胺酶(TG)是一种能够催化蛋白质分子与分子间及分子内部酰基进行转移的酶[1].它不仅是一种新型的食品添加剂,还能促进伤口愈合、表皮分化、毛囊蛋白质架桥、胰岛素分泌,诱导细胞分化,催化介导细胞凋亡,识别癌变细胞组织等[2-5].源于微生物的谷氨酰胺转胺酶(MTG)对底物特异性要求低,分子中无Ca2+结合位点[6],适用于工业化生产[7].
目前利用大肠杆菌PET系统生产重组MTG多在培养过程中添加IPTG(异丙基β-D-硫代半乳糖苷)诱导获得.但IPTG有潜在的毒性且价格较贵,在大规模的发酵生产中应用受限.国内外研究者发现乳糖作为诱导剂表达大肠杆菌重组产物的优越性,Sarduy[8]等利用乳糖诱导表达的恶性疟原虫半胱氨酸蛋白酶(falcipain-2)菌体密度是用IPTG诱导表达的1.5倍,Yi[9]等在优化T7系统控制的谷氨酸变位酶S时发现乳糖比IPTG更高效.本实验利用乳糖代替IPTG诱导MTG表达,优化适合重组MTG大肠杆菌pET22b-MTG/E.coliBL21(DE3)的诱导表达条件, 证实了以乳糖作诱导剂,对T7lac启动子控制的重组目的产物可获得很好的诱导表达效果,并利用亲和层析等技术实现了MTG蛋白的纯化.
1 材料与方法
1.1 材料与仪器
pET22b-MTG/E.coliBL21(DE3)及PCR引物1972R,0317R由中南民族大学生命科学学院分子微生物学实验室保存.蛋白marker(美国Bio-Rad公司),Ni Sepharose resin(美国GE公司),DEAE Sephadex A-50(Amersham公司),Sephadex G-75(武汉生命科技公司),咪唑、TEMED(美国Sigma公司),GSH、GSSG、DTT、β-巯基乙醇(德国Merck公司),BamHⅠ、HindⅢ(日本TAKARA公司),其余为国产分析纯.
自动凝胶图像分析仪(JS-380A,上海培清科技公司),PCR仪(Biometra公司),垂直板电泳仪(DYCZ-24DN,北京六一仪器厂),超声波细胞破碎机(宁波新芝生物科技公司),HD-4电脑核酸蛋白检测仪、DBS-160电脑全自动部分收集器、HL-2B数显恒流泵(上海沪西分析仪器厂),LC-20AT HPLC(LC-20AT,日本岛津公司),扫描仪(Epson Perfection 4990 Photo,日本爱普生公司).
1.2 方法
1.2.1 重组菌的鉴定
取1年以上重组菌株,提取质粒,取3 μL质粒DNA,加1 μL 10×K buffer,0.5 μLBamHⅠ,0.5 μLHindⅢ,5 μL ddH2O,37 ℃酶切过夜,取5 μL溶液用0.8%琼脂糖凝胶电泳检测.
另取1 μL重组质粒DNA ,加入5 μL PCR buffer,1 μL dNTP,引物各0.5 μL,0.3 μL Taq DNA聚合酶,18 μL ddH2O.PCR条件为:94 ℃预变性5 min;94 ℃ 1 min,56 ℃ 1 min,72 ℃ 1 min,循环29次;72 ℃ 10 min,4 ℃保温40 min.取3 μL产物用0.8%琼脂糖凝胶电泳检测.
1.2.2 pET22b-MTG自诱导培养及条件的优化
将1%(体积比)的pET22b-MTG接种在含100 μg/mL氨苄的自诱导培养基[10](含10 g/L胰蛋白胨,5 g/L酵母浸粉,10 g/L NaCl,0.32 g/L葡萄糖,一定含量的乳糖,4.4 g/L甘油,25 mmol/L KH2PO4,17.7 mmol/L Na2HPO4,2 mmol/L MgSO4)中,220 r/min,26 h,37℃,发酵过夜,定时取样测定A600,初步确定菌株的生长曲线,并与IPTG诱导的生长曲线相比较.条件优化后取样作SDS-PAGE分析并测蛋白浓度:(1)最佳培养温度的确定:在乳糖自诱导条件下,分别将4个50 mL的摇瓶置25,28,37,45℃培养20 h,取1.0 mL菌液;(2)乳糖浓度的确定:分别配置含乳糖0,0.8,1.2,1.6 g/L的乳糖自诱导培养基,接种1% pET22b-MTG,分别在18,20 h时取样;(3)乳糖诱导时间的确定:从培养10 h起,隔2 h取样一次;(4)诱导pH的确定:调整培养基的pH值分别为6.0,6.5,7.0,7.5,8.0,8.5,接种后18 h取样.
1.2.3 升温诱导对pET22b-MTG的影响
在8个50 mL的乳糖诱导培养基中,同时接种1%的pET22b-MTG/E.coliBL21(DE3).除对照瓶外,其余分别在0,10.5,11.5,12.5,13.5,14.5,15.5 h时放入50℃摇床热诱导1 h,并于28℃摇床培养至18 h,取样检测.
1.2.4 目的蛋白定位
在最优条件下诱导表达pET22b-MTG/E.coliBL21(DE3),取25 mL发酵液,12000 rpm离心15 min,用10 mL洗涤液(140 mmol/L NaCl,2.7 mmol/L KCl,10 mmol/L Na2HPO4,1.8 mmol/L KH2PO4,pH 7.4)洗涤后,加2 mL裂解液(50 mmol/L Tris-HCl,0.5 mmol/L EDTA,50 mmol/L NaCl,10%甘油,5 mmol/L DTT,pH 8.0),混匀1 h,超声破碎仪破胞,离心取上清,沉淀用包涵体溶解液(50 mmol/L Tris-HCl,1 mmol/L EDTA,0.15 mol/L NaCl,8 mol/L 尿素,5 mmol/L DTT,pH 7.5)溶解.可溶性蛋白和包涵体蛋白分别作SDS-PAGE确定表达产物的分布.
1.2.5 表达产物的纯化
收集可溶性蛋白50 mL,0.22 μm滤膜过滤,超声去气泡.用缓冲液(20 mmol/L PBS,20 mmol/L NaCl ,pH 6.5)冲洗Sephadex G-75柱子至基线水平后,上样,用同一缓冲液洗脱,收集A280洗脱峰检测.
50 mmol/L PBS缓冲液(pH 7.5)冲洗DEAE Sephadex A-50柱,上样后依次用含0.05,0.10,0.15,0.20,0.30,0.50,0.80,1.00,2.00 mol/L NaCl的PBS缓冲液洗脱,收集A280洗脱峰检测.
清洗HPLC通路,将Ni+葡聚糖凝胶柱与HPLC连接,用脱气的二次水洗涤凝胶柱至基线水平.用上样缓冲液(20 mmol/L Tris-HCl,0.5 mol/L NaCl,pH 7.4)平衡后上样,再用上样缓冲液洗涤Ni柱,待基线水平后,进洗脱缓冲液(20 mmol/L Tris-HCl,0.5 mol/L NaCl,10 mmol/L 咪唑,pH 7.4),收集A280洗脱峰检测.
1.2.6 MTG的酶活测定与蛋白质浓度测定
按照Grosswicz[11]等的方法测定纯化过程中酶活,37℃时,每分钟催化产生1 μmol L-谷氨酰-γ-单氧肟酸的酶量定义为一个单位谷氨酰胺转胺酶的酶活.
2 结果与分析
2.1 重组菌pET22b-MTG/E.coli BL21(DE3)的质粒双酶切鉴定与PCR鉴定
pET22b-MTG的质粒提取后经电泳检测结果见图1.由图1可见,1、 2、3泳道显示两条约6.7kb和4.0 kb的电泳条带,pET22b-MTG的质粒约6750bp.
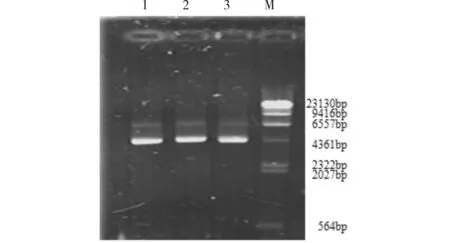
Lane1-3:重组质粒;M:λDNA/HindⅢ marker
质粒DNA经BamH I、Hind III双酶切过夜孵育后结果见图2.由图2可见,1、2、3、4泳道出现两条约5.5 kb和1.3 kb的电泳条带.而pET22b和MTG片段的大小分别为6750 bp和1257 bp,与电泳条带大小相符,证明MTG基因已成功与pET22b载体连接.

M:λDNA/HindⅢ marker;Lane 1~4:重组质粒
pET22b-MTG的质粒DNA经PCR扩增后(见图3),于1257 bp处呈亮带,证明重组菌中的MTG目的片段已被成功插入载体.

图3 重组质粒PCR电泳图
2.2 诱导条件的优化
2.2.1 生长曲线的初步测定
乳糖(0 h添加)和IPTG(14 h添加)诱导pET22b-MTG/E.coliBL21(DE3)菌株的生长曲线见图4.由图4可见,12 h前菌体生长均较缓慢,14 h 添加IPTG,此时菌株A600=0.552.26 h时3组菌均进入稳定期,IPTG诱导的菌株A600=1.862,与对照(无诱导剂)A600=1.702无明显差别;而乳糖诱导的菌株A600=2.135,明显高于其他两组.
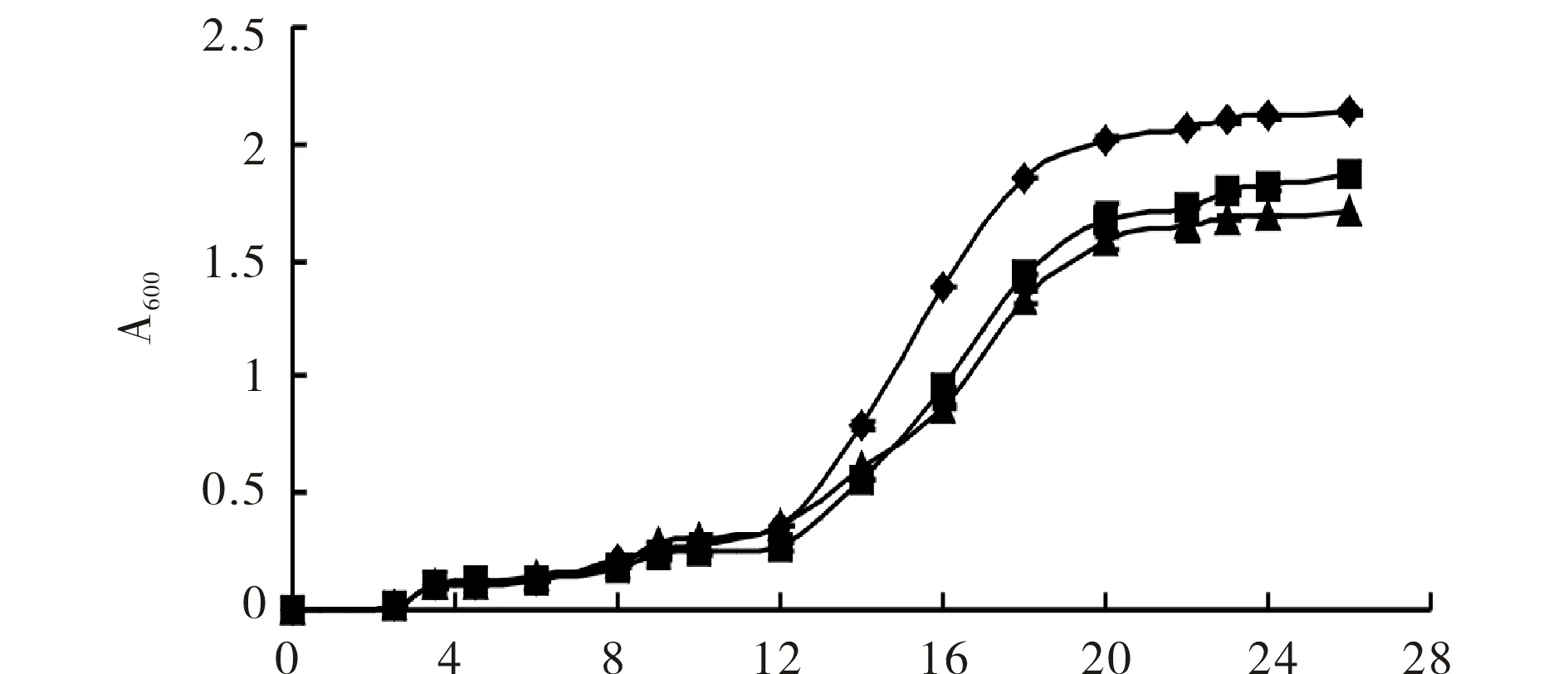
t/h
2.2.2 诱导温度的确定
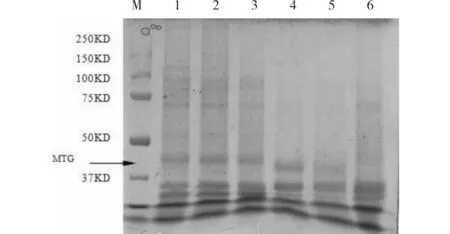
不同温度下MTG表达量的SDS-PAGE结果见图5.经BandScan 5.0软件分析蛋白条带得MTG相对表达量,用Bradford法[12]测定总蛋白表达浓度,结果见图6.由图5可见,28℃下(Lane 3)MTG表达量最大.由图6可见,MTG相对表达量与总蛋白表达量在28℃时均有最大值;37℃时,总蛋白的量较大,而MTG的表达量不高,证明重组菌最佳诱导温度是28℃.

M:Protein marker;Lane 1:45℃;Lane 2:37℃;Lane 3:28℃;Lane 4:25℃

图6 不同温度下的MTG相对表达量和总蛋白浓度
2.2.3 乳糖浓度的确定
20h、18h时不同浓度的乳糖诱导MTG的SDS-PAGE和总蛋白表达量的测定结果分别见图7、图8.由图7可见,当乳糖的浓度为1.2 g/L,培养18 h(Lane 6)蛋白的表达量较高.由图8可见,MTG最高相对表达量为20.4%,在18 h时总蛋白的表达量为12.5 g/L.

Lane 1:20 h,1.6 g/L乳糖;M:Protein marker;Lane 2~4:1.2,0.8,0 g/L乳糖(20 h);Lane 5~8:1.6,1.2,0.8,0 g/L乳糖(18 h)
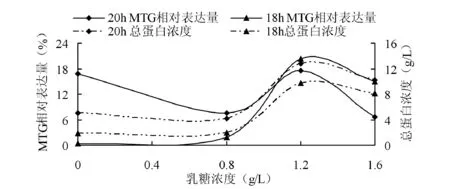
图8 不同乳糖浓度下的MTG相对表达量和总蛋白浓度
2.2.3 诱导时间的确定
乳糖诱导不同时间后的MTG的SDS-PAGE和表达量分析结果分别见图9、图10.由图9、图10可见,18 h(Lane 2)后,MTG的表达量最高,其相对表达量为24%,此时总蛋白的浓度为18.69 g/L.

Lane 1~6:20,18,16,14,12,10h;M:Protein marker

图10 不同诱导时间下的MTG相对表达量和总蛋白浓度
2.2.4 诱导pH的确定
在不同pH值下菌株经乳糖诱导18 h后,SDS-PAGE电泳结果和蛋白表达量分析见图11和图12.由图11、图12可见,当诱导的pH为7.0(Lane 4)时,MTG的相对表达量最大,为11.2%,此时总蛋白浓度是9.54 g/L.
M:Protein marker;Lane 1~6:pH 8.5,8.0,7.5,7.0,6.5,6.0

图12 不同pH下的MTG相对表达量和总蛋白浓度
2.2.5 升温起始时间的确定
在不同起始时间开始升温诱导MTG表达,SDS-PAGE电泳结果与蛋白表达分析见图13和图14.由图13、图14可见,当乳糖诱导培养11.5 h(Lane 4)时,升温至50℃诱导1 h再放入28℃培养,MTG表达量增大,其相对表达量为23.6%,总蛋白浓度为14.53 g/L.

Lane 1:对照;Lane 2~8:0,10.5,11.5,12.5,13.5,14.5,15.5 h时开始诱导1 h;M:Protein marker

图14 不同时刻升温MTG相对表达量和总蛋白浓度
2.2.6 乳糖诱导与IPTG诱导的比较
乳糖诱导与IPTG诱导的比较结果见图15.由图15可见,乳糖诱导MTG的表达量(Lane 2)明显高于IPTG诱导MTG的表达量(Lane 1),经软件分析前者是后者的3.7倍.同时测得IPTG和乳糖诱导条件下的蛋白浓度分别为7.24 g/L和18.8 g/L,乳糖诱导的菌体总蛋白浓度是IPTG诱导的2.6倍.说明可用乳糖替代IPTG诱导本工程菌株.在50~75KD之间出现了两个条带,是由于在升温过程中某些热激基因被激活.

M:Protein marker;Lane 1:IPTG诱导MTG;Lane 2:乳糖诱导MTG
2.3 MTG的定位与纯化
2.3.1 MTG的定位
将全菌、可溶性蛋白与包涵体蛋白分别进行SDS-PAGE电泳后结果见图16.由图16可见,MTG主要存在于pET22b-MTG上清液中(Lane 3),有利于进一步的纯化.

Lane 1:pET22b-MTG全菌;Lane 2:pET22b-MTG包涵体溶解液;Lane 3:pET22b-MTG上清蛋白;Lane 4:pET22b全菌液;M:Protein marker
2.3.2 MTG的凝胶过滤分离
将pET22b-MTG上清溶液用一次性针头滤器过滤后,进行Sephadex G-75凝胶过滤层析,结果见图17.由图17可见两个洗脱峰,1、2洗脱峰为非均一对称的单峰.经酶活检测,MTG位于2峰中.
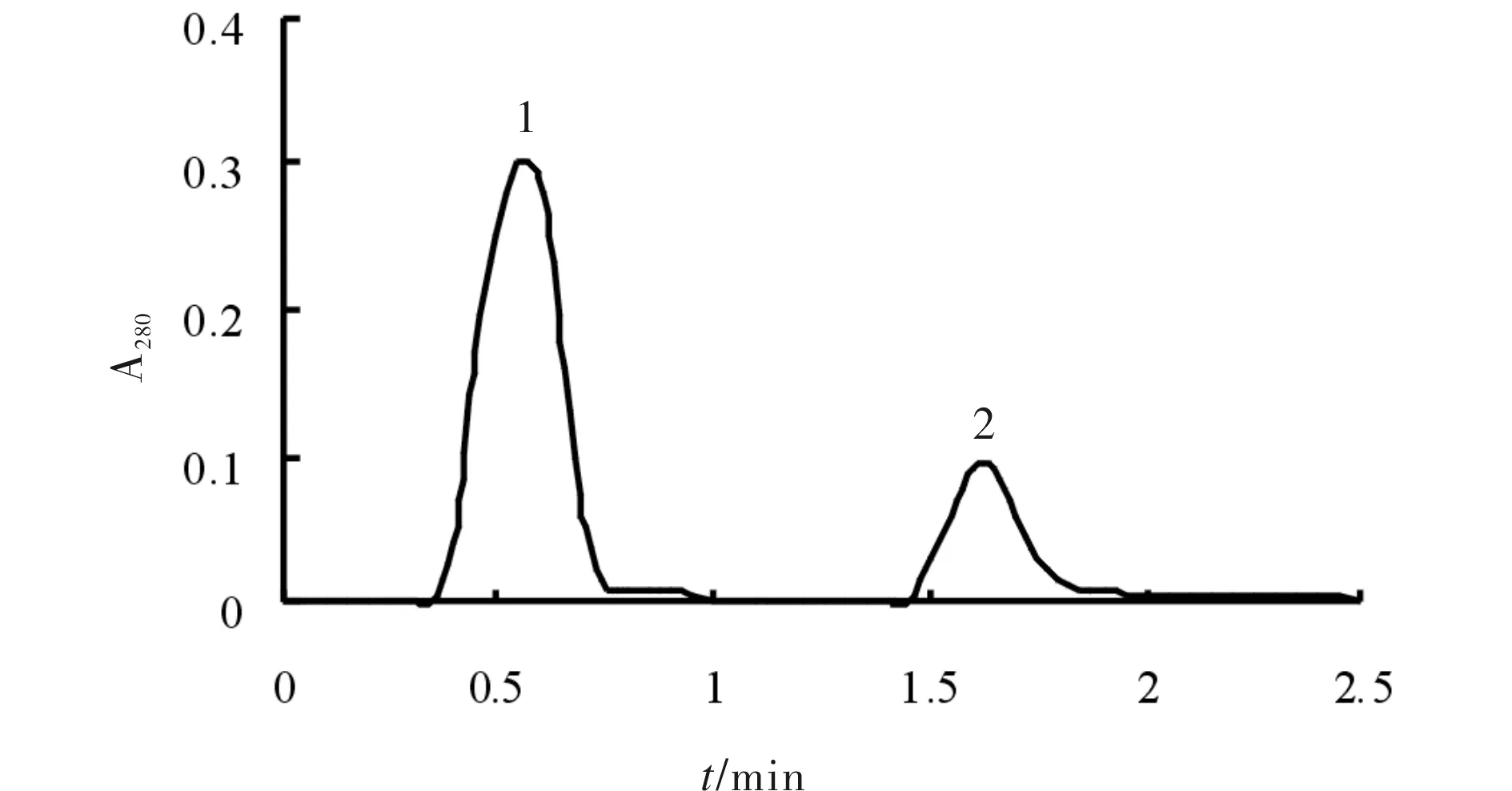
图17 MTG蛋白凝胶过滤洗脱谱图
2.3.3 MTG的离子交换分离
MTG的离子交换分离的结果见图18.由图18可见,当洗脱溶液中的盐离子浓度为0.1,0.5,0.8,1.0,2.0 mol/L时均出现了洗脱峰,经酶活检测,0.8 mol/L的洗脱峰有酶活,收集并进行亲和层析分离.

图18 MTG蛋白离子交换洗脱谱图
2.3.4 MTG的亲和层析分离
MTG的亲和层析分离的结果见图19.由图19可见,用Ni柱分离酶液时出现了单一峰,该峰曲线平滑且左右对称,证明该处洗脱的蛋白较纯.

图19 MTG蛋白Ni柱洗脱峰
2.3.5 MTG纯化后的检测
MTG经凝胶过滤、离子交换及亲和层析后,将多批次纯化的终酶液合并,取样进行SDD-PAGE电泳,结果见图20.由图20可见,在47KD处出现了单一条带,标志着MTG已达到电泳纯状态.

Lane 1:纯化后的酶液;M:Protein marker
2.4 MTG的酶活与蛋白浓度的测定
取超声破碎后上清,凝胶过滤、离子交换、Ni柱纯化后酶液测定结果见表1.由表1可知,凝胶过滤后的酶液由于稀释倍数大,酶活为0.66 U/mL,低于上清中的酶活;但比活力(1.05 U/mg)为上清(0.16 U/mg)的6.5倍.随着酶蛋白溶液的逐次纯化,比活力值逐渐升高,终酶液的比活力为10.91 U/mg,纯化倍数为初始上清的68.2倍.

表1 MTG蛋白纯化情况
3 讨论
本文对重组MTG工程菌pET22b-MTG /E.coliBL21(DE3)的乳糖诱导条件进行优化,确定了适合重组菌生长和MTG蛋白表达的条件,其中乳糖浓度为1.2 g/L,pH为7.0,在28℃诱导18 h,培养11.5 h时升温表达量最大.培养过程中采取28℃→50℃→28℃的变温模式,最终获得了浓度为18.8 g/L的表达产物.
常规的温度诱导模式是:当菌体生长到一定密度时,将培养条件从30 ℃升高至42 ℃,由于42 ℃时cI857基因失活,解除阻遏后的启动子开始启动外源基因的表达[13].而谷氨酰胺转胺酶本身具有较高的热稳定性,最适温度为50 ℃左右,在45~55 ℃范围内都具有较高的活性.丁满生[14]等在研究温度诱导模式对重组大肠杆菌质粒拷贝数的影响时确立了二次升温诱导模式,发现二次升温诱导与一次升温诱导相比表达量提高了80%.
本文对重组菌乳糖诱导后,提取可溶性蛋白溶液,再经凝胶过滤、离子交换、亲和层析,获得纯度较高的MTG,与最初有活性的酶液相比,纯化了近70倍.但由于只研究了一步升温诱导对重组菌pET22b-MTG /E.coliBL21(DE3)的影响,不同温度诱导模式对重组菌的影响可待进一步的研究.
[1]王书平,刘俊华.谷氨酰胺转胺酶的研究进展[J].湖南农业科学,2010,(15): 41-43.
[2]Verma A,Mehta K.Tissue transglutaminase-mediated chemoresistance in cancer cells.Drug Res Update [J].2007,10(4): 144-151.
[3]Han I,Park H J,Seong S C,et al.Role of transglutaminase 2 in apoptosis induced by hydrogen peroxide in human chondrocytes[J].J Orthop Res,2011,29(2): 252-257.
[4]Griffin M,Casadio R,Bergamini C M.Transglutaminases:nature’s biological glues[J].J Biochem,2002,368(Pt 2): 377-396.
[5]谈 丹,陈 雄,黄敬华,等.微生物谷氨酰胺转胺酶对大鼠创伤愈合作用研究[J].中国生物工程杂志,2007,27(9):85-90.
[6]Taguchi S,Nishihama K I,Igi K,et al.Substrate specificity analysis of microbial transglutaminase using proteinaceous protease inhibitors as natural model substrates[J].J Biochem,2000,128(3): 415-425.
[7]Noda S,Miyazaki T,Tanaka T,et al.Production ofStreptoverticilliumcinnamoneumtransglutaminase and cinnamic acid by recombinantStreptomyceslividanscultured on biomass-derived carbon sources[J].Bioresour Technol,2012,104: 648-651.

[9]Yi P W,Fang C H,Wun S Y,et al.Optimization of the overexpression of glutamate mutase S component under the control of T7 system by using lactose and IPTG as the inducers[J].Enzyme Microb Technol,2006,38(3-4): 465-469.
[10]Studier F W.Protein production by auto-induction in high density shaking cultures[J].Protein Expr Purif,2005,41(1): 207-314.
[11]Grosswicz N,Wainfan E,Borek E,ed al.The enzymatic formation of hydroxamic acids from glutamine and asparagines[J].J Biol Chem,1950,187(1):111-125.
[12]Bradford M M.A Rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Anal Biochem,1976,72(1-2):248-254.
[13]Villaverde A,Benito A,Viaplana E,et al.Fine regulation of cI857-controlled gene expression in continuous culture of recombinantEscherichiacoliby temperature[J].Appl Environ Microbiol,1993,59(10): 3485-3487.
[14]丁满生,马文峰,郭美锦,等.温度诱导模式对重组大肠杆菌质粒拷贝数的影响[J].华东理工大学学报:自然科学版,2006,32(1): 33-37.
